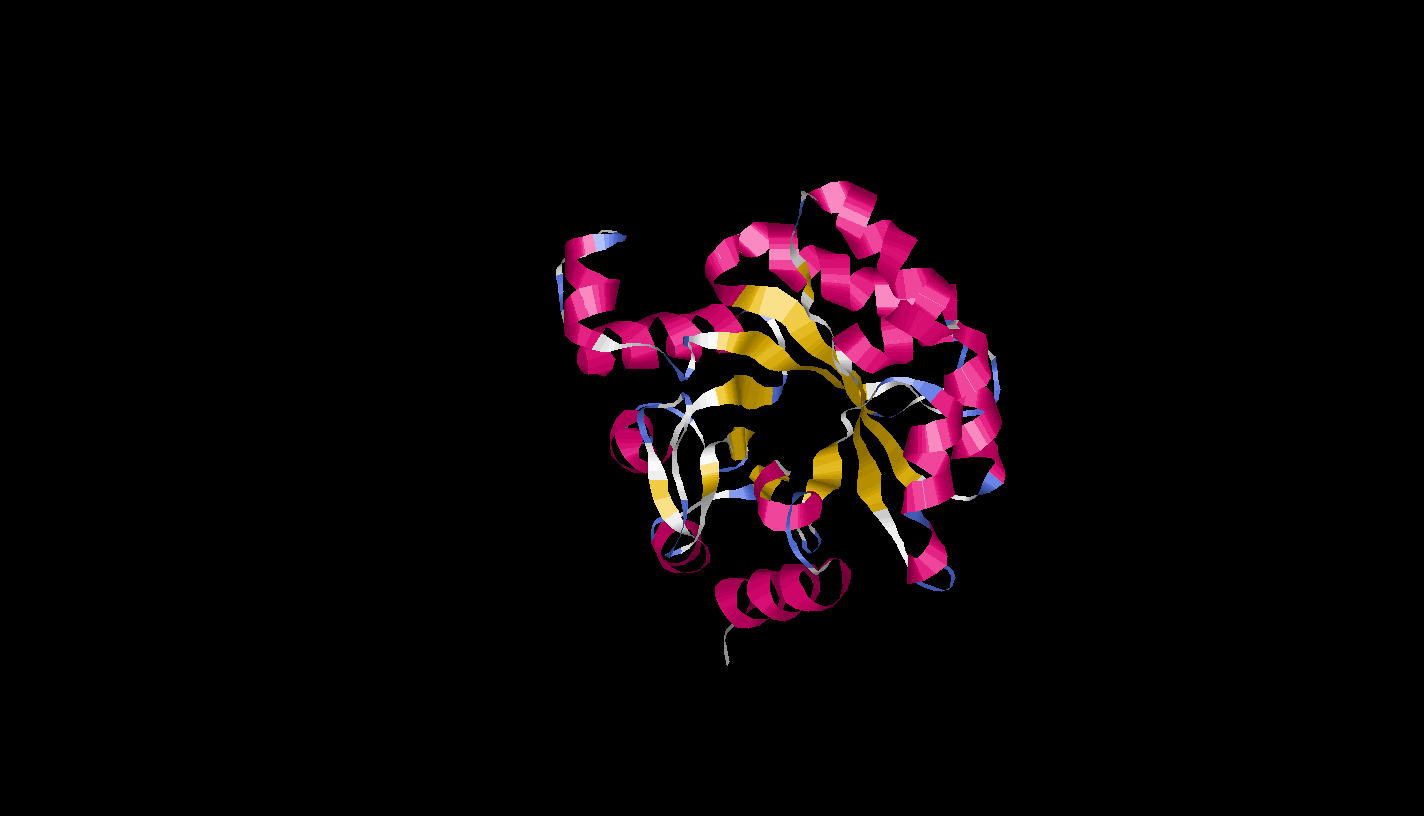Занятие 13: исследование вторичной структуры заданного белка
- Общее описание вторичной структуры белка
А Цепь белка похож на торус, где α-спирали находяться на периферии, а β-складки в центральном кольце
Количество водородных связей: 168
Количество α-спиралей: 14
Количество β-складок: 11
Количество β-поворотов: 24
А цепь orotidine 5'-phosphate decarboxylase (Оротидин 5`-фосфат декарбоксилазы) представляет собой α/β белок, так как четко видно правильное чередование α-спиралей и β-структур. -
вторичная структура:
α-спираль 223-235:A,
параллельные β-тяжи 84-88:A и 115-119:A
антипараллельные β-тяжи 100-106:A и 114-109:A (для белка с листами 1bs2 BACSU)
Петля круто поворачиваеться на 180 градусов на фрагменте 107-113:A - Задание 3
первое изображение
второе изображение
На обеих картинках показаны ВСЕ водородные связи в А-цепи, это не опечатка и не ошибка.
β-атомы располагаються точно по спирали, если на α-спираль смотреть сверху
H(4k,4(k+1)), H(3k,3(k+1)), H(2k,2(k+1)), k-целое число, таких связей было большинство. - Задание 4
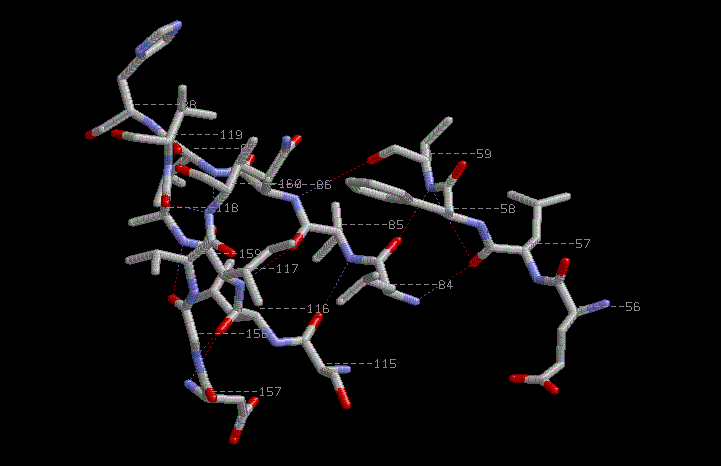
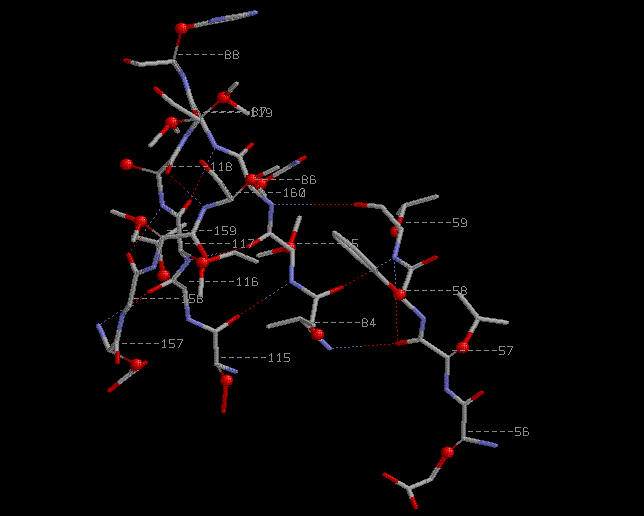
β-Структуры из множества: 84-88:A or 115-119:A or 157-160:A or 56-59:A
C-β атомы расположены слева и справа от плоскости листа по очереди.
β-структуры
β-структуры с выделенными Cβ атомами
- Задание 5
Поворот цепи
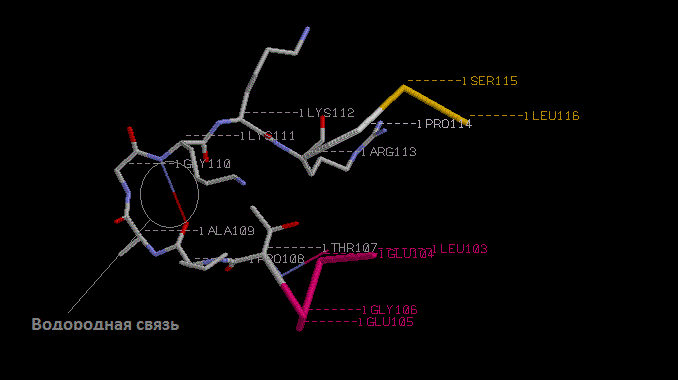
поворот происходит на множестве — THR107-PRO108-ALA109-GLY110-LYS111-LYS112-ARG113-PRO114
Между атомами N-лизина111 и О-пролина108 есть водородная связь, скрепляющая поворот
© Matvey Zaharov