Работа выполнялась в помощью базы данных OPM. Описание случайных трех бета-баррелей и трех спиральных трансмембранных белков, которые нашлись в OPM:
| PDB код
|
Тип
|
Какая мембрана
|
Толщина гидрофобной части мембраны в ангстремах
|
Медиана числа остатков в одном трансмембранном участке
|
| 3szd
|
баррель
|
внешняя мембрана грам-отрицательных бактерий
|
22.0
|
7
|
| 3fid
|
баррель
|
внешняя мембрана грам-отрицательных бактерий
|
25.6
|
9
|
| 2y0l
|
баррель
|
внешняя мембрана грам-отрицательных бактерий
|
21.4
|
6
|
| 3vga
|
спираль
|
эукариотическая плазмалемма
|
30.4
|
21
|
| 4dkl
|
спираль
|
эукариотическая плазмалемма
|
32.0
|
23
|
| 2knc
|
спираль
|
эукариотическая плазмалемма
|
34.8
|
25
|
Поиск и описание белка с заданным PDB кодом.
Данного мне белка 3ODY вообще не оказалось ни в одной из баз данных по мемебранным белкам.
В описании PDB не встречается упоминания, что он - мембранный. Возможно,
в таблице приведен ошибочный код? По этой причине я взяла для анализа резервный белок 3RKO.
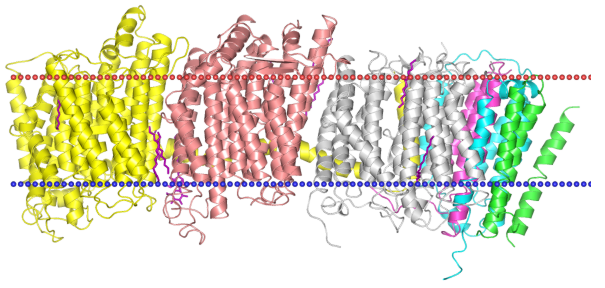
Данный белок с PDB ID 3RKO является респраторным комплексом I.
Он относится к типу трансмембранных белков, класса полиптотических альфа-спиралей,
суперсемейству комплекс I электронно-транспортной цепи (НАДН дегирогеназа), семейству
НАДН дегидрогеназ, транслоцирующих H+ и Na+ (код TC 3.D.1).
Его структура и расположение в мембране, картинки взяты из OPM:

Расшиифровка TC кода:
3. - первичные активные транспортеры,
3.D. - окислительно-управляемые транспортеры,
3.D.1. - НАДН дегидрогеназы, транслоцирующие H+ и Na+.
Некоторая инфомация в виде таблицы:
| PDB ID |
Организм |
Тип мембраны |
TC-код |
Наклон спиралей к нормали |
Количество трансмембранных спиралей (бета-тяжей в бочонке) |
Название белка |
Толщина гидрофобной мембраны (A) |
Медиана количества остатков в спиралях |
3 |
3RKO |
Escherichia coli |
внутренняя мембрана грам-отрицательных бактерий |
3.D.1 |
9 |
Дыхательный комплекс I |
29.6 |
18 (19 для цепи M) |
Поиск гомологов.
Поиск гомологов осуществлялся с помощью PSI-BLAST на сервере NCBI,
в 3 итерации, вывод 1000 хитов, порог E-value 1e-5. Выбраны представители разных таксонов, как эукариот, так и прокариот.
Поиск осуществлялся в базе данных Swiss-Prot, во всех таксонах, кроме филума протеобактерий, к
которому относится Escherichia coli BL21(DE3) (организм данного белка с PDB ID 3RKO).
Для анализа предлагалась цепь M. Именно по её последовательности проводился поиск и отбор гомологов.
Множественное выравнивание.
Множественное выравнивание осущствлялось с помощью muscle, встроенным в JalView.
Окрашивание было произведено по гидрофильности-гидрофобности, с измененным порогом на консервативность.
Размечены спирали и трансмембранные участки.
Полуенное выравниание и 3D-структура цепи M белка 3RKO, окрашивание по гидрофобности.
Но с такой раскраской нельзя увидеть преобладающие аминокислоты. Во втором выравнивании окарска подобрана так, чтобы неполярные остатки были белого цвета,
а полярные и/или заряженные - ярких цветов.
Тот же файл, но окраска по остатками задана мною.
Из выравниваний видно, что трансмембранные участки содержат больше неполярных алифатических аминокислот. Пример: участок выравнивания 118-138, в котором встречаются из
полярных незаряженных - серин, треонин, цистеин и всего один глутамин, из заряженных - один аспартат, один аргинин, один гистидин и два лизина. Остальные остатки - неполярные
алифатические или ароматические.
Встречаются случаи (например, позиция 222), когда в трансмембранном участке - консервативная заряженная аминокислота, в данном случае глутамат.
Возможно, он играет важную роль в формировании всего белкового комплекса или в исполнении функций, потому что расположен "с боку" цепи белка, а значит,
должен взаимодействовать с чем-то,
иначе стремился бы "спрятаться" внутрь цепи от гидрофобного окружения мембраны.
По разметке трансмембранных участков и спиралей видно, что они не совпадают точно.
Более того, некоторые спирали вообще не являются трансмембранными, например, со внешней стороны мембраны выступает спираль 286-294 в выравнивании и следующая за ней.
С внутренней стороны мембраны выступают спирали участка 495-556 выравнивания.
Ещё раз, картинка всего комплекса, цепь M выделена зеленым, сверху внешняя сторона клетки:
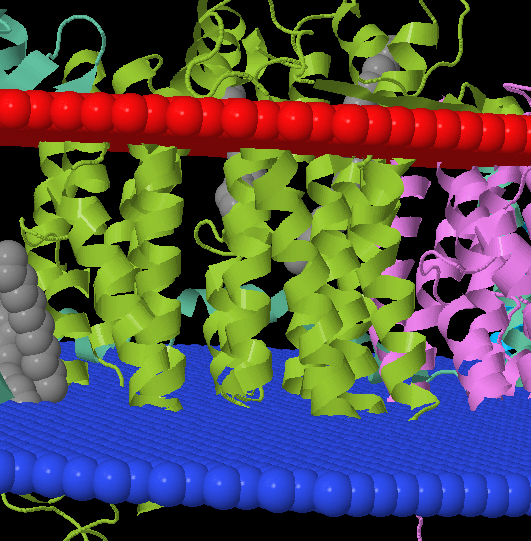
То есть цепь расположена как-то так:

Какую-либо систему между + или - зарядом аминокислот и стороной мембраны заметить не получается, возможно, из-за плохого качества работы и окраски.



