Задание 1. Работа с ЯМР структурой.
Выбор структуры
Критерии поиска PDB:
| Метод получения: ЯМР |
Experimantal method: SOLUTION NMR |
| Более 1 модели в записи |
Number of models: > 1 |
| В цепи более 60 остатков |
Chain length: between 60 and - |
| Получена в 2014 году |
Release Date: between 2014-01-01 and 2014-12-31 |
Результат: 288 структур.
|
Выбранная структура:
|
3ZPD
|
| Метод получения | SOLUTION NMR |
| Количество моделей | 25 |
| Количество остатков в цепи | 158 |
| Дата релиза | 2014-02-12 |
Структура подходит под все критерии, а главное, содержит аспарагин и глутаминовую кислоту на достаточно близком расстоянии. Успех, продолжаем работать с этой структурой.
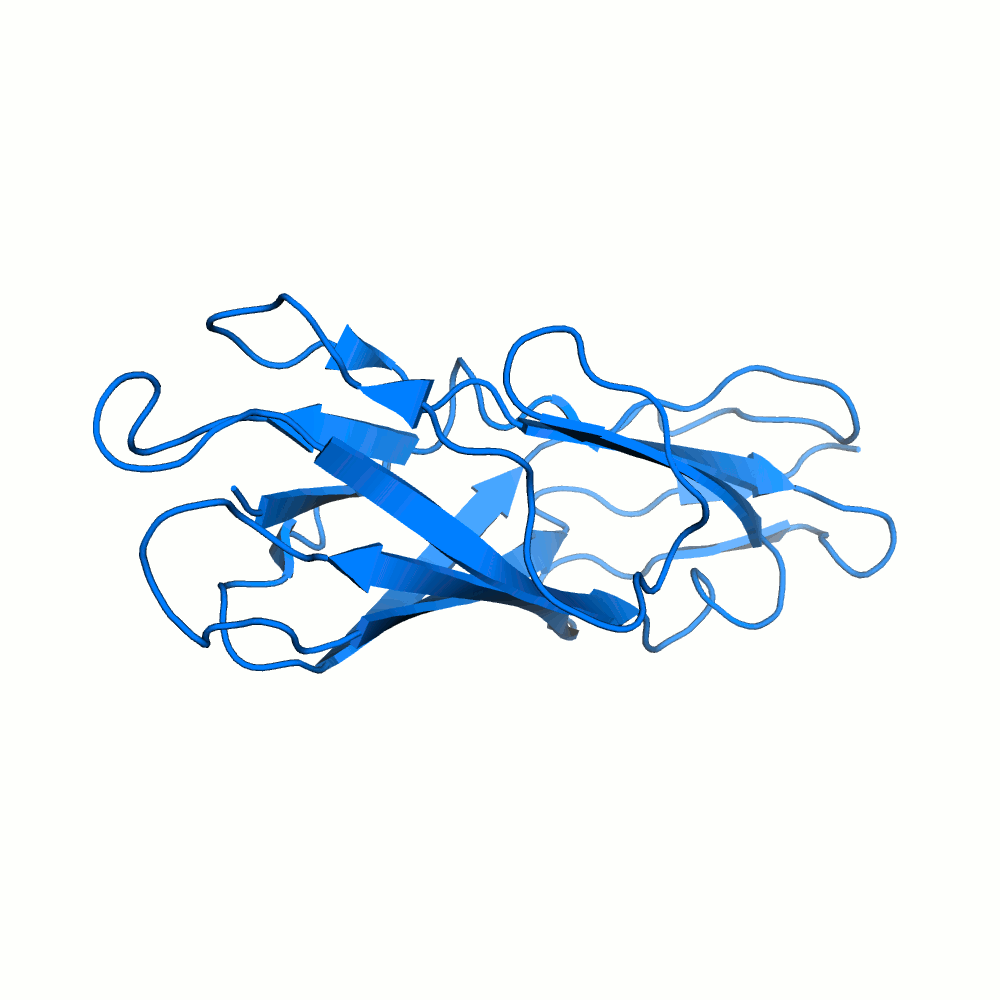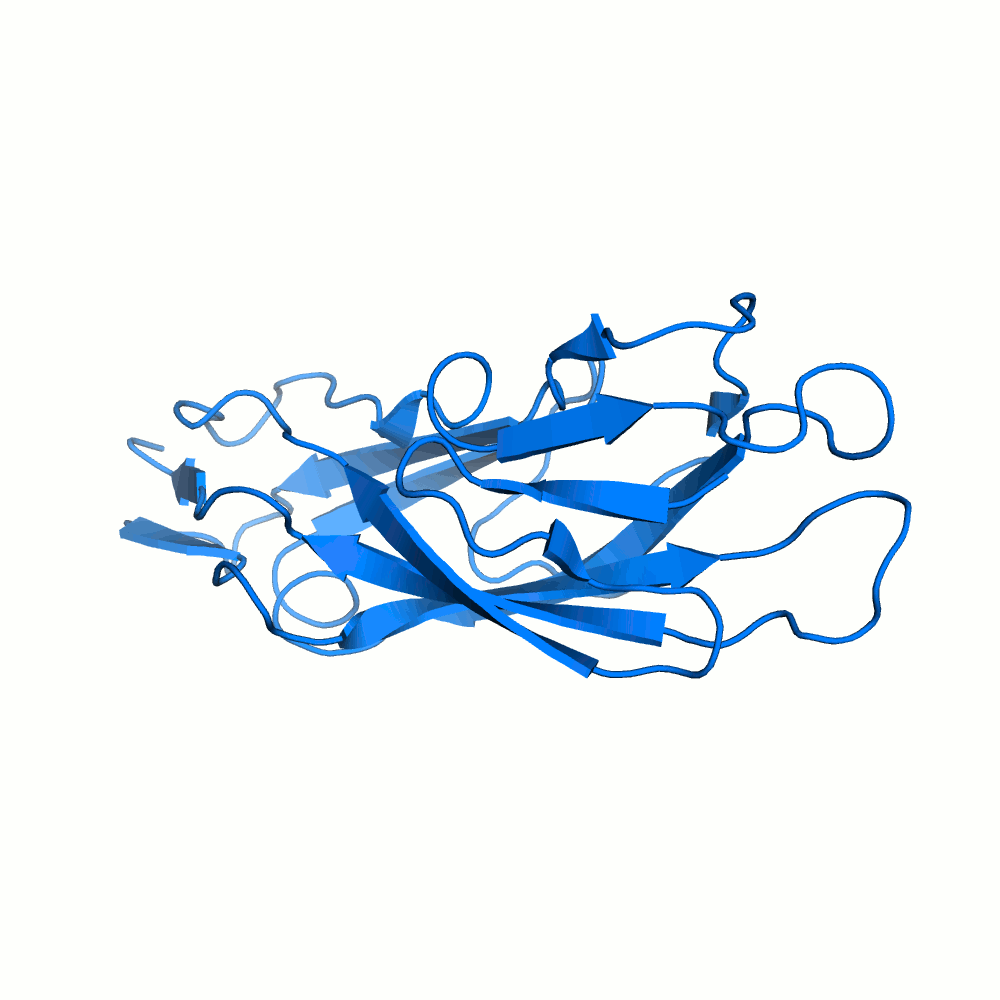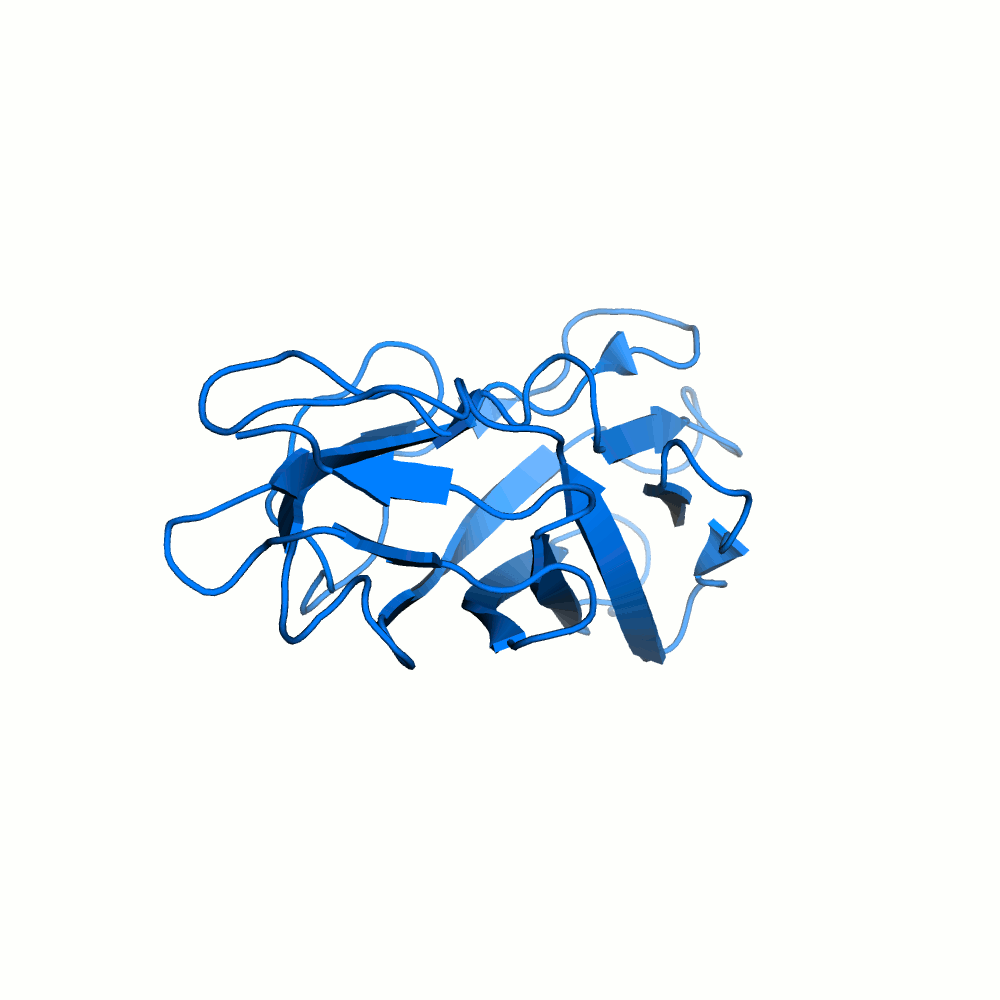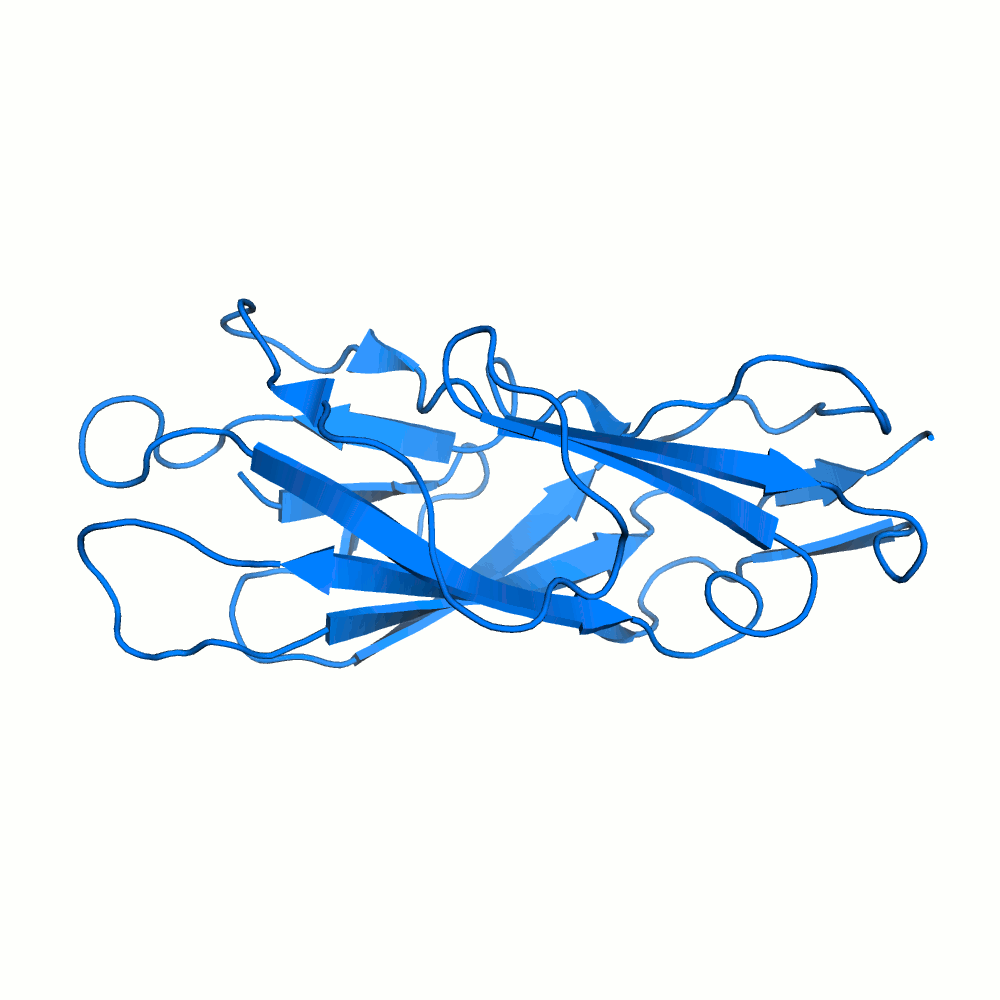
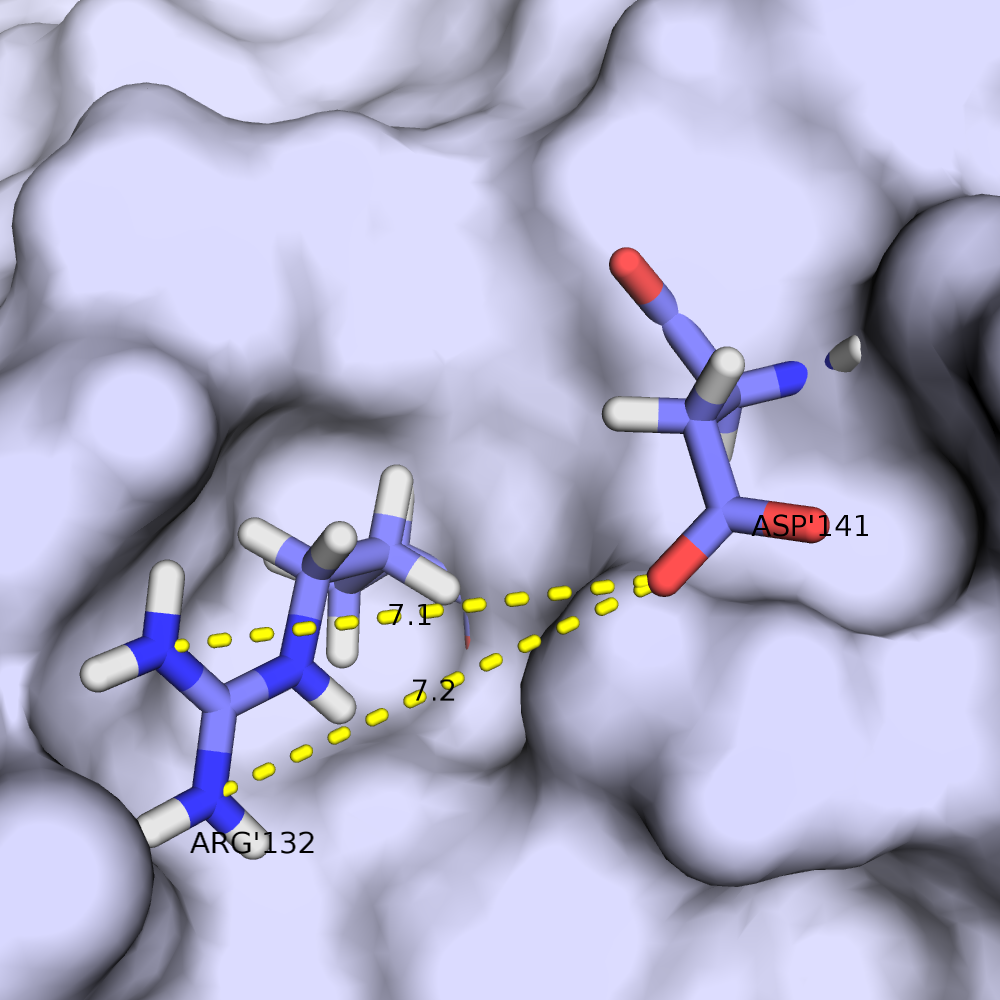
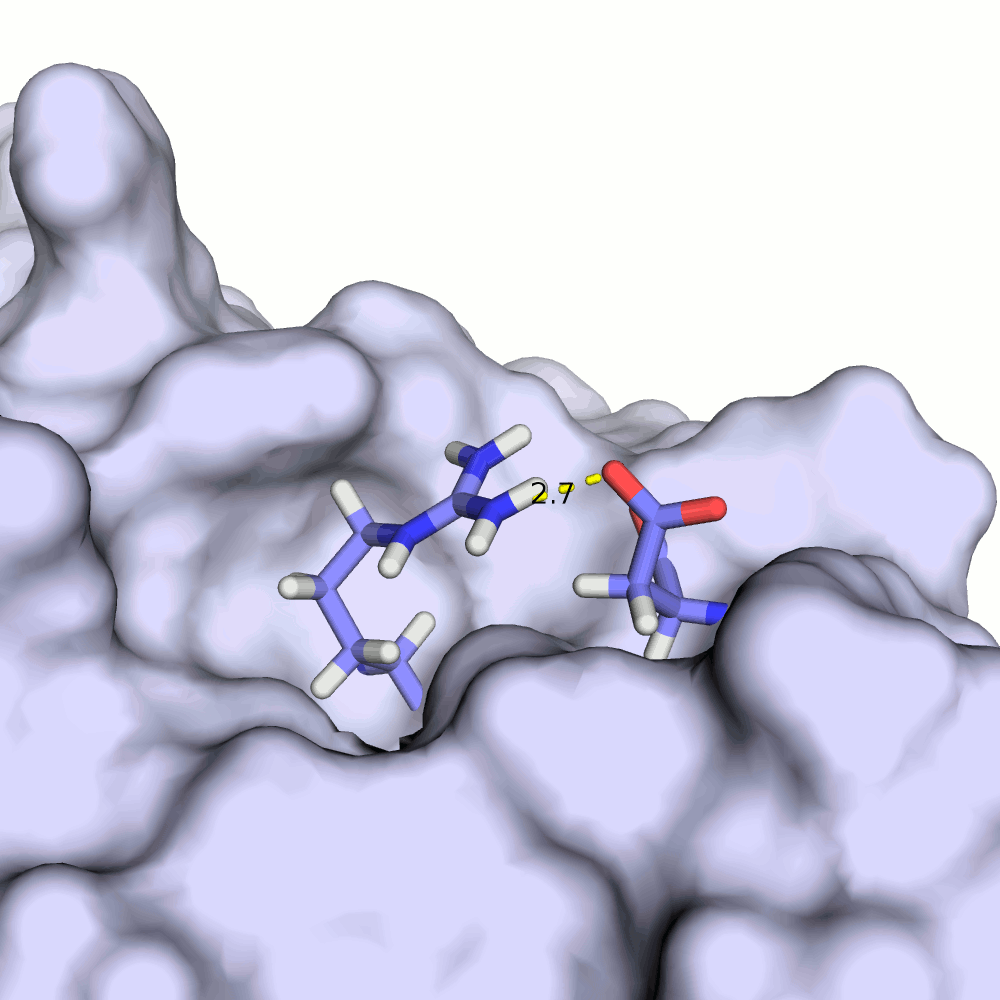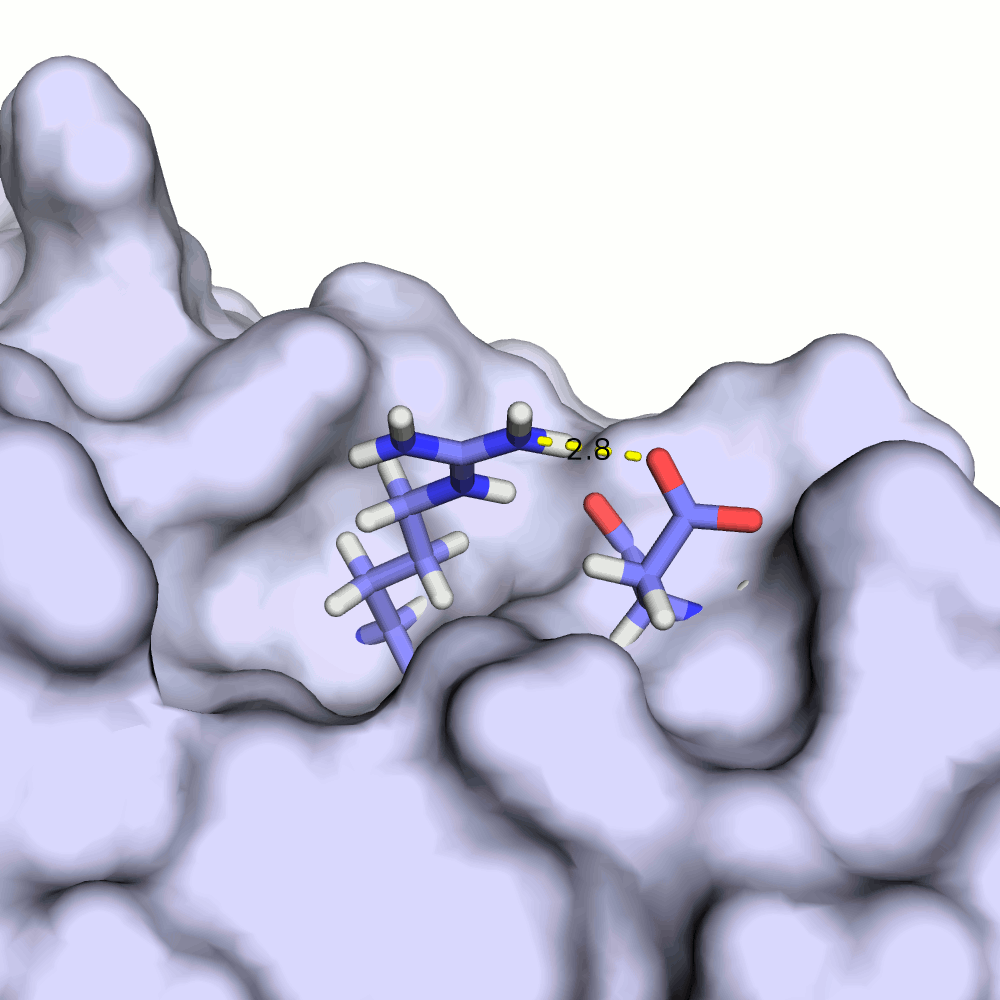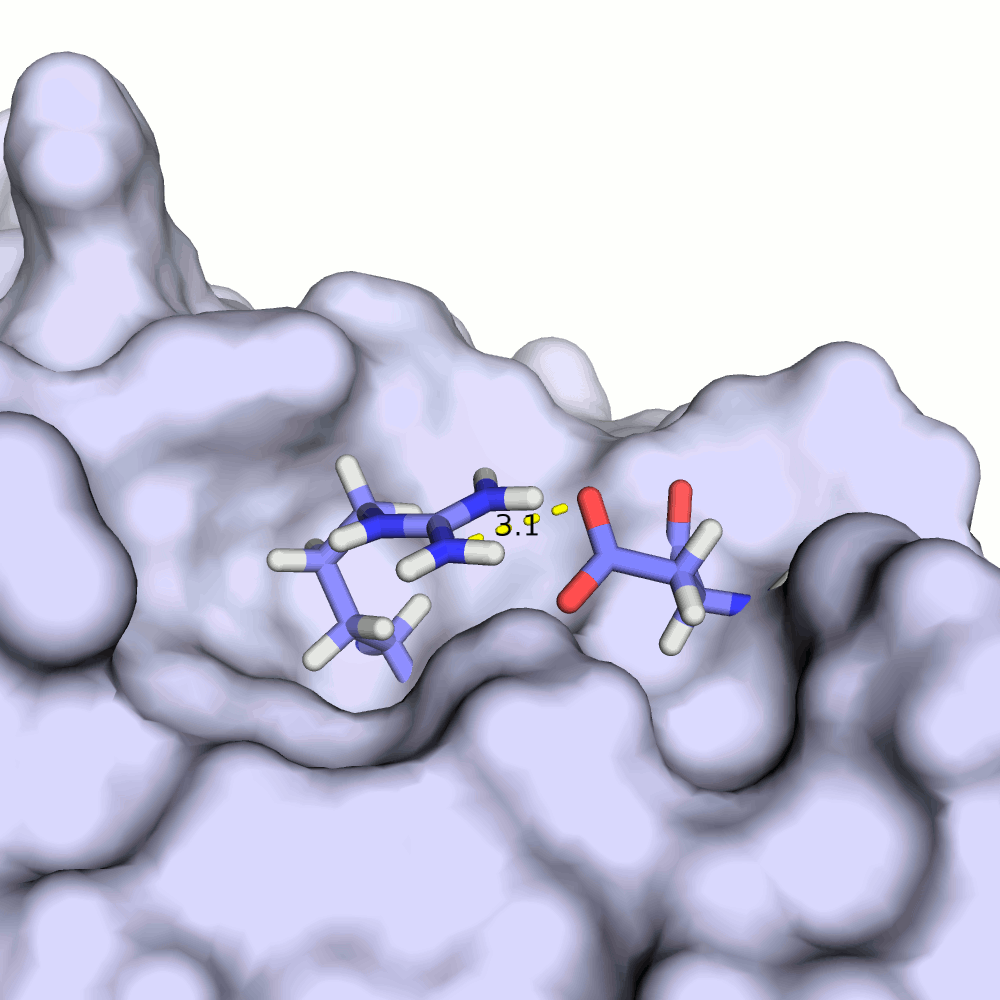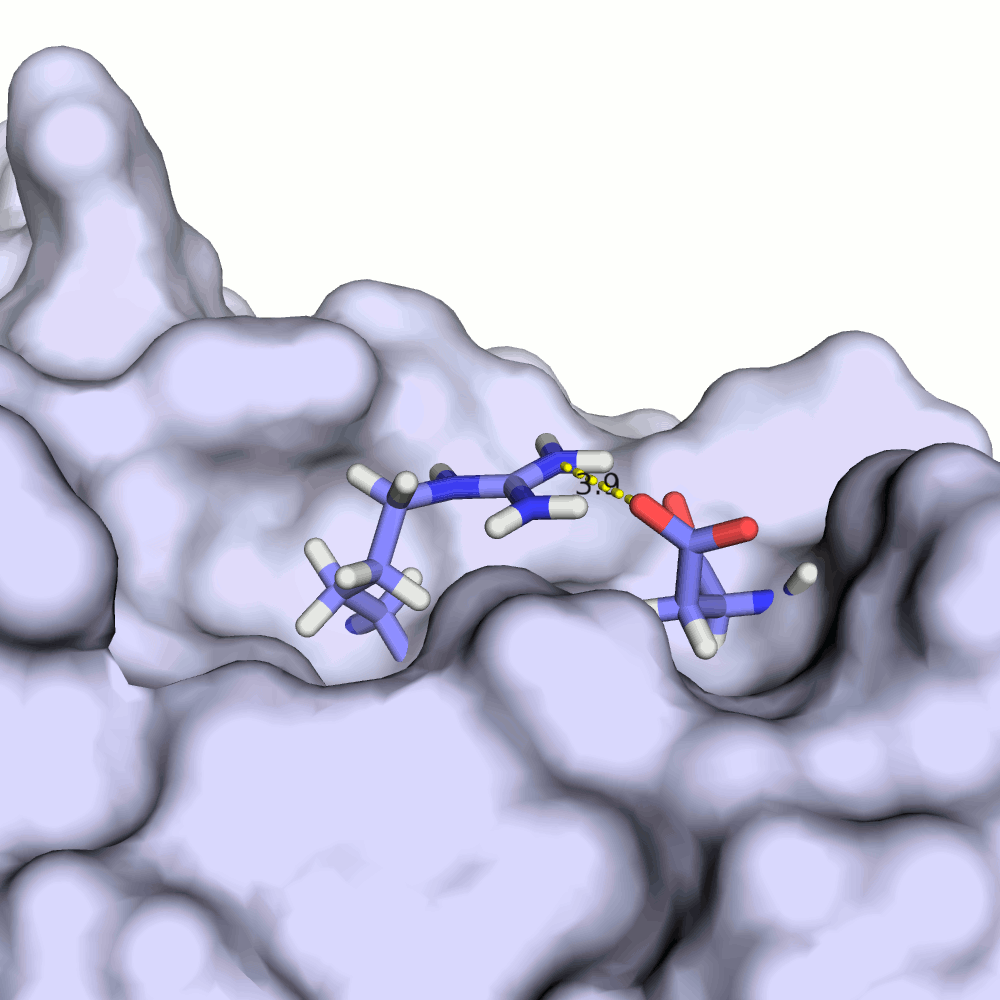
Водородная связь в разных моделях одной ЯМР-структутры
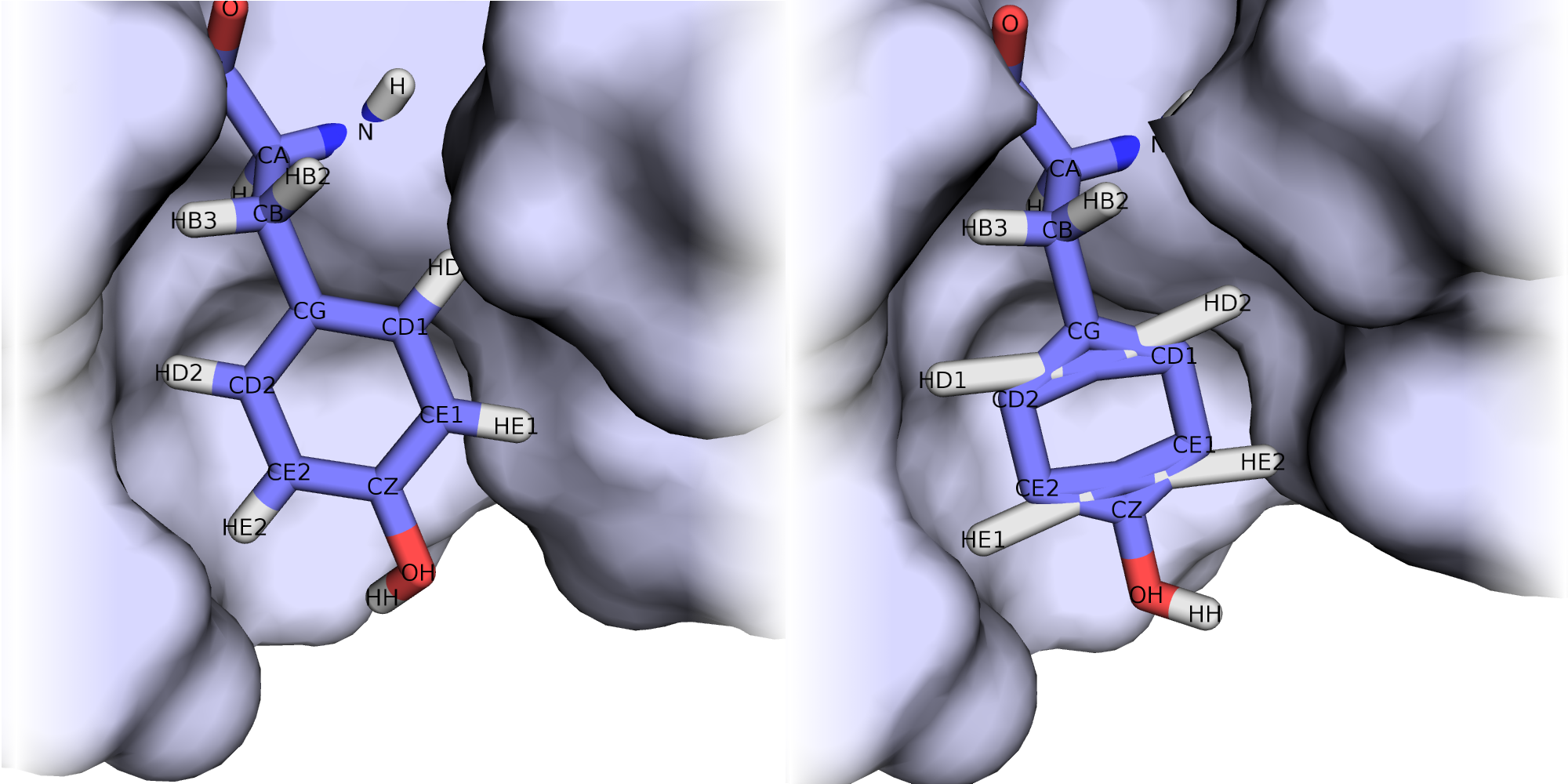
Для рассмотрения выбрана пара аминокислотных остатков ARG'132 и ASP'141.
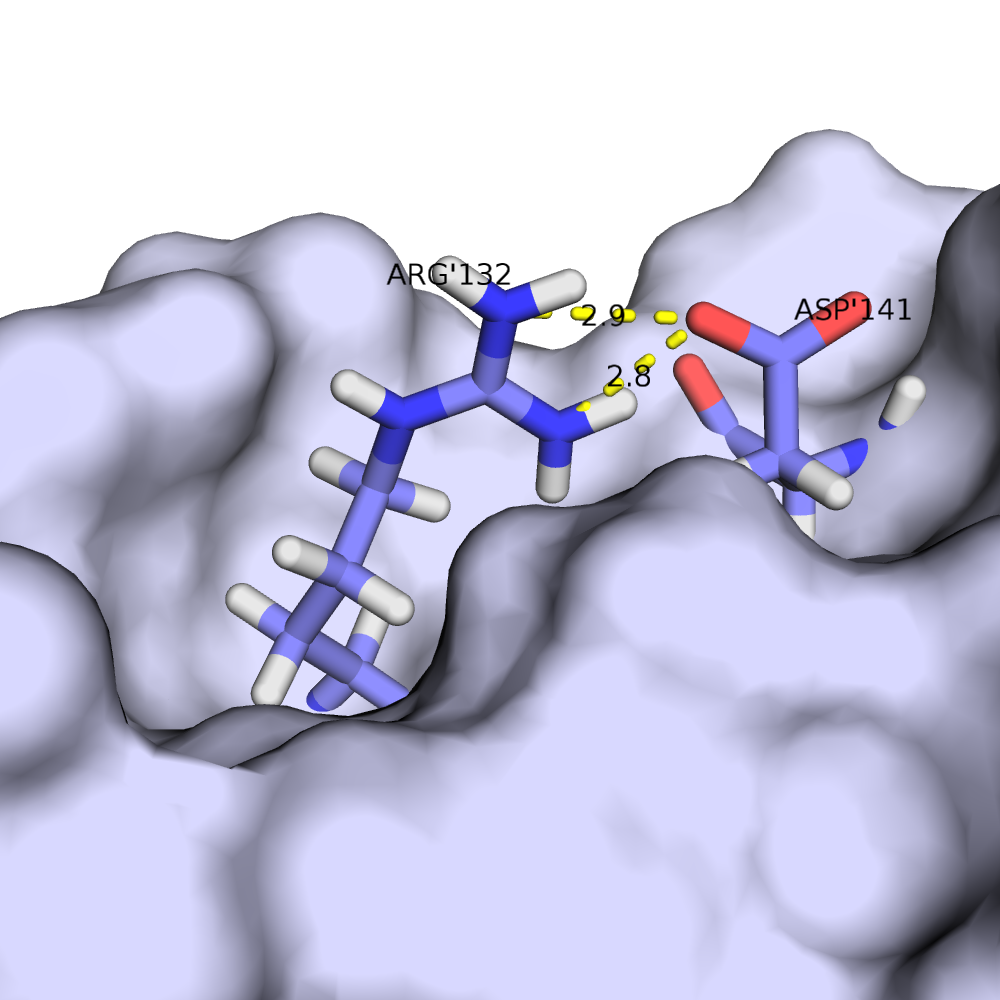
В некоторых моделях боковые радикалы этих аминокислот образуют водородную связь: ASP'141/OD2 или /OD1 располагаются на расстоянии менее 3 ангстрем от ARG'132/NH1 или /NH2. Иллюстрация водородной связи приведена на рис.3.
В моделях 4, 5, 8, 10, 18, 20 водородная связь отсутствует, атомы кислорода и азота расположены на большом расстоянии друг от друга.
Иллюстрация одного из крайних случаев приведена на рис.4.
*дополнительные наблюдения о структуре*
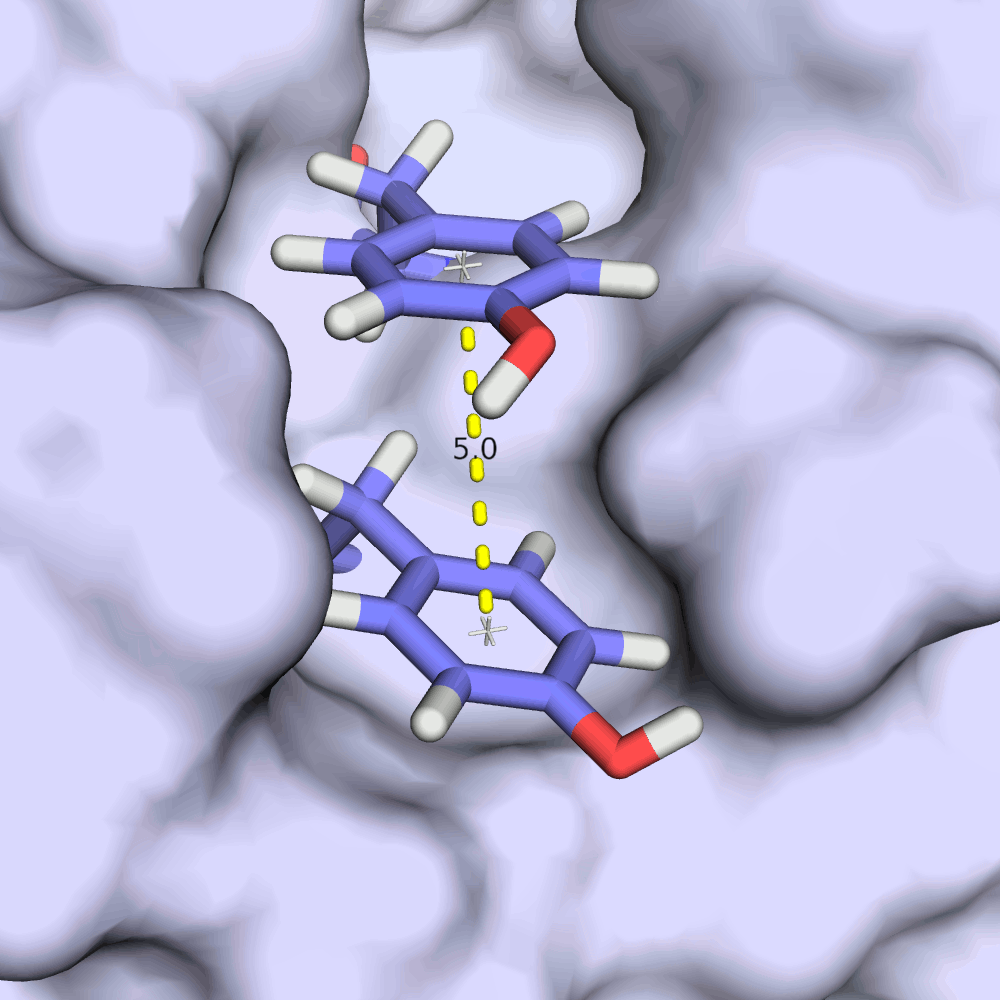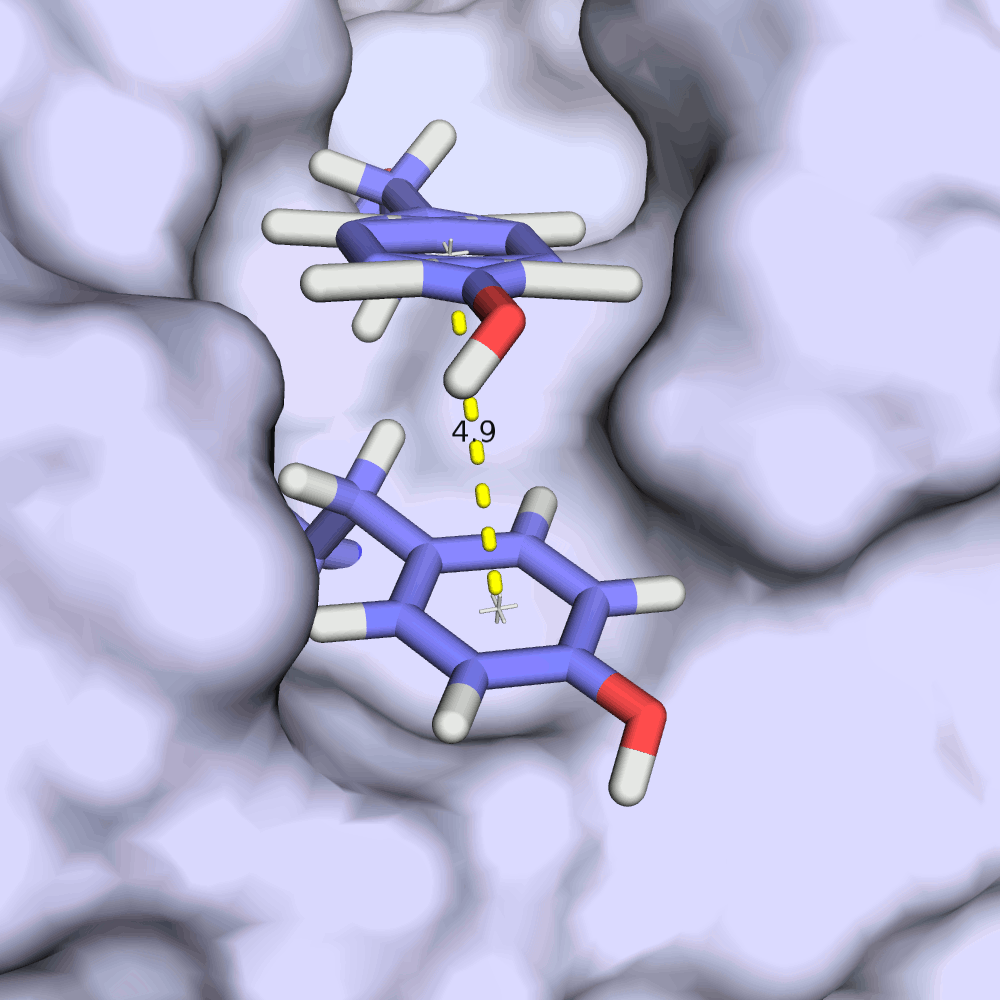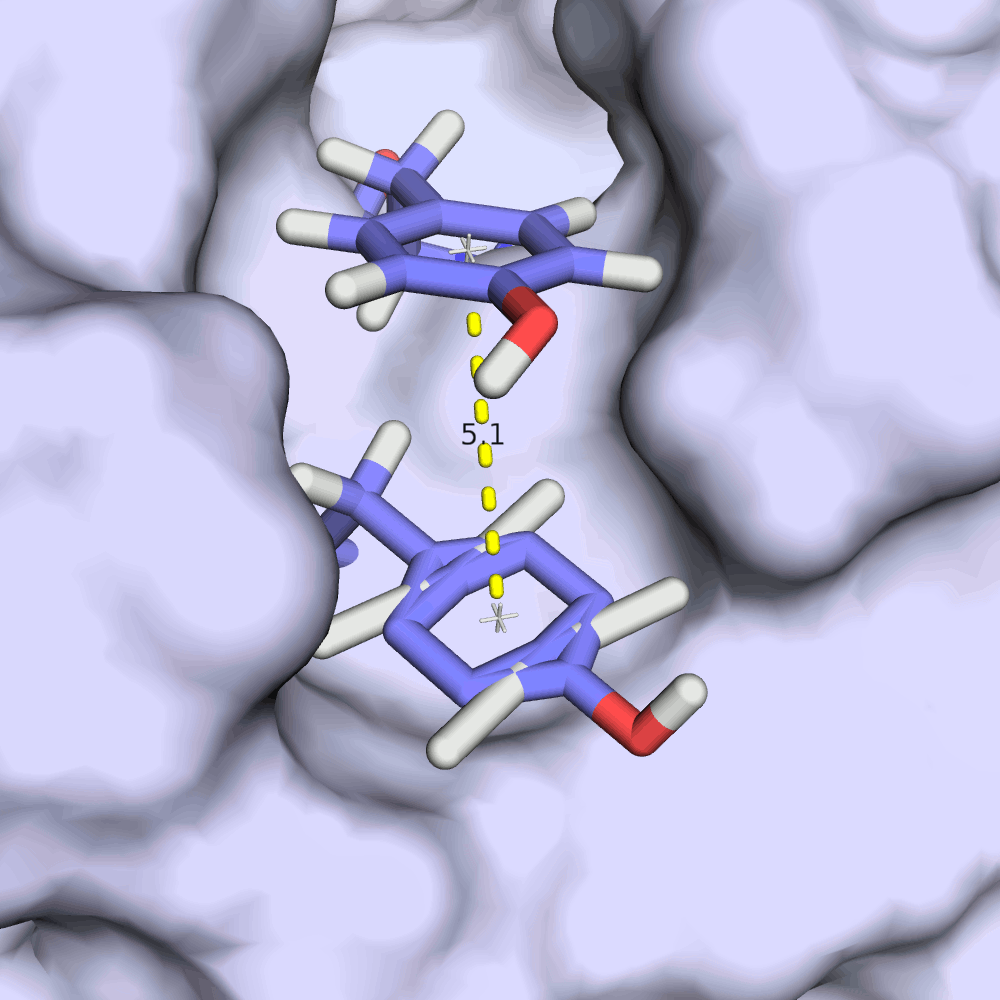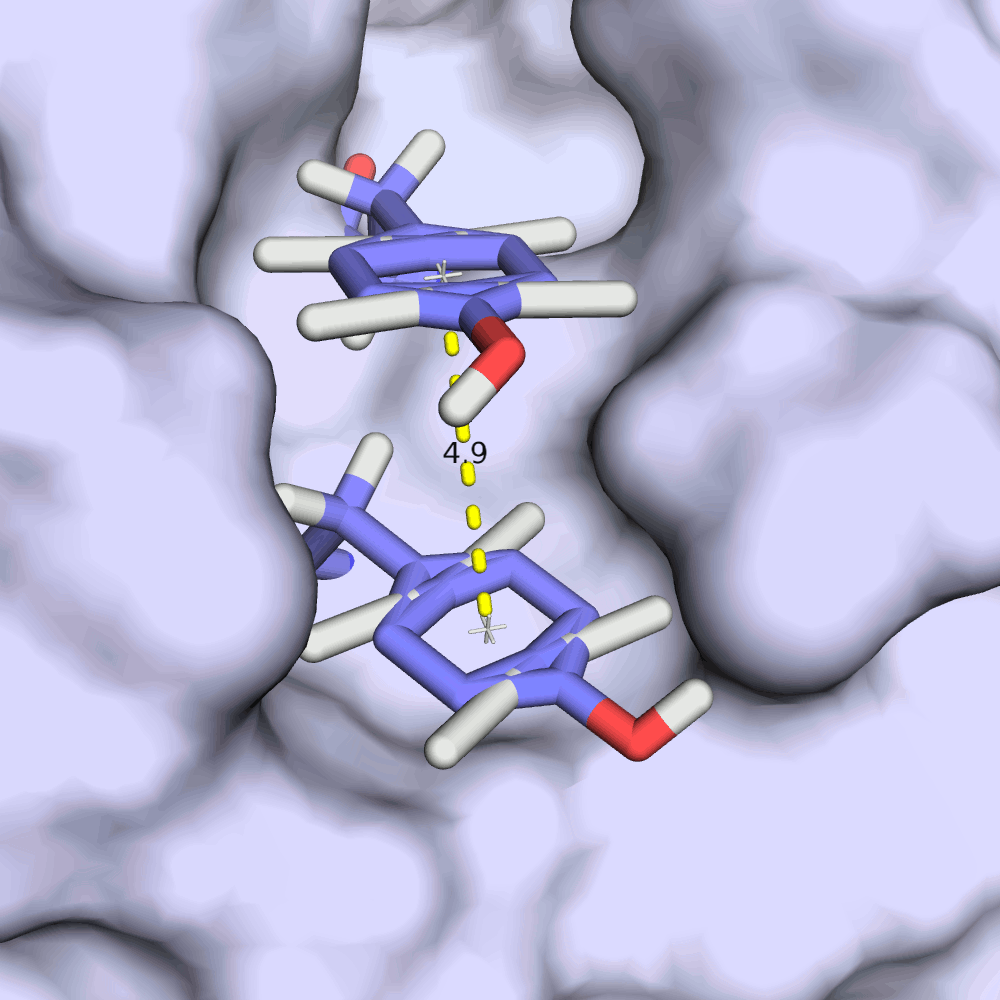
Интересно, как в этой записи ведет себя стекинг-взаимодействия на примере остатков TYR'21 и TYR'149. Из изображений видно, что расстояние между ароматическими кольцами тирозинов колеблется в пределах всего 0.2 ангстрем, а плоскости колец всегда остаются приблизительно параллельными. RMSD структурного выравнивания остова всех моделей при этом 1.44 ангстрема.
Выводы и обсуждение
В разных моделях ЯМР-структуры водородная связь может отсутствовать. При исследовании структуры на предмет водородных связей необходимо рассматривать все модели.
Такая картина соответствует здравому смыслу и картине теплового движения атомов реального белка: водородные связи не обязательно статичны, они могут разрываться и образовываться вновь. Нельзя забывать, что модели структуры в PDB - это только 25 наиболее "подходящих" под экспериментальные данные, а не 25 разных экспериментов, т.е. о подвижности боковых цепей можно заявлять лишь косвенно.
*обсуждение дополнительного наблюдения*
По каким-то причинам стекинг-взаимодействие тирозинов более "консервативно" в разных моделях. Это кажется противоречивым, если пытаться связать ЯМР и подвижность структуры белка в растворе: энергия стекинг-взаимодействия меньше энергии водородной связи, он должен с большей легкостью рваться.
С другой стороны, оба тирозина находятся в углублении белка, поэтому их положение имеет меньше степеней свободы, чем остатки с водородной связью, рассмотренные выше.
К тому же на их положение может влиять непосредственное окружение.
С третьей стороны, статья авторов по структуре 3ZPD посвящена исследованию TYR'48 и т.н. "tyrosin gate", в котором принимают участие и другие тирозины структуры. Возможно, при выборе лучших моделей или при получении окончательного выравнивания они как-то учитывали их положение.
Задание 2. Биологическая и асимметрическая единицы.
Выбор структуры
Критерии поиска PDB:
| Number of Chains (Asymmetric Unit): |
2 |
| Number of Chains (Biological Assembly) |
4 |
Результат: 3566 структур.
|
Выбранная структура:
|
3RY2
|
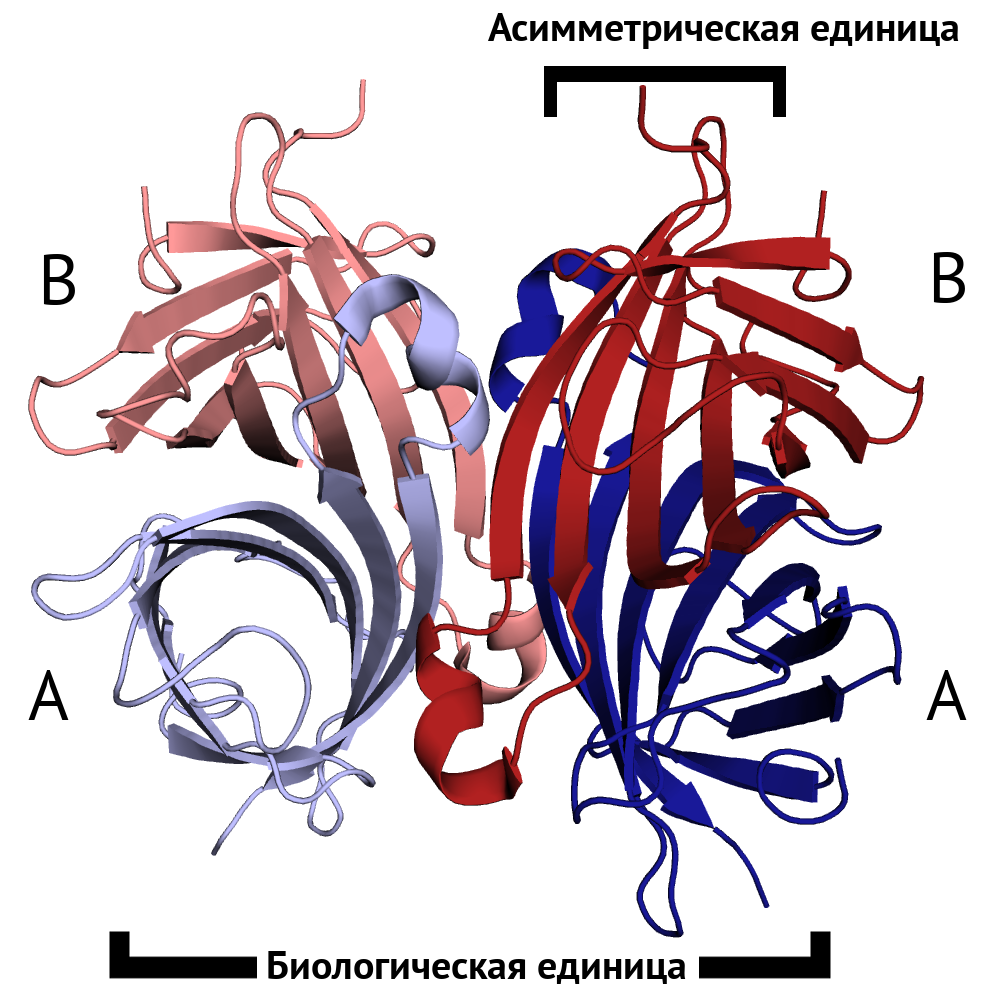
Структура подходит под заданные критерии.
Между субъединицами из разных моделей есть контакт.
Успех, продолжаем работать с этой структурой.
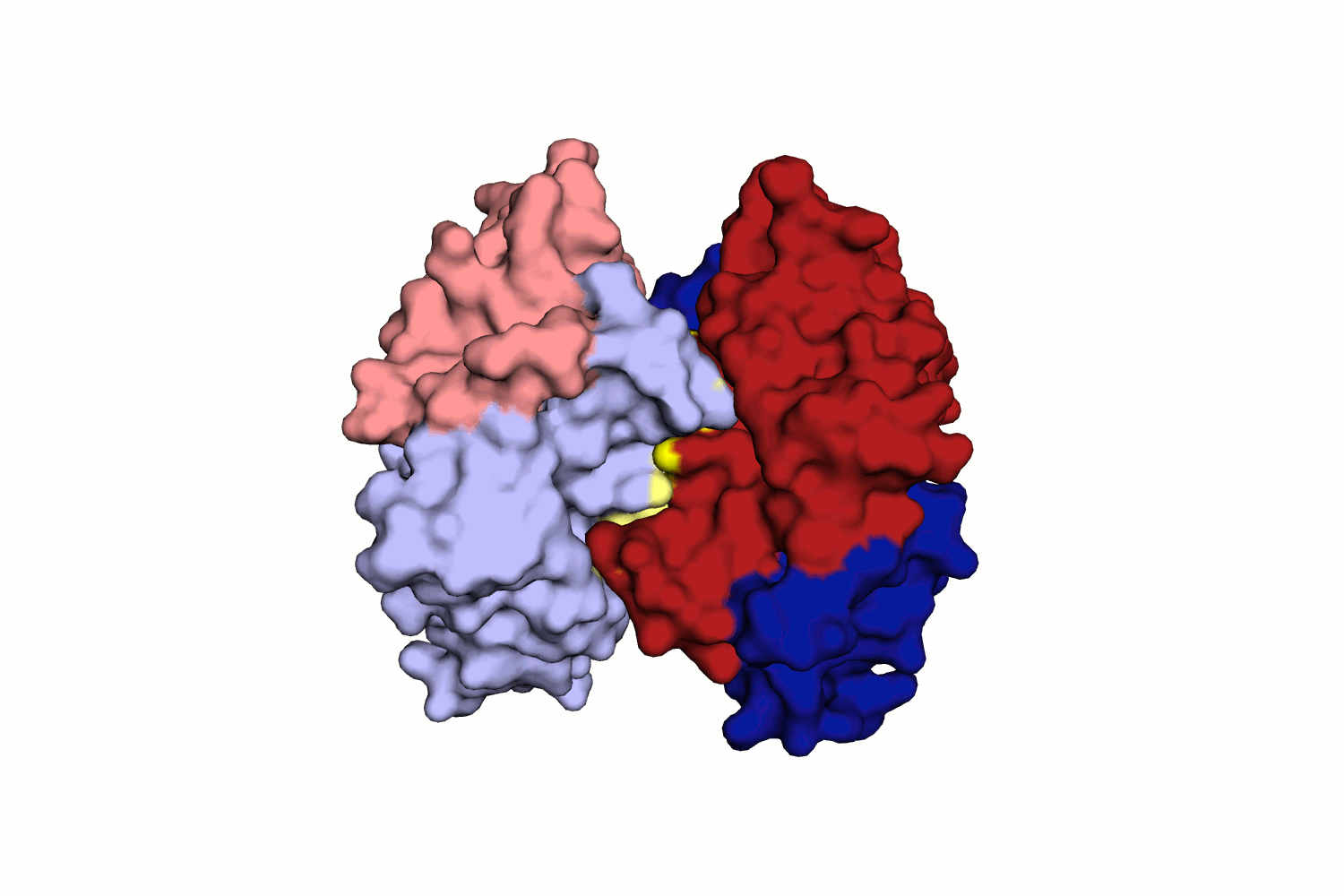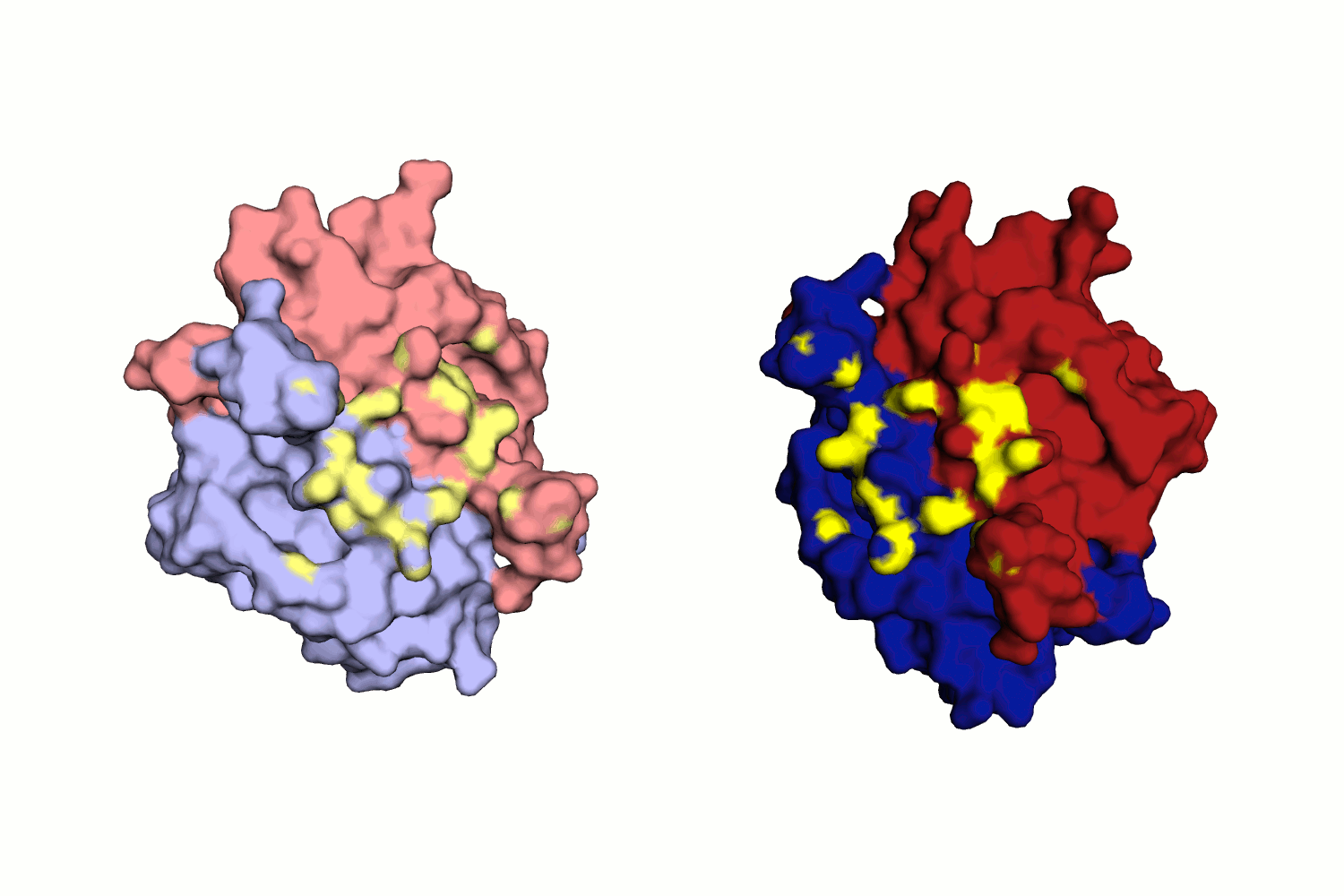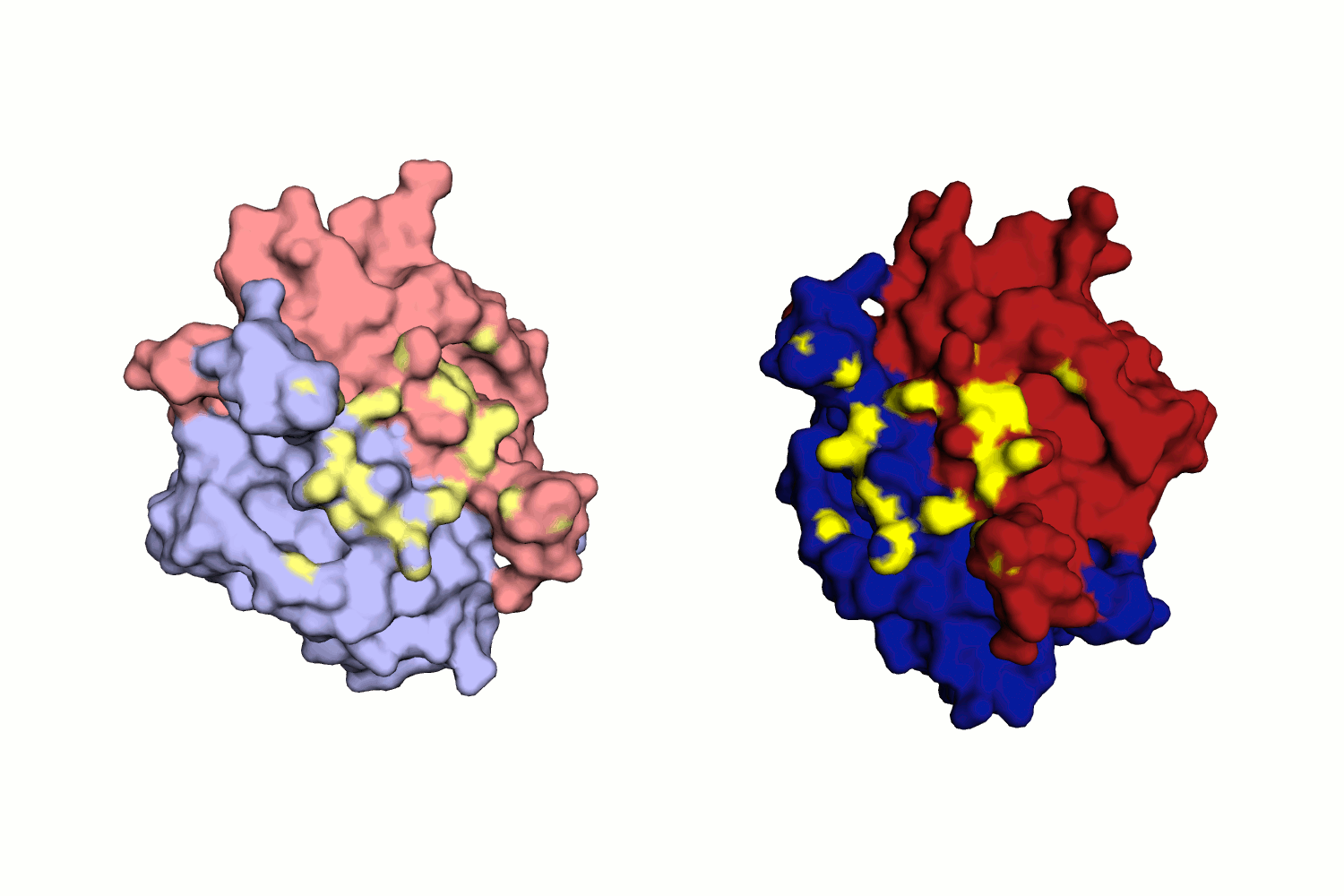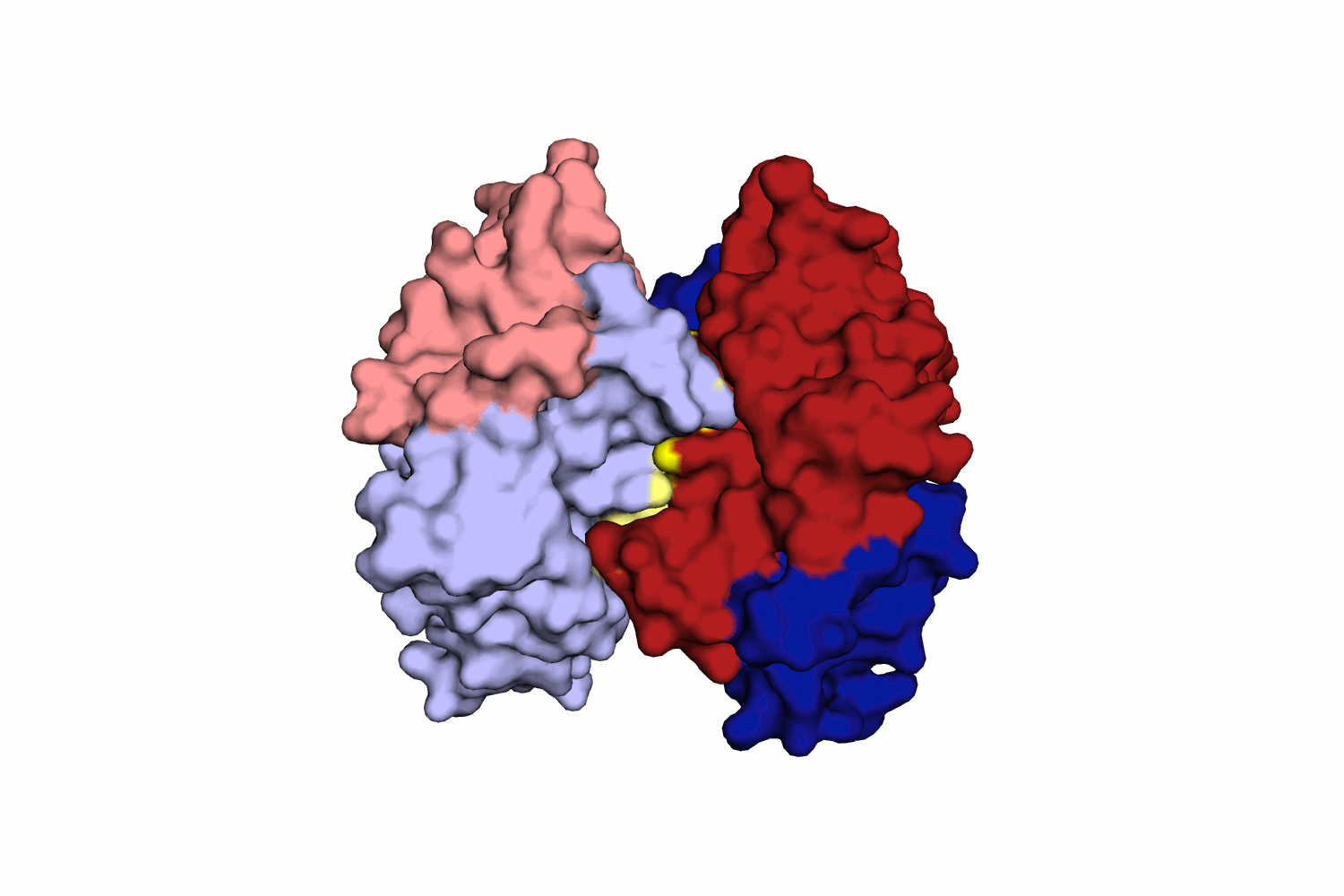
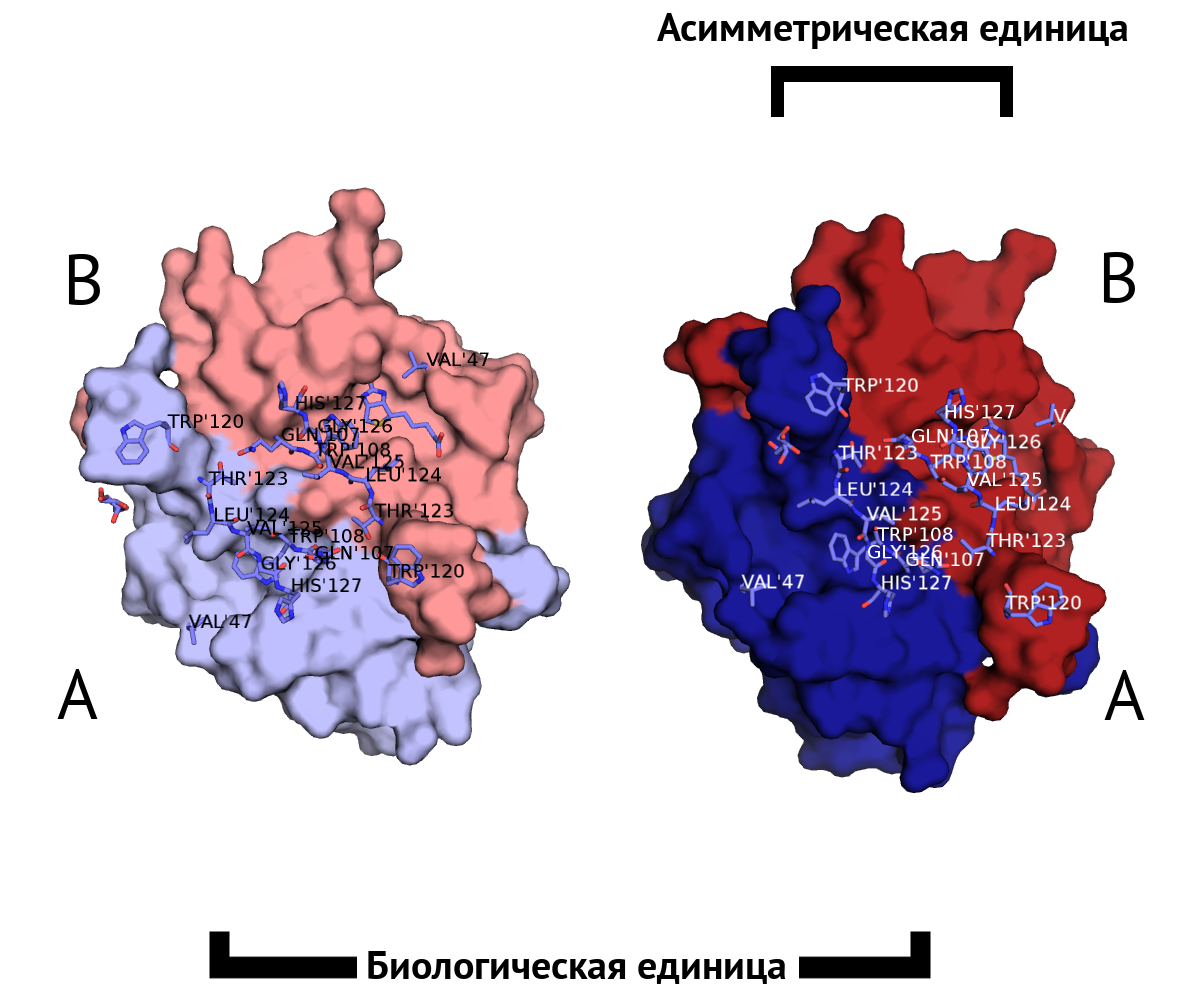
Водородная связь в разных моделях биологической единицы
Таких связей несколько, как видно из рис. 11.
Во-первых, это связь между двумя лигандами белка - GOL (глицерол) и BTN (биотин), которые приписаны к разным моделям. Глицерол находится в альтернативной конформации, все координаты имеют коэффициент заполнения 0.5, но приписаны к одному остатку в PDB.
Во-вторых, это водородные связи между остовными атомами O и N цепей B и A разных моделей. Можно сказать, что бета-тяж одной цепи переходит в бета-тяж с другой структуры.
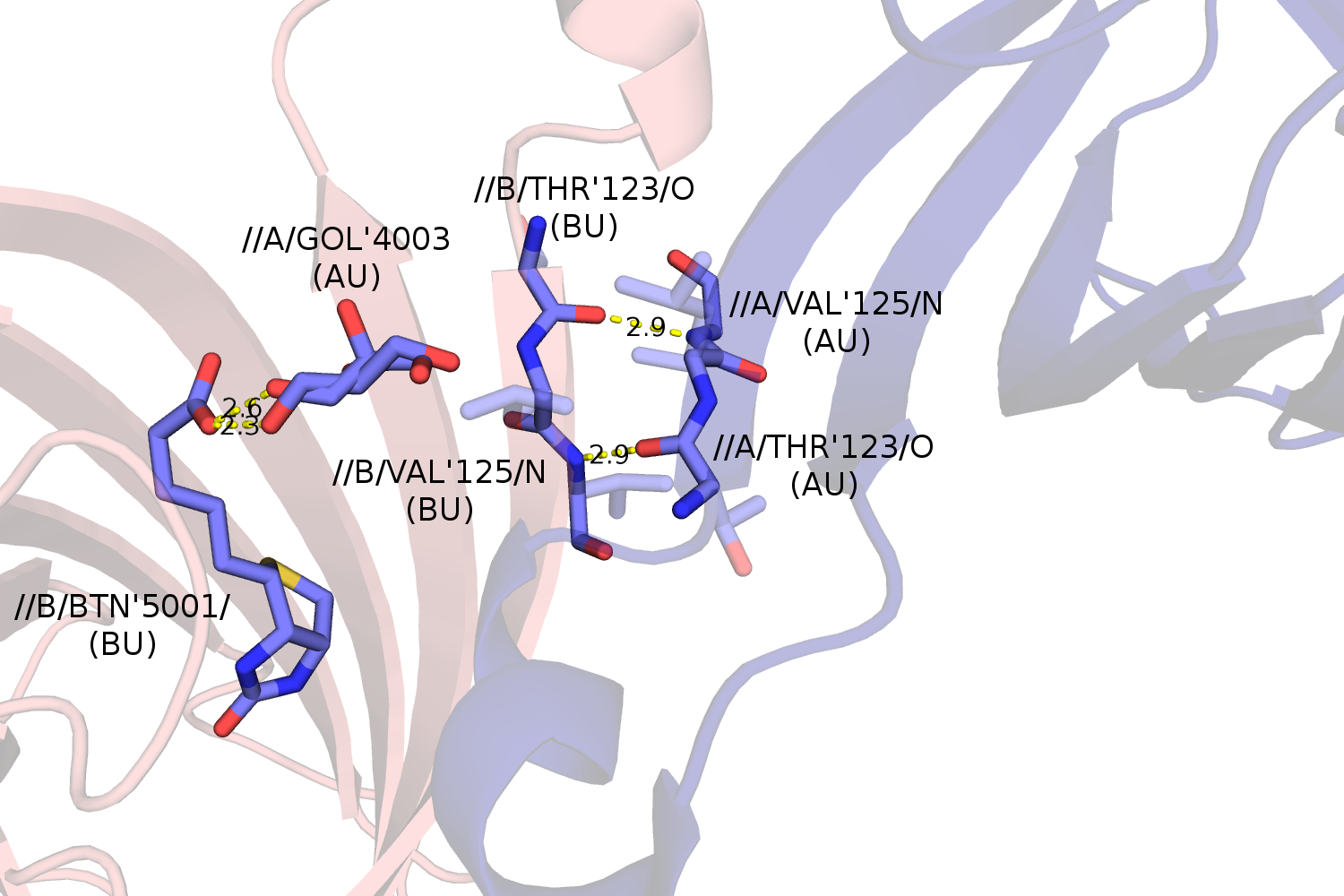
При исследовании связей между цепями структуры исследователь мог бы упустить эти важные взаимодействия, взяв только асимметрическую единицу.
Интересно, что кроме водородных связей, здесь же имеют место гидрофобные взаимодействия (не приведены в отчете подробно, но можно увидеть из рис.10). Они могут искажать структуру асимметрической единицы, поэтому должны быть учтены при рассмотрении, например, маргинальных остатков структуры.
Задание 3. Анализ записи 1QPI.
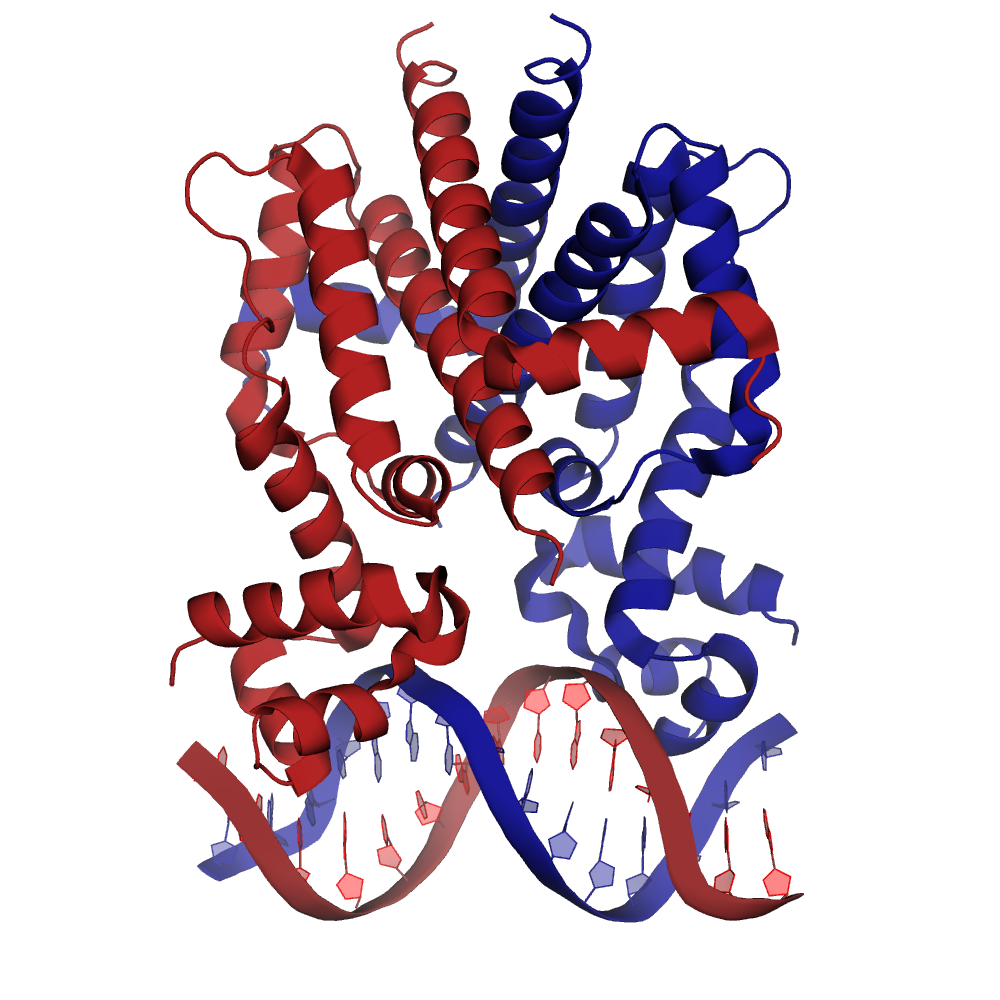
Структура 1QPI - один из примеров, когда биологическая единица не совпадает с асимметрической. Её структура приведена на рис.12. В PDB асимметрической единицы (загружается по умолчанию) отсутсвует одна цепь ДНК и одна цепь белка, желающим предлагается восстановить координаты целостной структуры самостоятельно.
Матрица преобразования приведена в поле
REMARK 350:
"COORDINATES FOR A COMPLETE MULTIMER REPRESENTING THE KNOWN
BIOLOGICALLY SIGNIFICANT OLIGOMERIZATION STATE OF THE
MOLECULE CAN BE GENERATED BY APPLYING BIOMT TRANSFORMATIONS
GIVEN BELOW. BOTH NON-CRYSTALLOGRAPHIC AND
CRYSTALLOGRAPHIC OPERATIONS ARE GIVEN.
...
APPLY THE FOLLOWING TO CHAINS: M, N, A"
и далее - матрица.)
Из странностей бросается в глаза неполная цепь белка: видимо, какой-то участок цепи плохо кристаллизовался, поэтому не виден не функции электронной плотности.
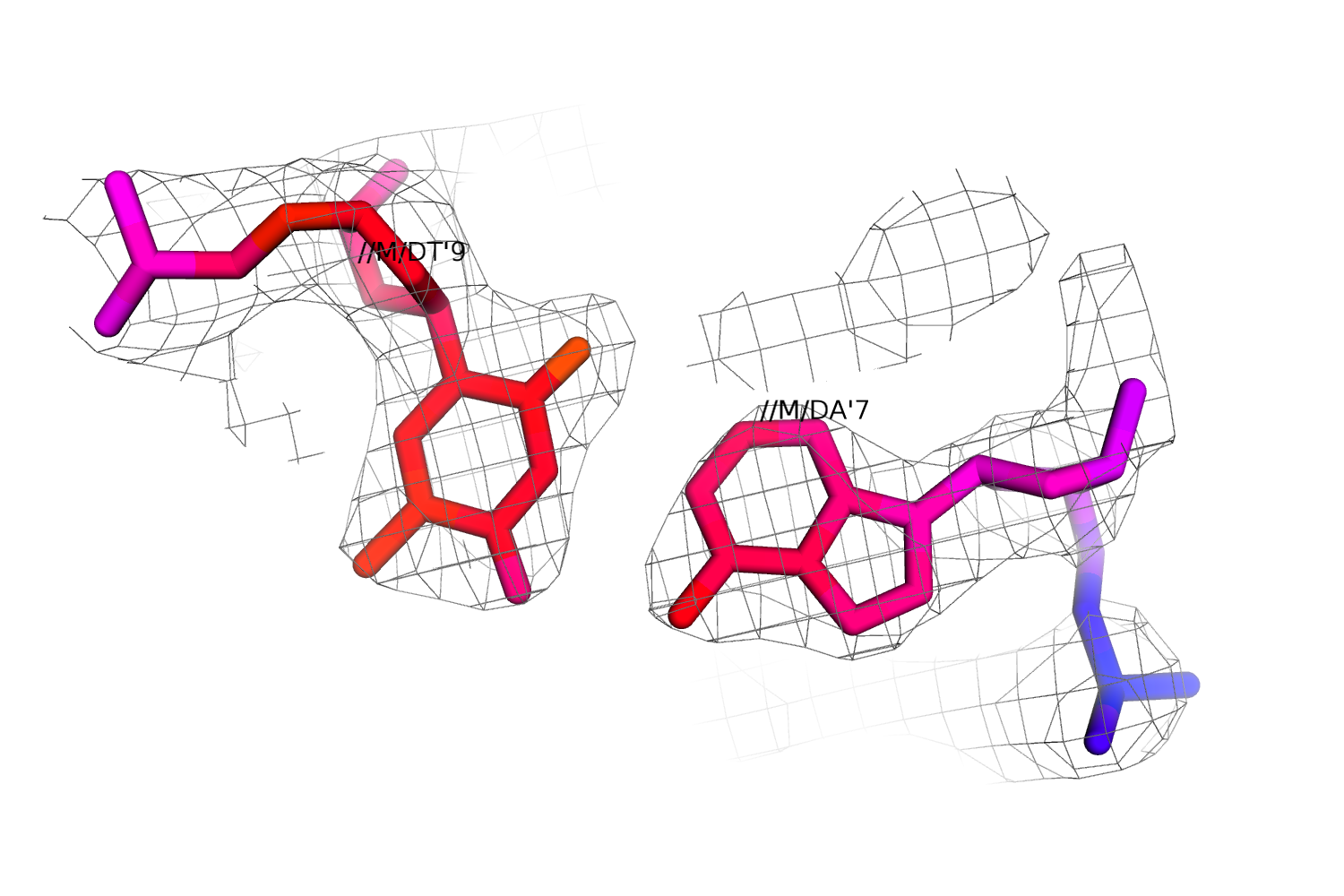
В PDB указано 2 цепи ДНК: N и M, но при визуализации оказалось, что координаты этих двух цепей практически идентичны. Интересно, что коэффициент заполнения для всех атомов ДНК имеет значение 0.5.
Загадка объясняется, стоит лишь приглядеться к последовательностям ДНК и представив ход эксперимента:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D(*CP*CP*TP*AP*TP*CP*AP*AP*TP*GP*AP*TP*AP*GP*A)-3')
D(*TP*CP*TP*AP*TP*CP*AP*TP*TP*GP*AP*TP*AP*GP*G)-3')
Эксперимент подразумевает присоединение димера белка к палиндромной последовательности ДНК. При этом между двумя палиндромными последовательностями есть незначимый линкер из 1 нуклеотида (информация из данных статьи о структуре, P. Orth et al., 2000 Nature Letters).
Нуклеотиды по краям - тоже не важны для присоединения белка.
Видим, что цепи N и M из эксперимента различаются точно на 1, 8 и 15 нуклеотиды, но при этом комплементарны, т.е. образуют несимметричную двуцепочечную ДНК в растворе.
Белку не важно, к какой последовательности присоединяться: содержащей аденин или тимин в середине, цитозин или тимин с 5' конца, аденин или тимин с 3' конца.
Присоединение будет равновероятно.
Таким образом, в половине ячеек кристалла ожидается присоединение к цепи N, в половине - к M. Именно этот эффект и наблюдается в записи PDB: "альтернативную конформацию" имеют не один остаток, и не даже три, а целые цепи. Правда, термин "альтернативная конформация" здесь неприменим, надо говорить об "альтернативном положении цепей" (которое, кстати, выявляется только после реконструкции биологической единицы).
В итоге то, что на первый взгляд казалось необъяснимой странностью оказалось понятны и логичным поступком авторов структуры.
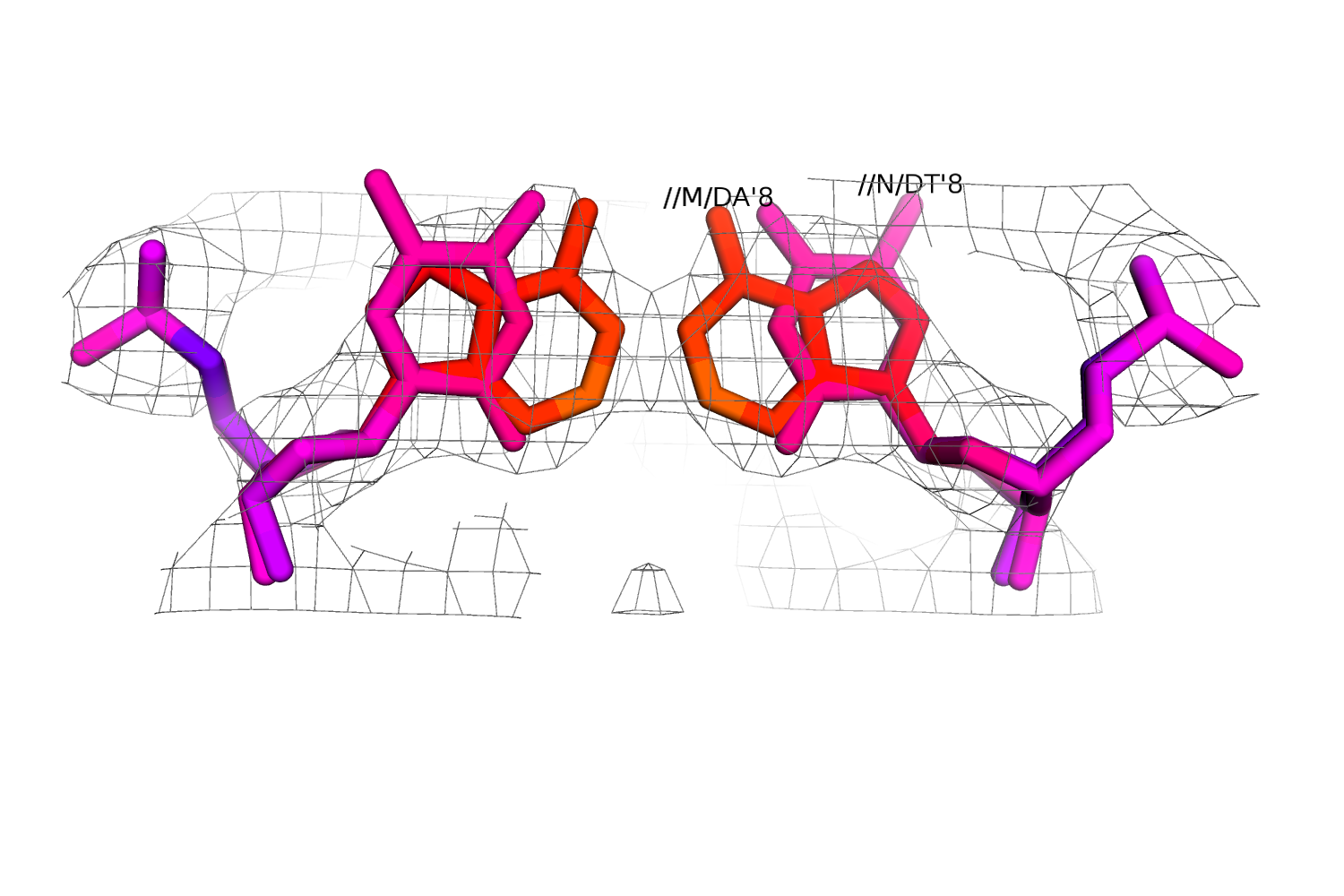
Интересно, как на функции электронной плотности выглядит такая неопределенность. На рис.13 приведено изображение остатков 8 цепей M и N (восстановлена 2-ая цепь ДНК) и их электронная плотность. На рис.14 приведена однозначная пара, видно, что электронная плотность более сжата.
Выводы
При работе со структурами нельзя забывать о биологической единице.
Во-первых, в ней содержится информация о межмолекулярных контактах.
Во-вторых, в некоторых случаях (как в случае структуры 1QPI) только с её помощью можно объяснить происходящие с записью странности и противоречия.













