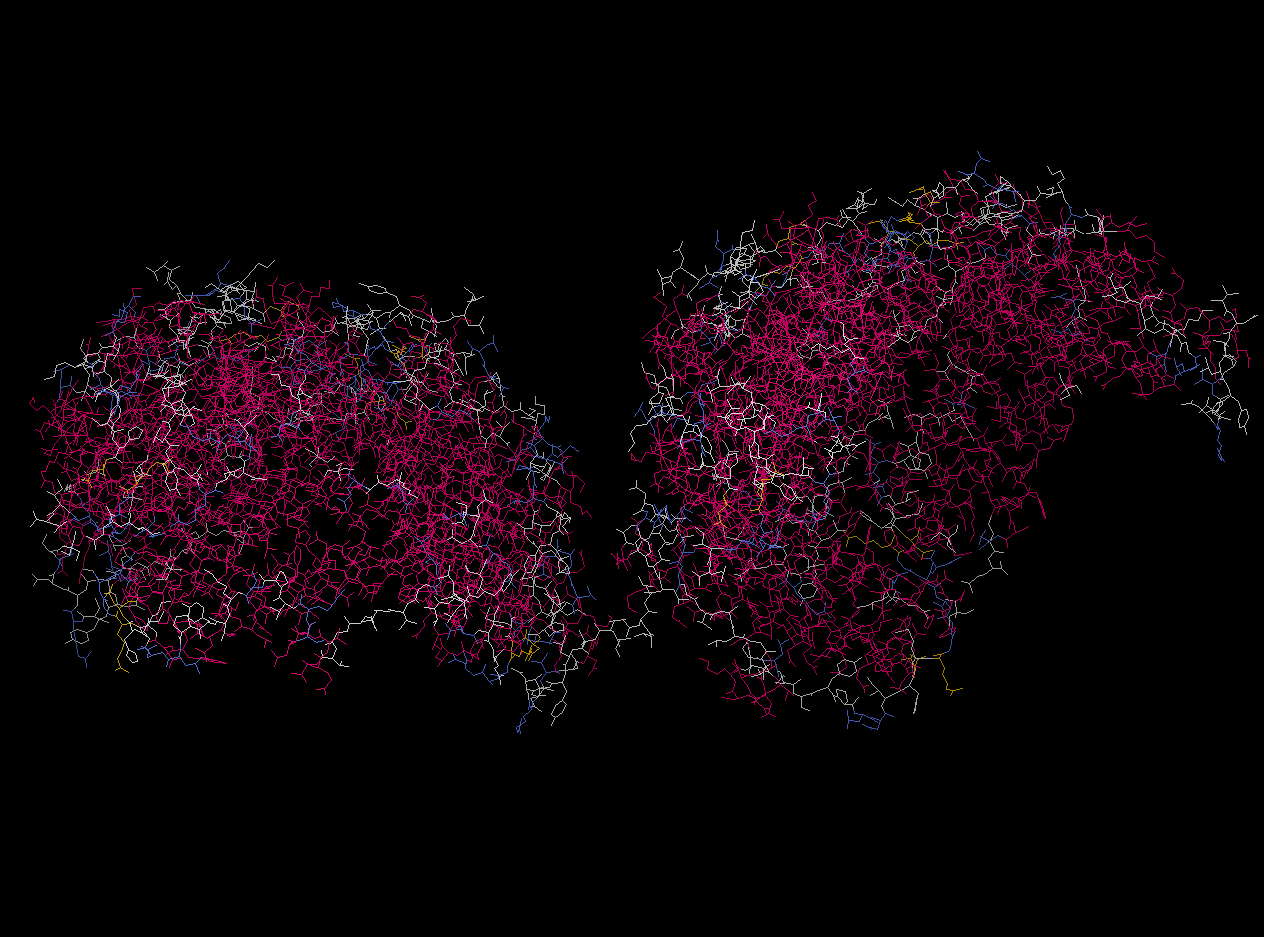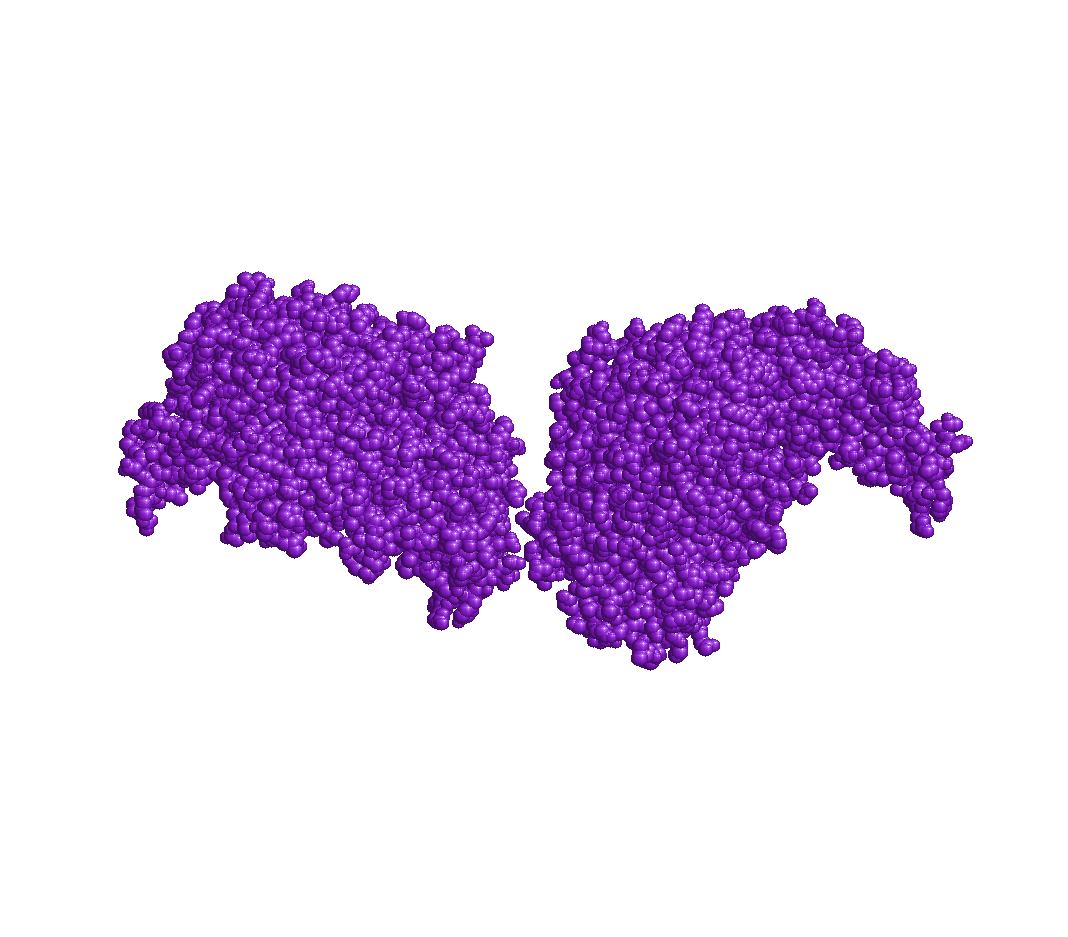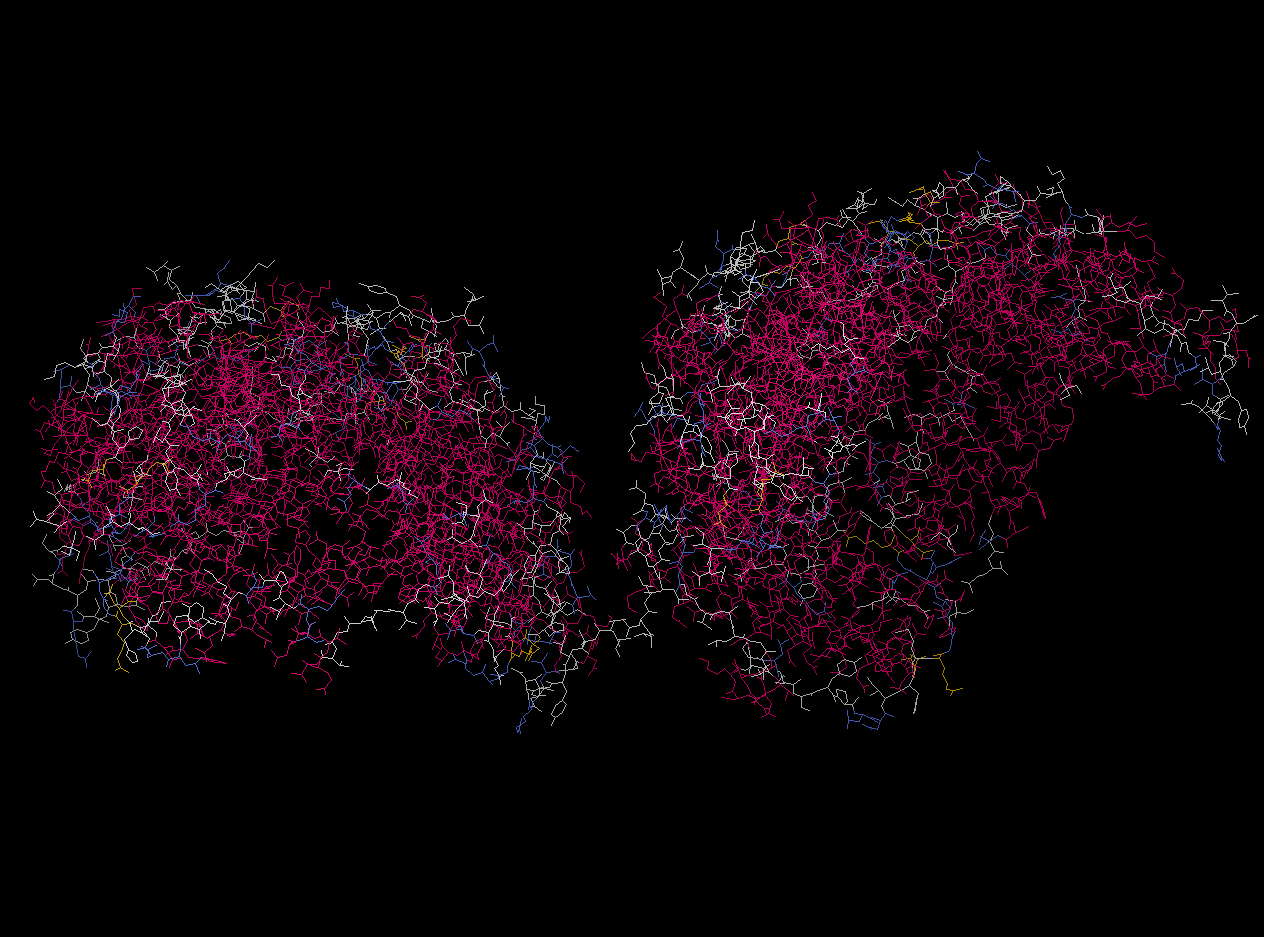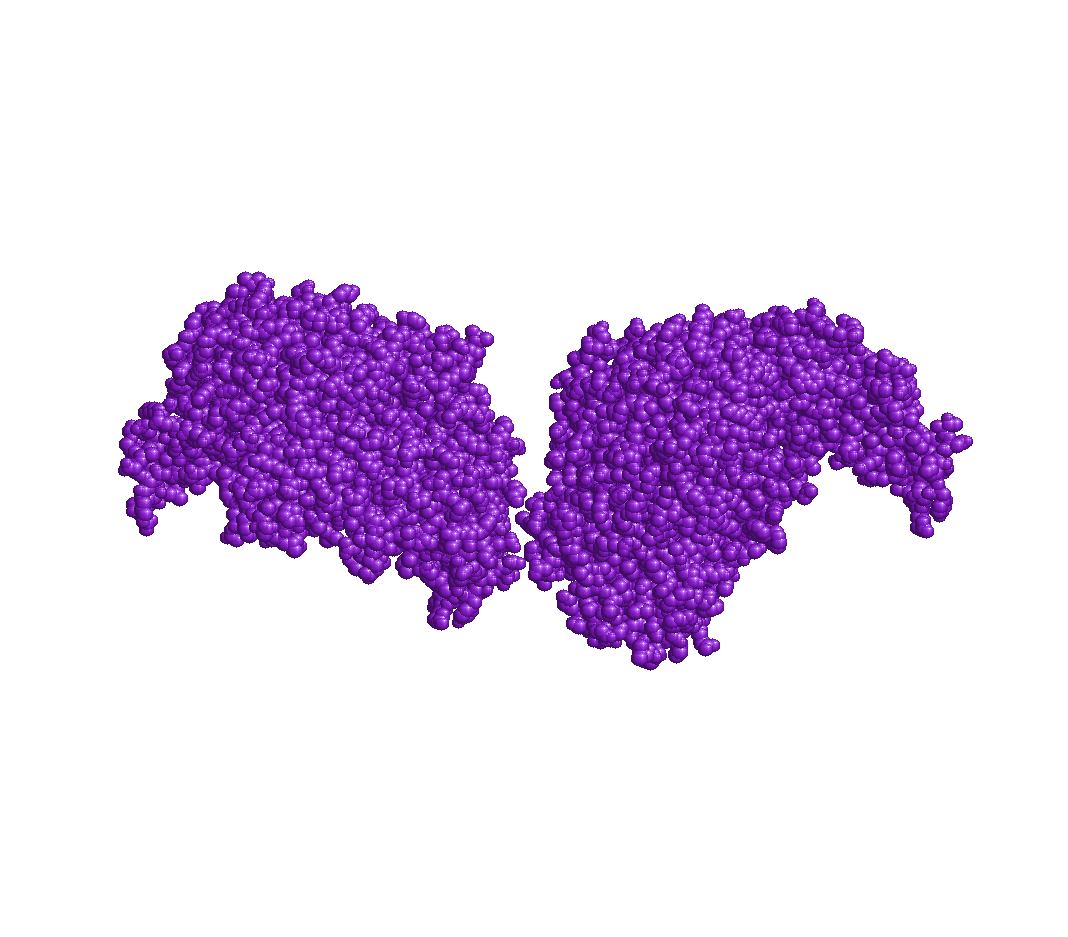Отчет о белке DPS E.coli
Полное название белка DPS_ECOLI - DNA protection during starvation protein (белок, обеспечивающий защиту ДНК во время голода).
Этот фермент относится к классу оксидоредуктаз: точнее к окисидоредуктазам, окисляющим ионы металлов (по классификации IUMBM (International Union of Biochemistry and Molecular Biology) носит номер EC=1.16).
Он относится к семейству dps, найден в бактерии Escherichia coli (strain K12) (ее классификация: Он относится к семейству dps, найден в бактерии Escherichia coli (штамм K12) (ее классификация: Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Escherichia), функционирует в цитоплазме и нуклеоиде клетки.
Закодирован он на обратной цепи гена DPS (имена локусов - ECK0801, JW0797), подробнее о котором можно узнать по этой ссылке.
Функция белка dps - образование высоко упорядоченного и стабильного ко-кристалла dps с ДНК, внутри которого хромосомиальная ДНК кондесирована и защищена от различных повреждений (в том числе от окислительного воздействия внутриклеточных ионов Fe(2+)) и превращение ионов Fe(2+) в оксикидроксидный минерал Fe(3+). Кроме того, dps защищает клетку от ультрафиолетового и гамма-излучения, токсичности железа и меди, температурного стресса и кислотно-основного воздействия (то есть является буфером).
Таким образом, фермент катализирует окислительно-восстановительную реакцию: 2 Fe2+ + H2O2 + 2 H+ = 2 Fe3+ + 2 H2O.
Теперь подробнее о строении белка dps.
Фермент является гомододекамером. Внизу представлено изображение четвертичной структуры белка, полученное с помощью программы RasMol. Как видно, белок состоит из двух половинок, каждая из которых состоит из 6 идентичных полипептидных цепей.
Полипептидная цепть белка состоит из 167 аминокислотных остатков, имеет молекулярную массу, равную 18695 MW.
Запись аминокислотной последовательности полипептидной цепи белка в fasta-формате:
>DPS_ECOLI Fe-binding and storage protein
MSTAKLVKSKATNLLYTRNDVSDSEKKATVELLNRQVIQFIDLSL
ITKQAHWNMRGANFIAVHEMLDGFRTALIDHLDTMAERAVQLGGVALGTTQVINSKTPL
KSYPLDIHNVQDHLKELADRYAIVANDVRKAIGEAKDDDTADILTAASRDLDKFLWFIE
SNIE
Кроме того, скачать ее можно по этой ссылке.
Активный центр цепи белка образован тремя аминокислотными остатками: His51 (гистидин), Asp78 (аспарагиновая кислота), Glu82 (глутаминовая кислота). Кроме того, возможна мутация 18-го аминокислотного остатка (аргинин может заместиться на аспарагин) и 68-го остатка (глицин может заместиться на аланин).
Интересно то, что белок dps содержит не только аминокислотную часть, но и лиганды. Благодаря кристаллизации белка, были получены данные о содержащихся в нем низкомолекулярных веществ:
| ID
|
Название
|
Формула
|
Число копий
|
Комментарии
|
ZN
|
ZINC ION
|
ZN2+
|
12
|
Ионы цинка.
|
| TRS
|
2-AMINO-2-HYDROXYMETHYL-PROPANE-1,3-DIOL
|
C4H12NO31+
|
12
|
2-амино-2-гидроксиметил-пропан-1,3-диол -
спирт, похожий на глицерин, но второй атом углерода в нем
связан с гидроксильной группой через метильную группу и связан с аминогруппой.
|
| HOH
|
WATER
|
H2O
|
539
|
Молекулы воды.
|
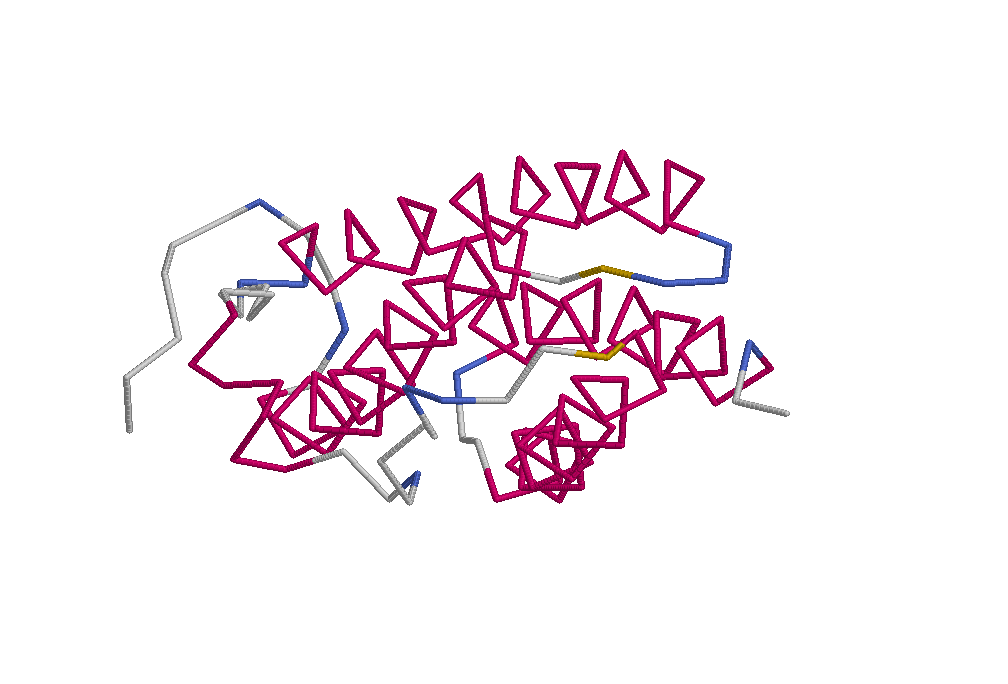
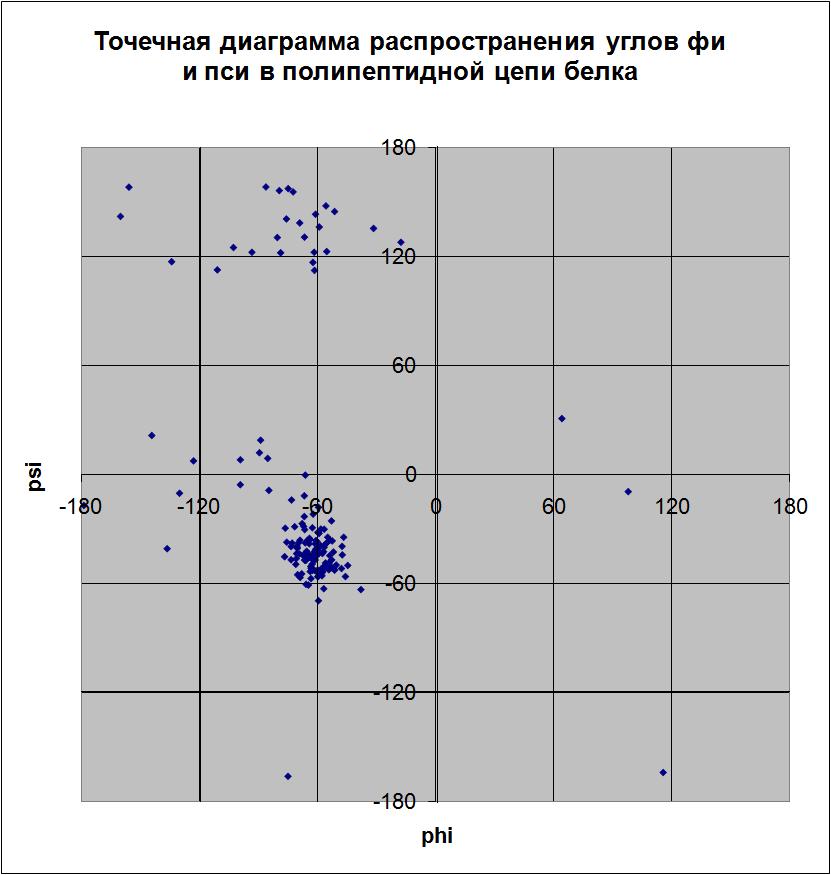
Теперь обратим внимание на вторичную структуру белка. Белок DPS E.coli альфа-спиральный. Каждая его цепь состоит из 4 длинных альфа-спиралей и одной коротенлькой (состоящей всего из 2 витков). Внизу представлено изображение вторичной структуры одной полипептидной цепи белка (цепи А). Красным показаны альфа-спирали, синим - бета-повороты полипептидной цепи. Рисунок был получен с помощью программы RasMol. На рисунке так же показаны 2 бета-тяжа (желтым), но на самом деле это просто аморфные участки цепи (исходя из файла из банка UniProt P0ABT2.txt). Кроме того внизу представлена точечная диаграмма распространения углов фи и пси в полипептидной цепи А белка. Эта диаграмма ясно показывает, что основная вторичная структура в цепи - альфа-спирали (скопление точек в районе фи = - 60, пси = - 43); углов, соответствующих бета-тяжам, очень мало (точки в районе фи = -60,
пси = 120). Наиболее распространенные торсионные углы: фи = -56,8; -60; -66,9; пси = -43,4. Точки, не соответствующие ни углам альфа-спиралей, ни углам бета-тяжей, относятся к остаткам глицинов, радикалы которых, вследствие своих маленьких размеров, не создают препятствий для вращения вокруг связей, вследствие чего значения торсионных углов глицинов могут быть весьма разнообразными, в то время как эти же значения запрещены для других аминокислотных остатков.
�
Идентификатор записи белка DPS E.coli в базе данных UniProt - DPS_ECOLI. Идентификаторы записи в PDB - 1F30; 1F30; 1F33; 1JRE; 1JTS; 1L8H; 1L8I.
Аннотации некоторых статей о белке DPS_ECOLI из файла базы данных UniProt P0ABT2.txt представлены ниже:
- "A novel DNA-binding protein with regulatory and protective roles in starved Escherichia coli."
Almiron M, Link AJ, Furlong D, Kolter R.
Полный текст статьи есть в открытом доступе! Для чтения пройдите по этой ссылке.
- "Characterization of the sigma 38-dependent expression of a core Escherichia coli starvation gene, pexB."
Lomovskaya O.L., Kidwell J.P., Matin A.
Полный текст статьи есть в открытом доступе! Для чтения пройдите по этой ссылке.
- "A 718-kb DNA sequence of the Escherichia coli K-12 genome corresponding to the 12.7-28.0 min region on the linkage map."
Oshima T, Aiba H, Baba T, Fujita K, Hayashi K, Honjo A, Ikemoto K, Inada T, Itoh T, Kajihara M, Kanai K, Kashimoto K, Kimura S, Kitagawa M, Makino K, Masuda S, Miki T, Mizobuchi K, Mori H, Motomura K, Nakamura Y, Nashimoto H, Nishio Y, Saito N, Horiuchi T.
Полный текст статьи есть в открытом доступе! Для чтения пройдите по этой ссылке.
- "The complete genome sequence of Escherichia coli K-12."
Blattner FR, Plunkett G 3rd, Bloch CA, Perna NT, Burland V, Riley M, Collado-Vides J, Glasner JD, Rode CK, Mayhew GF, Gregor J, Davis NW, Kirkpatrick HA, Goeden MA, Rose DJ, Mau B, Shao Y.
Аннотация статьи:
The 4,639,221-base pair sequence of Escherichia coli K-12 is presented. Of 4288 protein-coding genes annotated, 38 percent have no attributed function. Comparison with five other sequenced microbes reveals ubiquitous as well as narrowly distributed gene families; many families of similar genes within E. coli are also evident. The largest family of paralogous proteins contains 80 ABC transporters. The genome as a whole is strikingly organized with respect to the local direction of replication; guanines, oligonucleotides possibly related to replication and recombination, and most genes are so oriented. The genome also contains insertion sequence (IS) elements, phage remnants, and many other patches of unusual composition indicating genome plasticity through horizontal transfer.
- "Highly accurate genome sequences of Escherichia coli K-12 strains MG1655 and W3110."
Hayashi K, Morooka N, Yamamoto Y, Fujita K, Isono K, Choi S, Ohtsubo E, Baba T, Wanner BL, Mori H, Horiuchi T.
Полный текст статьи есть в открытом доступе! Для чтения пройдите по этой ссылке.
- "The N-terminal extensions of Deinococcus radiodurans Dps-1 mediate DNA major groove interactions as well as assembly of the dodecamer."
Bhattacharyya G, Grove A.
Аннотация статьи:
Dps (DNA protection during starvation) proteins play an important role in the protection of prokaryotic macromolecules from damage by reactive oxygen species. Previous studies have suggested that the lysine-rich N-terminal tail of Dps proteins participates in DNA binding. In comparison with other Dps proteins, Dps-1 from Deinococcus radiodurans has an extended N terminus comprising 55 amino acids preceding the first helix of the 4-helix bundle monomer. In the crystal structure of Dps-1, the first approximately 30 N-terminal residues are invisible, and the remaining 25 residues form a loop that harbors a novel metal-binding site. We show here that deletion of the flexible N-terminal tail obliterates DNA/Dps-1 interaction. Surprisingly, deletion of the entire N terminus also abolishes dodecameric assembly of the protein. Retention of the N-terminal metal site is necessary for formation of the dodecamer, and metal binding at this site facilitates oligomerization of the protein. Electrophoretic mobility shift assays using DNA modified with specific major/minor groove reagents further show that Dps-1 interacts through the DNA major groove. DNA cyclization assays suggest that dodecameric Dps-1 does not wrap DNA about itself. A significant decrease in DNA binding affinity accompanies a reduction in duplex length from 22 to 18 bp, but only for dodecameric Dps-1. Our data further suggest that high affinity DNA binding depends on occupancy of the N-terminal metal site. Taken together, the mode of DNA interaction by dodecameric Dps-1 suggests interaction of two metal-anchored N-terminal tails in successive DNA major grooves, leading to DNA compaction by formation of stacked protein-DNA layers.
Перевод этой аннотации на русский язык:
Белки из семейства Dps (белки, обеспечивающие защиту ДНК во время голода) играют большую роль в защите макромолекул прокариот от вреда, наносимого химически активными разновидностями кислорода. Предыдущие исследования показали, что богатый лизином N-конец белков Dps принимает участие в связывании ДНК. В сравнении с другими белками Dps, белок Dps-1 из бактерии Deinococcus radiodurans обладает вытянутым N-концом, содержащим 55 аминокислот перед первой альфа-спиралью четырех-спирального мономера. В кристаллической структуре белка Dps-1 приблизительно 30 первых остатков с N-конца невидимы, а остальные 25 остатков образуют петлю, скрывающую участок, связывающийся с металлом. Мы показываем в этой статье, что удаление гибкого N-конца приводит к неспособности белка Dps-1 взаимодействовать с ДНК.
Удивительно, но удаление всего N-конца также разрушает додекамерную сборку белка. Сохранение участка N-конца, связывающего металл, необходимо для формирования додекамера, и связывание металла в этом участке способствует олигомеризации белка. Более того, электрофоретические методы анализа, использующие ДНК, модифицированную специфичными реагентами большой и малой бороздок, показывают, что белок Dps-1 взаимодействует с ДНК через большую бороздку. Анализы циклизации ДНК показывают, что додекамерный белок Dps-1 не обертывает ДНК вокруг себя. Существенное снижение сродства к связыванию ДНК сопровождается снижением длины с 22 до 18 bp, но только для додекамерного Dps-1. Более того, наши данные говорят о том, что высокое сродство к связыванию ДНК зависит от "занятости" участка N-конца, связывающего металл. В итоге, механизм взаимодействия ДНК с додекамерным белком DPS-1 предполагает взаимодействие двух связанных с металлом N-концов с последовательными большими бороздками ДНК, приводящее к сжатию ДНК, благодаря формированию уплотненных белково-ДНК-вых слоев.
Назад