Выдача PROCHECK для записи 1F30
Воспользуемся базой данных PDBSum. Со страницы структуры записи 1F30 пройдем по гиперссылке "PROCHECK". Выдача PROCHECK для записи 1F30 выглядит так. Посмотрим на карту Рамачандрана для остатков записи 1F30: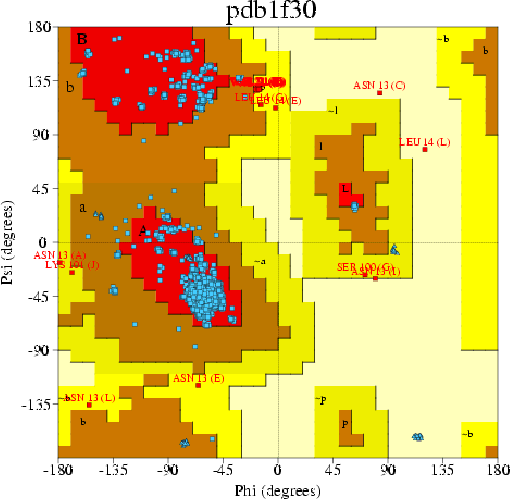
Как видно, в запрещенных областях находятся всего 3 остатка структуры (отличных от Gly и Pro); это составляет всего 0.2% остатков. В предпочитаемые области попало 1642 остатка из 1752 (отличных от Gly и Pro); это составляет 93.7% остатков. Такой процент остатков, расположенных в предпочитаемой области, говорит о хорошем качестве модели белка (если судить по критерию карты Рамачандрана).
Значения RSR остатков записи 1F30 по данным сервера EDS
На сервере EDS зайдем на страницу структуры записи 1F30. Пройдем по гиперссылке "Significant regions". На открывшейся странице можем найти информацию о количестве остатков каждой цепи белка с подозрительным значением RSR (отклонившимся от своего среднего значения больше чем на 2 сигмы). Другими словами, это остатки со значением Z-score, большим двух.Всего таких остатков во всем белке 236. Информация о числе остатков в каждой цепи представлено в таблице:
Количество остатков с высоким значением Z-score в каждой цепи белка записи 1F30
| Номер цепи | Число остатков с высоким значеним Z-score |
| A | 3 |
| B | 1 |
| C | 2 |
| D | 0 |
| E | 4 |
| F | 3 |
| G | 43 |
| H | 53 |
| I | 21 |
| J | 21 |
| K | 45 |
| L | 40 |
Для примера возьмем остаток Asp-23 цепи K. Электронная плотность вокруг него выглядит так:
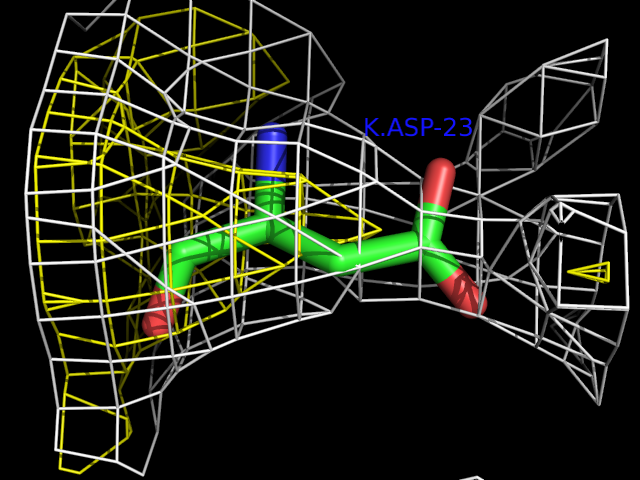
Из рисунка видно, что остаток совершенно не вписывается в рассчитанную для него электронную плотность (особенно если посмотреть на плотность уровня 1 (окрашена желтым)).
Пространственный R-фактор этого остатка RSR = 0.354.
Коэффициент корреляции для электронной плотности ("real-space correlation coefficient") равен 0.719.
Z-score пространственного R-фактора равен 2.030303.
Все приведенные значения для остатка Asp-23 не являются достоверными (RSR > 0.1; коэффициент корреляции < 0.9; Z-score > 2). Таким образом, теоретическая и экспериментальная электронные плотности для этого остатка не могут считаться одинаковыми.
Изучение показателей оптимизированной структуры записи 1F30
Со страницы структуры записи 1F30 на сервере EDS перейдем по гиперссылке "PDB_REDO". Изучим таблицы "R-values" и "WHAT_CHECK validation". Показатели качества для неоптимизированной и оптимизированной структур представлены в таблице:Показатели качества структуры записи 1F30
| Показатели качества | Неоптимизированная структура | Полностью оптимизированная структура |
| R | 0.2471 | 0.1958 |
| R-free | 0.2832 | 0.2388 |
| σR-free | 0.0028 | 0.0023 |
| R-free Z-score | 4.75 | -1.65 |
| 1st generation packing quality | 0.632 | 0.760 |
| 2nd generation packing quality | 0.302 | 0.444 |
| Ramachandran plot appearance | -2.809 | 0.368 |
| Chi-1/Chi-2 rotamer normality | -1.741 | -1.442 |
| Backbone conformation | 0.890 | 0.683 |
| Bond length RMS Z-score | 0.321 | 0.501 |
| Bond angle RMS Z-score | 0.582 | 0.716 |
| Total number of bumps | 426 | 466 |
| Unsatisfied H-bond donors/acceptors | 185 | 174 |
Таким образом, после оптимизации улучшились следующие параметры: значение R-value; R-free; значения торсионных углов φ и ψ на карте Рамачандрана; комфортность окружения атомов; значения торсионных углов χ-1 и χ-2 боковых цепей; число атомов, способных образовывать водородные связи, но их не образующих.
После оптимизации ухудшились следующие параметры: разность R-R-free (в оптимизированной структуре стала чуть больше); конформация остова; длины связей и валентные углы; количество атомов с недостоверно коротким межатомным расстоянием.
В целом, оптимизация сильно повысила качество структуры белка записи 1F30.
Изучение оптимизированной структуры записи 1F30
Скачаем с сервера EDS оптимизированную структуру записи 1F30 и сохраним ее в файле 1f30_final.pdb. В целом структуры схожи (в оптимизированной структуре остатки сдвинуты незначительно).Сравним расположение остатка Asp-23 цепи K в исходной и оптимизированной структуре белка. Для этого получим изображение этих остатков:
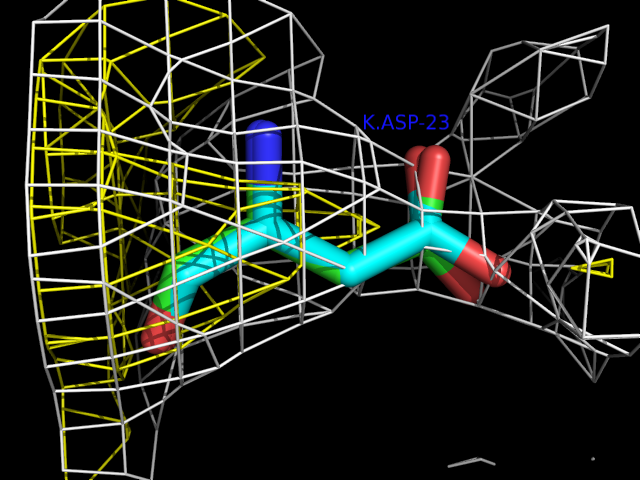
Углероды исходной структуры окрашены зеленым, оптимизированной - синим. Плотность уровня 1 окрашена желтым, уровня 0.5 - белым.
Как видно из рисунка, остаток сдвинулся очень незначительно. В основном, смещение заключается в небольшом повороте боковой цепи. Засчет этого поворота, боковая цепь чуть лучше вписалась в электронную плотность, но это улучшение очень незначительно. Таким образом, даже в оптимизированной структуре остаток Asp-23 цепи K не вписывается в свою электронную плотность.
Выдача WHAT_CHECK для записи 1F30
Рассмотрим выдачу WHAT_CHECK для записи 1F30. Из выдачи можно получить следующую информацию:- есть ли какие-нибудь различия между идентичными цепями;
- есть ли какие-либо стерические нарушения в структуре молекулы (дополнительные внутрицепочечные ковалентные связи, перекрывания атомов, остатки, расположенные внутри лигандов, и т.д.);
- карта Рамачандрана для каждой цепи;
- вторичная структура цепей по данным DSSP;
- есть ли какие-либо нарушения в последовательностях белка (утраченные атомы остатков, С-концевой азот и т.д.);
- информация о температурном B-факторе;
- допустима ли конформация боковых цепей остатков;
- есть ли какие-либо нарушения в названиях атомов, остатков, цепей (одинаковые имена у 2 разных атомов, остатков, цепей и т.д.);
- есть ли какие-либо нарушения в геометрии структуры (недостоверные длины валентных связей, валентные углы, ошибка в хиральности, неплоские ароматические кольца);
- достоверны ли значения всех торсионных углов (информация о ротомерах и остове);
- информация об атомах с очень коротким межатомным расстоянием;
- информация о комфортности окружения атомов;
- информация о контактах белка с молекулами воды и о водородных связях внутри белка.