Изображения поверхностей димера пуриновых репрессоров записи 2PUE
Для выполнения заданий 1-3 воспользуемся файлом с биологической единицей димера пуриновых репрессоров записи 2PUE, сохраненной в файле 2pue_1.pdb.а) Для изображения поверхности контакта мономера белка с симметричным мономером на фоне остовной (ribbon) модели мономера была проведена следующая серия команд:
select ob1, chain a+d select contactzone, chain a and (chain d around 5.5) remove chain d show surface, contactzone set transparency, 0.2 set surface_quality, 1Таким образом, вначале был создан объект ob1, включающий в себя обе цепи димера. Затем командой select была определена зона контакта contactzone на цепи D. После этого из объекта была удалена цепь А. Команда show surface изобразила поверхность зоны контакта на цепи D. Команда set transparency позволила сделать поверхность полупрозрачной. Команда set surface_quality улучшила качество изображения.
В результате было получено следующее изображение:
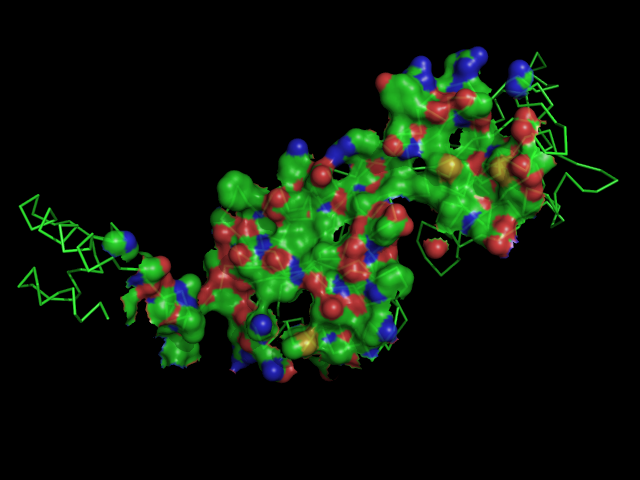
б) поверхность контакта димера белков с двойной спиралью ДНК на фоне остовной модели части белка, вовлечённой в контакт:
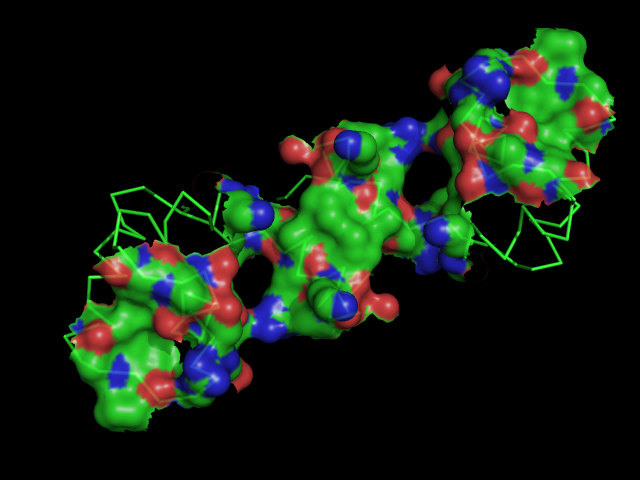
в) поверхность контакта ДНК с димером белков на фоне проволочной (sticks) модели двойной спирали:
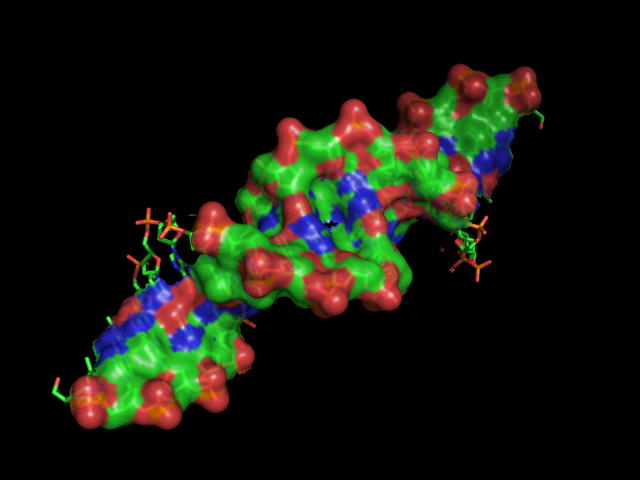
Площадь контакта мономеров белка записи 2PUE согласно данным сервиса PROTORP
Воспользуемся сервисом PROTORP и найдем площадь контакта мономеров белка записи 2PUE. Для этого загрузим через специальное поле файл 2pue_1.pdb и выберем цепи, площадь контакта между которыми хотим найти (в данном случае цепи А и D). На выходе получаем страничку с результатами.Таким образом, площадь контакта мономеров белка (Interface Accessible Surface Area) составляет 2543.85 Å2. На гидрофобные взаимодействия приходится 44.17% этой площади (процент вклада неполярных атомов в площадь контакта).
Гидрофобные кластеры мономеров белка записи 2PUE согласно данным сервиса CluD
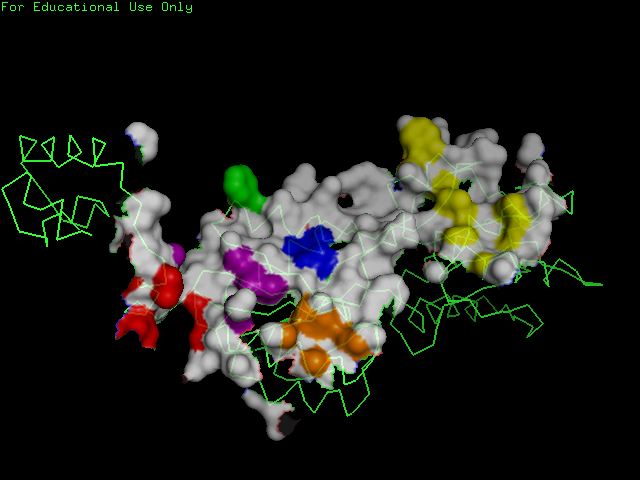
Воспользуемся сервисом CluD и определим гидрофобные кластеры на интерфейсе мономеров белка записи 2PUE объемом не менее 10 атомов. На выходе получаем список атомов, образующих гидрофобные кластеры. Почему-то, в выданном списке атомов перечислялись и кластеры, состоящие из меньшего числа атомов (хотя при запуске программы в специально указанном поле было поставлено число "10"). Поэтому выходной файл был немного отредактирован вручную и сохранен в файле clust.txt.Создадим изображение поверхности контакта мономера белка (цепи А) с симметричным мономером на фоне остовной модели мономера, на котором поверхность, относящаяся к атомам, входящим в найденные гидрофобные кластеры, выделена разными цветами, а остальная поверхность окрашена белым цветом. Для этого вначале напишем программу на языке Perl, которая создаст скрипт для PyMOL, приняв на вход список атомов цепи А, входящих в кластеры. Программа была сохранена в файле clust.pl, а скрипт - в файле clust.pml. В результате работы скрипта было получено следующее изображение:
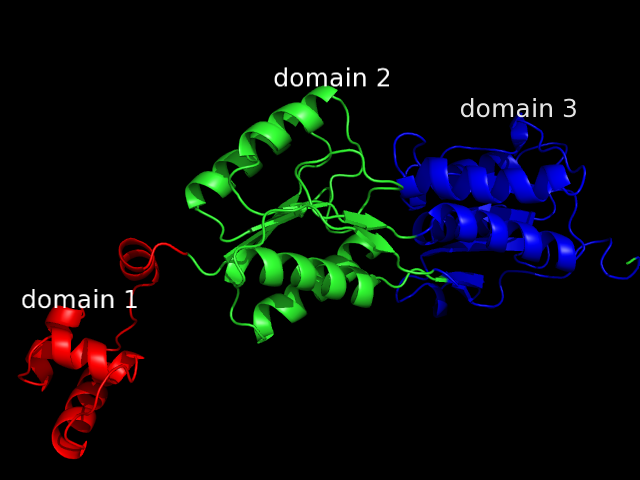
Доменная структура цепей белков записей 2PUE и 1F30 согласно данным сервиса pDomains
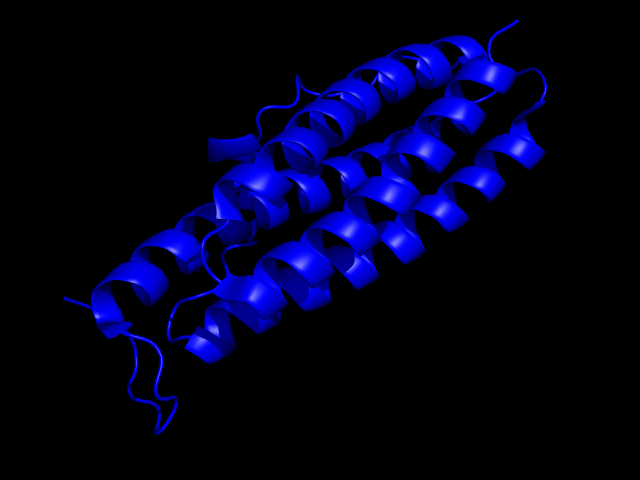
Определим на сервисе pDomains доменную структуру белков.а) Для цепи А белка записи 1F30 все методы выделения доменов определили только 1 домен. Причем, приблизительно половина методов определила его координаты с 12 по 167 остаток (длина цепи составляет 167 остатков), а другая половина методов - с 1 по 167 остаток. Всего один метод (PUU) определил домен с 1 по 156 остаток. Если посмотреть на пространственную структуру цепи А белка, то в ней, действительно, сложно выделить какой-то структурный домен. Вся цепь в целом образует полноценную глобулу:

Изображение той же цепи в ленточной модели:
Такая же доменная структура имеется у других цепей белка (все они имеют одинаковую последовательность, так что этот факт не вызывает удивления).
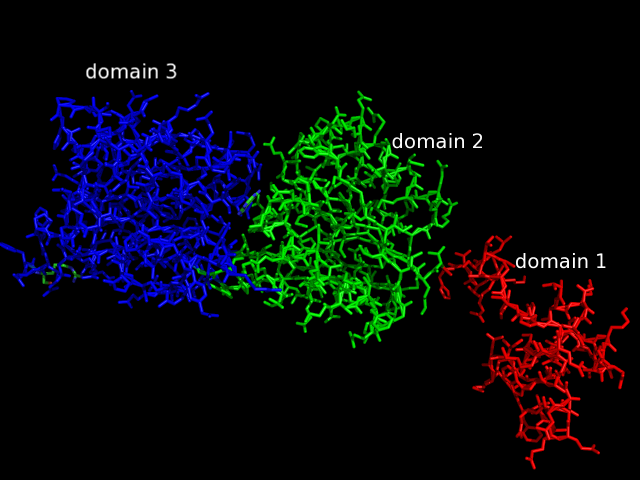
б) Для цепи A белка записи 2PUE картина доменной структуры получилась достаточно интересной. Почти все методы выделения доменов определили в этой цепи 3 домена. Первый из них находится на N-концевом цчастке цепи. Далее идет второй домен, а третий находится либо после второго, либо внутри него (причем, два метода определили такую доменную структуру: 1-2-3-2-3). Один из методов определил лишь 2 домена (SCOP), а метод DDomain определил всего один домен.
Самыми достоверными мне кажутся результаты методов CATH (определивший структуру 1-2-3-2-3) и SCOP (1-2). Действительно, если посмотреть на структуру цепи, один домен (N-концевой) выделяется однозначно. В оставшейся структуре можно выделить 2 домена, но расположены они близко и обособлены слабо. И, все-таки, гидрофобных ядра в них два, в связи с чем программа CATH выделила, пожалуй, более правильную доменную структуру. Изображение цепи с раскраской по доменам согласно данным метода CATH в остовной модели представлено ниже:
Изображение той же цепи в ленточной модели: