
В ходе данного практикума сравнивали структуры одного белка рустицианина в восстановленной форме (reduced rusticyanin), полученные различными методами. Наложение одной полученной структуры на другую показано на рисунке 1. Структура, полученная методом рентгеноструктурного анализа (РСА), имеет PDB ID 1A3Z (на рисунке 1 окрашена в розовый). Разрешение данной модели равно 1.9 Å. Структура, полученная с помощью ЯМР-спектроскопии, имеет PDB ID 1CUR, она представлена 15 моделями (на рисунке 1 окрашены в фиолетовый). Первое различие можно заметить сразу при загрузке структур: в моделях, полученных методом ЯМР нет молекул растворителя, в отличии от РСА модели. Это объясняется тем, что при ЯМР-спектроскопии используют дейтерированные растворители. В целом, структуры, полученные двумя методами очень схожи, однако есть и заметные различия. Большая часть элементов вторичной структуры сопоставляется между двумя моделями, расхождения в пространственном положении аминокислот в основном заметны в петлях, выходящих на поверхность глобулы, или на концах аминокислотной цепи. Дело в том, что в кристалле все части белка принимают наиболее стабильную конформацию, эти части белка в нативных условиях подвижны, особенно это качается участков, не фиксированных жестко в белковой глобуле. Первые пять аминокислотных остатков отсутствуют в модели РСА, однако присутствуют в модели ЯМР (рисунок 2). Вероятнее всего эти остатки не имеют строго определенного положения (что подтверждается различиями между моделями ЯМР в этой области) и при кристаллизации занимают различные позиции в разных ячейках, поэтому определить их положение методом РСА не удается. Некоторые элементы вторичной структуры, в моделях ЯМР имеют большую протяженность. Например, на рисунке 3 &beta-лист, который в РСА структуре состоит из двух более коротких тяжей, в ЯМР моделях включает в себя один целый странно изогнутый &beta-тяж. Такое различие может быть связано с особенностями алгоритма расшифровки ЯМР структуры по атомам водорода. Еще одним важным отличием ЯМР модели является то, что в ней присутствуют атомы водорода, которые не видны на РСА модели с разрешением 1.9 Å.

Рисунок 1: сравнение моделей рустицианина, полученных методами РСА (окрашена в розовый) и ЯМР-спектроскопии (окрашены в фиолетовый).

Рисунок 2: начальный участок аминокислотной цепи рустицианина, полученный методом РСА (окрашен в розовый) и ЯМР-спектроскопии (окрашены в фиолетовый).

Рисунок 2: &beta-тяж в структуре белка рустицианина, полученной методом РСА (окрашена в розовый) и ЯМР-спектроскопии (окрашены в фиолетовый).
Запись в PDB, полученная методом ЯМР, представляет собой набор моделей, которые, по мнению авторов, наилучшим образом соответствуют реальной структуре. Неполнота данных об ограничениях на расстояния и ковалентную связность между атомами может быть связана с подвижностью этих атомов, но также обуславливается несовершенством эксперимента. В идеале модели ЯМР отражают вариацию в позициях белка, а полученные в эксперименте значения RMSF отражают реальную подвижность отдельных его участков. На рисунке 4 приведено соотношение значений RMSF, рассчитанных в результате анализа моделей ЯМР, и B-факторов, полученных методом РСА. Сравниваются значения для одних и тех же аминокислот белка рустицианина (RMSF или B-фактор аминокислотного остатка это среднее по соответствующим значениям составляющих его атомов). При сравнении структур в PyMOL было замечено, что первые пять аминокислотных остатков отсутствуют в модели PCA, поэтому значения B-фактора и RMSF рассматривались для 150 аминокислотных остатков, с 6 до 155 (последнего). На диаграмме рассеяния видно, что значения, характеризующие подвижность аминокислотных остатков в разных методах анализа структуры, соотносятся. В целом остатку с большим B-фактором соответствует большее значение RMSF, однако зависимость не линейная. Таким образом, если считать B-фактор из модели РСА точным отображением реальной подвижности, то, исходя из данных наблюдений для белка рустицианина, RMSF из ЯМР модели тоже отображает подвижность.
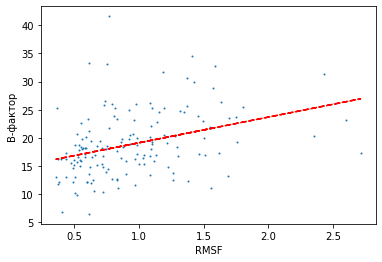
Рисунок 4: соотношение B-фактора аминокислотного остатка, полученного из РСА модели 1A3Z, и RMSF из ЯМР модели 1CUR.
В структуре, полученной методом РСА было выбрано три водородных связи, информация о них приведена в таблице 1.
Таблица 1: примеры водородных связей в структуре белка рустицианина, расстояния между донором и акцептором, определенные различными методами.
| Положение в структуре | Связанные остатки | Расстояние в РСА, Å | Процент моделей ЯМР со связью | Минимальное расстояние в ЯМР, Å | Максимальное расстояние в ЯМР, Å | Медиальное расстояние в ЯМР Å |
| Mежду атомами остова в ядре белка (в бета-листе) | PHE-125, VAL-74 | 2.9 | 100% | 2.8 | 3.6 | 3 |
| Между атомами боковых цепей в ядре белка | HIS-85, ASN-80 | 2.8 | 60% | 2.8 | 4.5 | 3 |
| Между атомами в петлях, выходящих на поверхность глобулы | LYS-92, LYS-92 | 3 | 6.7% | 3 | 8.5 | 6.8 |
Первая водородная связь образована атомами остова фенилаланина 125 и валина 74, оба аминокислотных остатка входят в состав &beta-листа (рисунок 5). Донором при образовании связи выступает азот фенилаланина, а акцептором кислород валина. Данная водородная связь была выбрана по структуре, определённой методом РСА, однако она присутствует во всех ЯМР моделях. Это может быть связано с тем, что &beta-лист находящийся в глобуле белка устойчив и мало подвержен изменениям, то есть расстояние и угол между донором и акцептором в белке колеблется слабо.
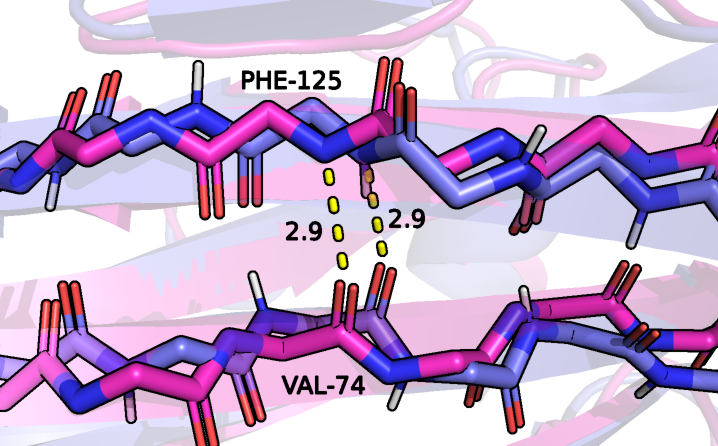
Рисунок 5: водородная связь между атомами PHE-125 и VAL-74 в составе белка рустицианина (РСА модель окрашена в розовый, первая ЯМР модель окрашена в фиолетовый). Водородная связь показана желтым пунктиром.
Вторая рассмотренная водородная связь (рисунок 6) образована атомами боковых радикалов гистидина 85 (азот является донором) и аспарагина 80 (кислород является акцептором). Данная связь также находится внутри белковой глобулы. Такая водородная связь есть в 9 из 15 моделей ЯМР, одна из моделей, где связь есть показана на рисунке 7. На рисунке 7 показана модель, где связи явно нет.
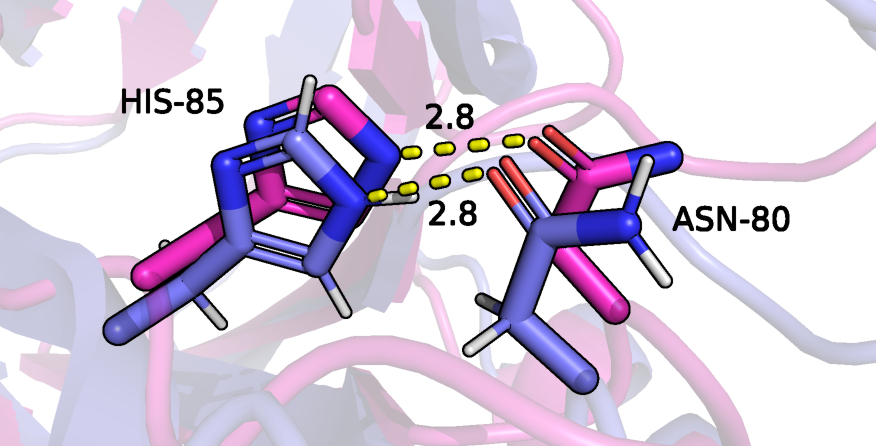
Рисунок 6: водородная связь между атомами HIS-85 и ASN-80 в составе белка рустицианина (РСА модель окрашена в розовый, пятая ЯМР модель окрашена в фиолетовый). Водородная связь показана желтым пунктиром.
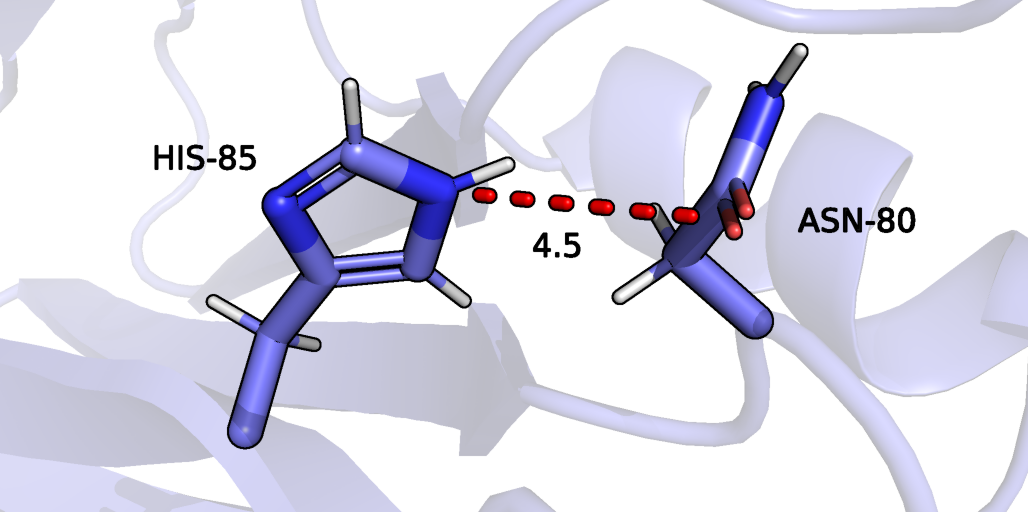
Рисунок 7: аминокислотные остатки HIS-85 и ASN-80 в составе белка рустицианина, пятнадцатая ЯМР модель, атомы, которые в других моделях связаны водородной связью соединены красным пунктиром.
В качестве донора для третьей водородной связи выступает атом азота радикала лизина 92, акцептором является кислород остова глицина 93 (рисунок 8). Эти аминокислотные остатки входят в состав петли на поверхности глобулы. Из 15 моделей ЯМР данная водородная связь может быть только в одной, показана на рисунке 9. Пример модели, где образование такой водородной связи невозможно приведен на рисунке 10.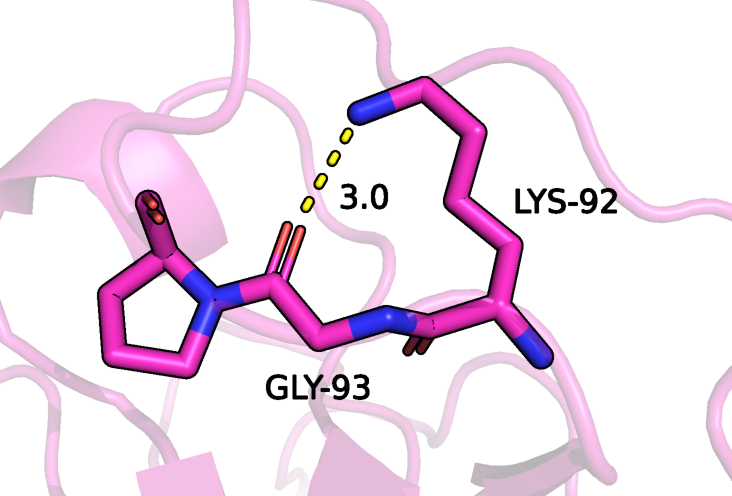
Рисунок 8: водородная связь между атомами GLY-93 и LYS-92 в составе белка рустицианина (модель, полученная методом РСА). Водородная связь показана желтым пунктиром.
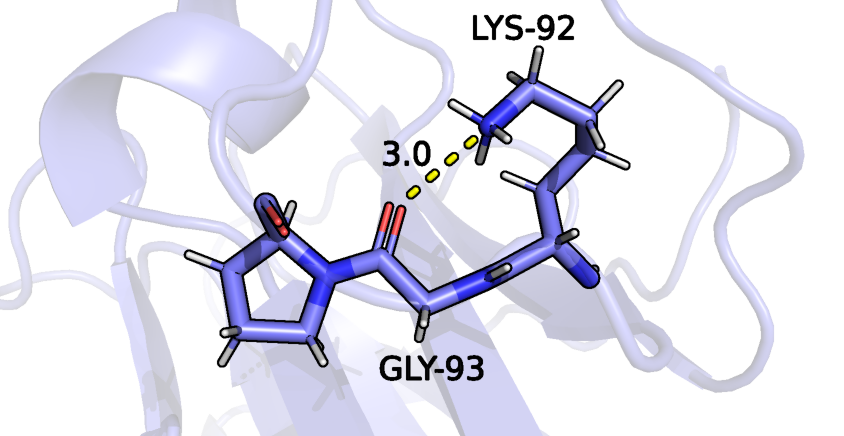
Рисунок 9: водородная связь между атомами GLY-93 и LYS-92 в составе белка рустицианина (тринадцатая модель ЯМР). Водородная связь показана желтым пунктиром.
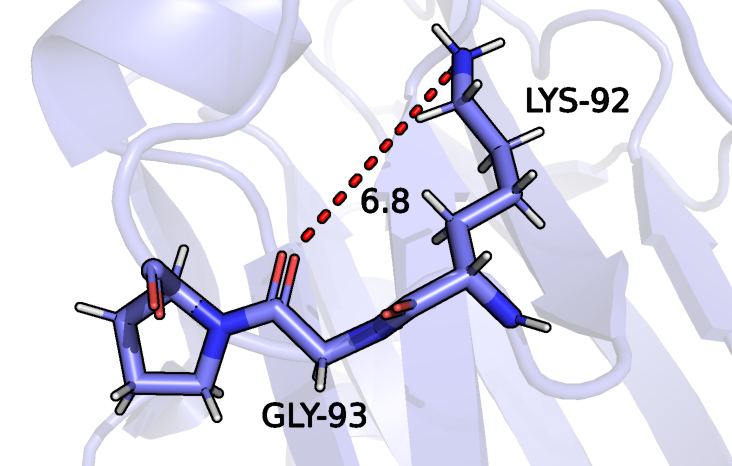
Рисунок 10: Атомы GLY-93 и LYS-92 в составе белка рустицианина, первая ЯМР модель, атомы, которые в модели РСА связаны водородной связью соединены красным пунктиром.
Таким образом, наблюдается определенная тенденция, в первом случае водородная связь есть во всех моделях ЯМР, во втором чуть более чем в половине, в третьем всего в одной. Первая водородная связь участвует в поддержании структуры &beta-листа и образуется всегда. Вторая водородная связь чуть менее «консервативна» и, если считать, что ЯМР модели действительно отображают динамическую подвижность белка, может разрываться и образовываться при колебании аминокислот в белке. Третья связь между атомами на поверхности белковой глобулы в растворе образуется редко и является скорее артефактом кристаллизации.
Седьмой семестр (осенний семестр 2020)