|
Геном Halobacterium salinarum секвенировали с целью
исследования ее приспособлений к жизни в средах c
повышенной концентрацией соли,а также для общего
научного исследования и дальнейшего практического применения.
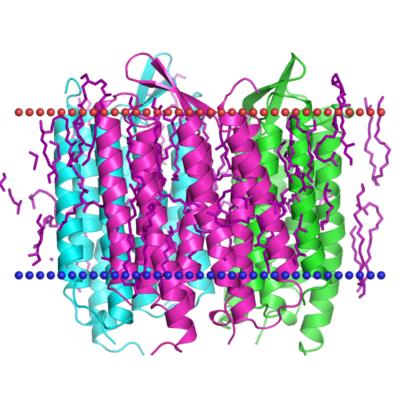
В результате исследований в клеточной мембране
H. salinarum был обнаружен ретинальсвязывающий белок
(до этого такие белки были известны исключительно в
фоторецепторных клетках сетчатки животных), вовсе не
фоторецептор, как родопсин зрительный, а
светоактивируемая протонная помпа, т.е.он перекачивает
протоны через мембрану (изнутри наружу), используя для
этого энергию света. Создаваемый таким образом
электрохимический градиент протонов клетка использует
для синтеза АТФ или других процессов,требующих затраты
энергии. Считается, что такой способ утилизации солнечной
энергии одной единственной молекулой возник в ходе
эволюции задолго до появления куда более сложно
организованного фотосинтеза на основе хлорофилла.
Далее, оказалось, что у того же вида архей кроме
бактериородопсина есть еще три других ретинальсвязывающих
белка. Один из них под действием света перекачивает
через мембрану не протоны, а ионы хлора в противоположном
протонам направлении, запасая дополнительную энергию.
А два остальных работают так и как фоторецепторы,
позволяя клеткам H. salinarum скапливаться в местах,
освещенных оранжевым светом (бактериородопсин лучше
всего поглощает именно этот свет), и избегать опасного
коротковолнового света.
Елена Говорунова, кафедрa физиологии растений
Биологического факультета МГУ (1985 г.)
|