Исследование белок-нуклеиновых контактов
1.
Заданный файл PDB:HLH (Helix-loop-helix DNA-binding domain) 1NKP
можно найти в файле: 1NKP.pdb
2.
В тексте полученных структур необходимые атомы называются так:
основания в цепях ДНК называютя dc,dg,da,dt.
атомы остатка сахара -- C1',C2',C3',C4',O4'.
атомы фосфорной кислоты -- OP1,OP2,P.
атомы азотистых оснований -- C2,N3,C4,N4,C5,C6,N1,O2.(для C)
После запуска скрипта dna.def, были выделены множества:
base - все атомы оснований ДНК (эквивалентно dna and not backbone);
mjg - атомы оснований ДНК, обращённые в большую бороздку ("major groove");
mig - атомы оснований ДНК, обращённые в малую бороздку ("minor groove").
Далее были определены множества полярных и неполярных атомов ДНК.
полярные: атомы кислорода и азота. Для 2'-дезоксирибозы: "*.О?"
Для полярных атомов остатков фосфорной кислоты: "*.ОР?"
Для полярных атомов азотистых оснований, обращенных в большую бороздку: (oxygen,nitrogen) and mjg
Для полярных атомов азотистых оснований, обращенных в малую бороздку: (oxygen,nitrogen) and mig
неполярные:атомы углерода.
Для 2'-дезоксирибозы: " *.C?* "
Для неполярных атомов бороздки: "carbon and..."
Расстояния при поиске полярных контактов были взяты 3,5 A, при поиске неполярных - 4,5 A.
Полярные взаимодействия атомов белка с ДНК: spacefill 200
Гидрофобные взаимодействия атомов белка с ДНК: spacefill 300
Скрипт: script.spt
Результаты в таблице (велся поиск суммарного числа контактов для всей структуры):
| |
Полярные |
Неполярные |
Всего |
| Контакты белка с ... |
|
|
|
| ... остатками 2'-дезоксирибозы |
3 |
29 |
32 |
| ... остатками фосфорной кислоты |
31 |
37 |
68 |
| ... остатками азотистых оснований со стороны большой бороздки |
14 |
23 |
37 |
| ... остатками азотистых оснований со стороны малой бороздки |
0 |
0 |
0 |
Количество неполярных контактов с белком превышает количество полярных взаимодействий. Остатки
азотистых оснований со стороны большой бороздки, видимо, играют важную роль в образовании
водородных связей. Впрочем, как и в гидрофобных контактах с белком.
Остатки же азотистых оснований со стороны малой бороздки не образуют контактов с белком.
3.
На этом рисунке показан контакт гистидина 906 и гуанина 313.
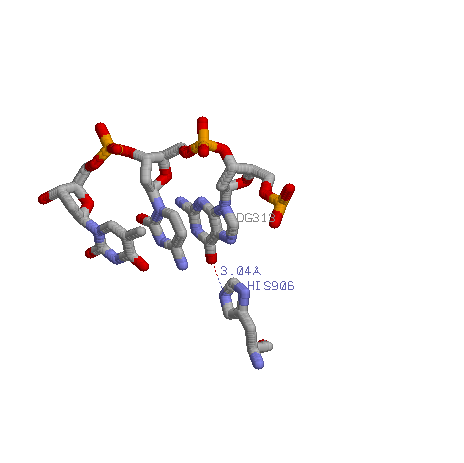
4.
C помощью Uniprot были найдены следующие сведения о заданном белке:
Название - MYC_HUMAN
АС в UniProt -P01106; P01107; Q14026;
Относится к семейству HLH(PF00010). Это структура ДНК-связывающих доменов через мотив "спираль-петля-спираль"
(helix-loop-helix). Базовые "спираль-петля-спираль" белки - это группа эукариотических факторов транскрипции,
которые определяют пути развития. Этот фактор транскрипции, известный как сильно
эволюционно консервативный bHLH домен, который играет роль в образовании специфичного димера.
Они облегчают переход из неактивных мономеров в транс-активыне димеры на нужной стадии развития.
Выравнивания Pfam
Здесь можно увидеть, что рассмотренный специфический контакт( в задании 3), является консервативным.
Координаты,указанные в выравнивании не совпадают с теми номерами позиций белков, которые есть в файле pdb.
Но здесь можно найти как именно была изменена нумерация.
5.
С помощью программы nucplot были получены следующие изображения.
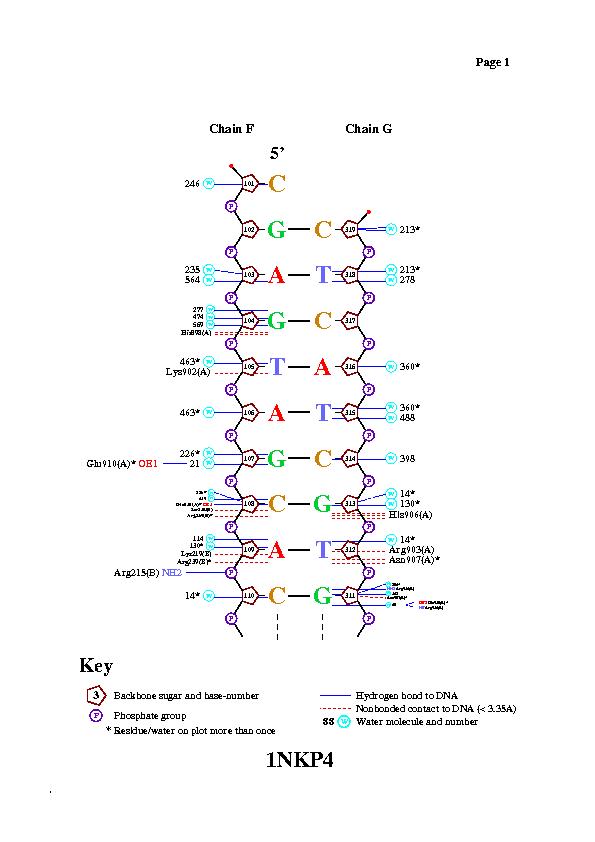
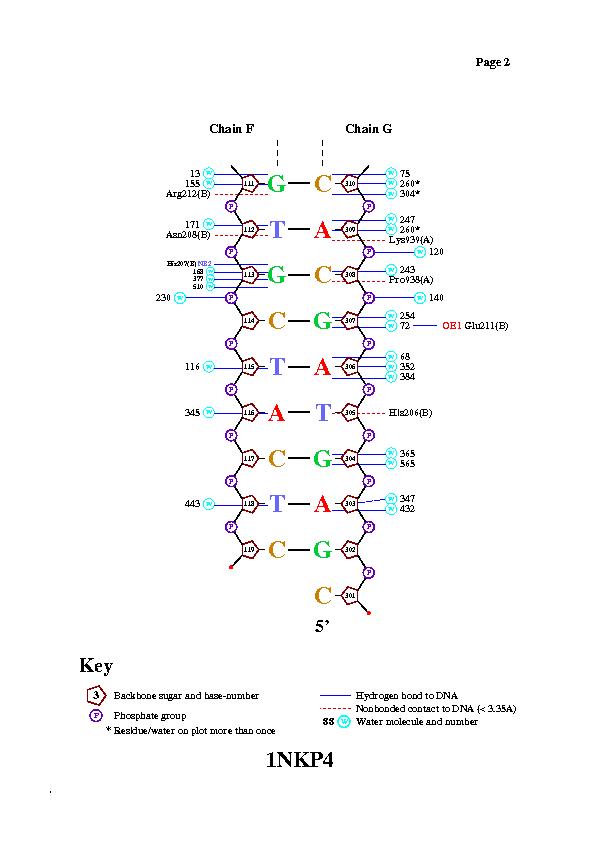
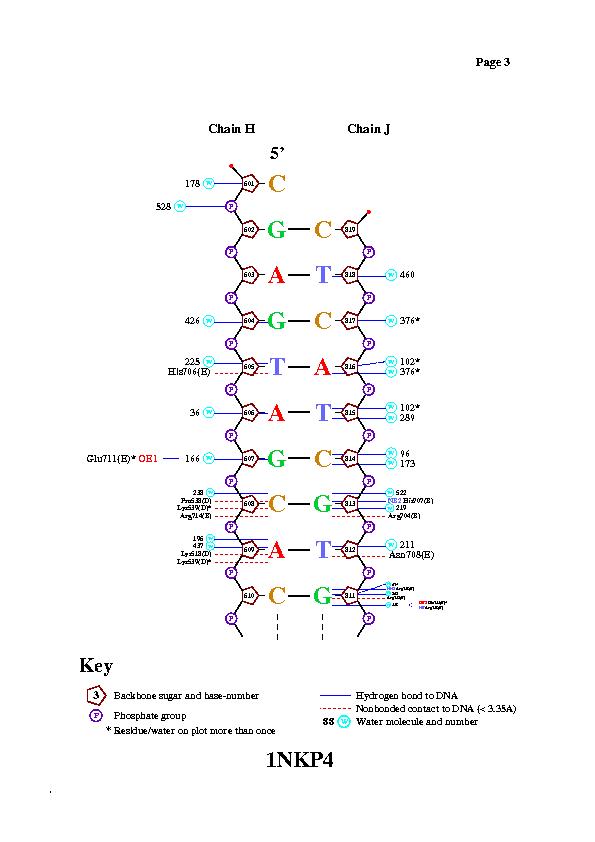
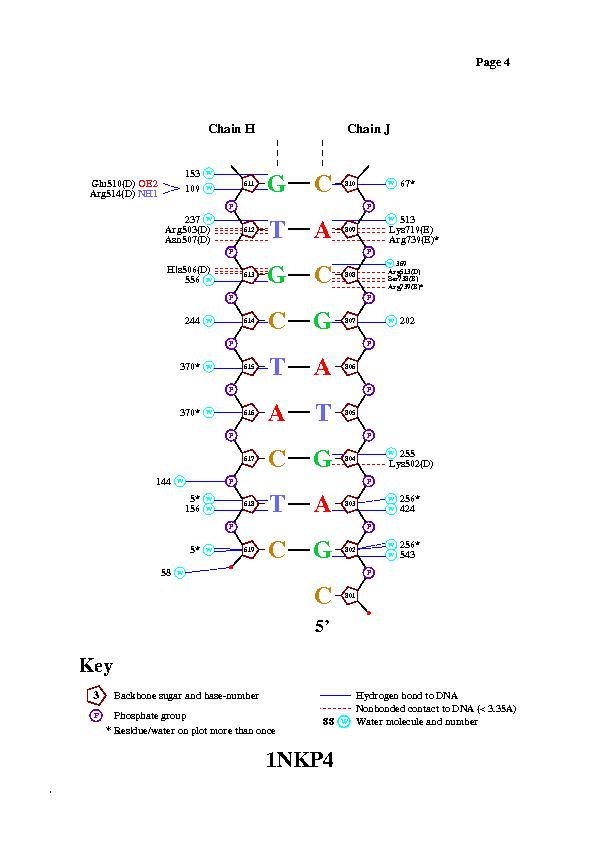 Изображения подтверждают предположение о контакте, указанном выше.
Изображения подтверждают предположение о контакте, указанном выше.
вернуться на главную
©Пономарева Ольга




 Изображения подтверждают предположение о контакте, указанном выше.
Изображения подтверждают предположение о контакте, указанном выше.