| Учебный сайт Екатерины Швецовой | |||
| Главная | Обо мне | Семестры | Ссылки |
| 1 семестр | 2 семестр | 3 семестр | 4 семестр | 7 семестр | 8 семестр |
Мембранные белки
В рамках данного задания нужно было проверить корректность предсказания трансмембранных участков сервисом TMHMM и проверить консервативность различных частей трансмембранных белков.
Для этого была составлена репрезентативная выборка гомологов белка Bacteriorhodopsin (идентификатор PDB - 4X32) археи Halobacterium sp. NRC-1. Поиск гомологов осуществлялся с помощью blastp в базе данных nr (в Swissprot гомологов белка было слишком мало, в Refseq - у находок были слишком плохие значения % identity). Поиск производился отдельно по трём суперсемействам, при поиске по бактериям были исключены филумы Proteobacteria, Firmicutes, Actinobacteria, чтобы получить больше редких последовательностей.. В выборку было включено 6 белков архей, 6 белков бактерий, 10 белков эукариот. Выбранные белки имеют не очень большое, но удовлетворительное значение e-value и Identity не менее 35%.
Последовательности всех найденных гомологов были объединены в общий файл и выравнены с помощью сервера Muscle. Полученное выравнивание было открыто в программе Jalview. Изображение выравнивания можно увидеть на рис. 1

Рис. 1 Выравнивание репрезентативной выборки гомологов белка Bacteriorhodopsin археи Halobacterium sp. NRC-1. Раскраска ClustalX. Изображение получено с помощью программы Jalview.
С последовательностью белка 4X32 была ассоциирована его трёхмерная структура (для этого нужно щелкнуть правой кнопкой мыши на названии белка, выбрать в меню пункт Structure -> Associate structure with a sequence и дать PDB-файл, или PDB ID), на основе которой в строке аннотации TM_REAL отмечены участки трансмембранных спиралей белка. Также принималась во внимание информация о белке 4X32, полученная с помощью сервера предсказания PPM базы данных ОРМ.
Далее с помощью программы TMHMM для гомолога heat shock protein 30 (идентификатор Genbank ELA23788.1) гриба Colletotrichum gloeosporioides Nara gc5 было получено предсказание трансмембранных спиралей - участки 20-48, 55-77, 130-152, 159-178, 193-215, 228-250. Эти предсказанные участки были отмечены в строке аннотации TM_PREDICTED. Изображение графика из выдачи TMHMM можно увидеть на рис. 2.
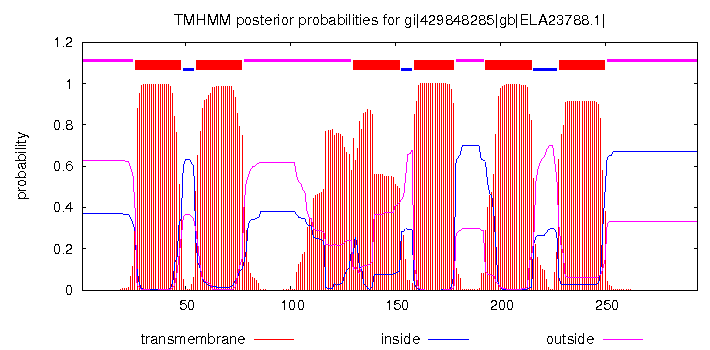
Рис. 2. График из выдачи программы TMHMM для белка heat shock protein 30 гриба Colletotrichum gloeosporioides Nara gc5.
Выравнивание с получившимися аннотациями в двух вариантах раскраски можно увидеть на рис. 3. Изображение белка 4X32 покрашеного в соответствии с выравниванием (также в двух вариантах) можно увидеть на рис. 4.


Рис. 3 Выравнивание гомологов белка Bacteriorhodopsin археи Halobacterium sp. NRC-1 с аннотациями. Первая строчка соответствует последовательности самого белка, вторая - гомологу heat shock protein 30, для которого производилось предсказание TMHMM. Раскраска Hydrophobicity (красный цвет соответствует гидрофобным остаткам, синий - гидрофильным). Наверху - раскраска By Conservation 10%, внизу - Above Identity Threshold 40%. Изображение получено с помощью программы Jalview.

Рис. 4. Изображение трёхмерной структуры белка Bacteriorhodopsin археи Halobacterium sp. NRC-1, покрашенное в соответствии с выравниванием. Соответствующее выравнивание было поркашено раскраской Hydrophobicity. Слева - By Conservation 10%, справа - Above Identity Threshold 40%.
Если посмотреть на выравнивание, покрашенное By Conservation 10% (рис. 3 сверху), то можно заметить, что участки, относящиеся к трансмембранным спиралям более-менее консервативны (по крайней мере по сравнению с участками между спиралями, у которых консервативность намного хуже).
В основном трансмембранные спирали содержат гидрофобные остатки (чаще всего встречаются лейцин и изолейцин), но всё же в них встречается достаточное количество полярных/заряженных аминокислот, некоторые из них даже консервативны (например, аспарагиновая кислота (позиция в выравнивании 143), триптофан (144), треонин (147), тирозин (225, 263)). Это может быть связано с тем, что внутри трансмембранного домена белка эти остатки формируют водородные связи между собой, а, т. к. их плотно окружает гидрофобная часть белка, вариантов для размещения полярных остатков немного. Таким образом, консервативность гидрофобной части мембранной спирали влечёт консерфативность её полярной части.
Программа TMHMM довольно достоверно предсказала шесть из семи трансмембранных спиралей белка 4X32 (различия в границах спиралей не такие значительные и вероятно в наибольшей степени связаны с тем, что для предсказания использовался не сам белок, а его гомолог). Однако, третья (если считать с начала выравнивания) трансмембранная спираль предсказана не была. Если посмотреть на график из выдачи TMHMM (рис. 2), то можно заметить, что перед четвёртой спиралью, совсем рядом с ней находится участок, предположительно являющийся третьей спиралью. Однако, из-за того, что значения вероятности (принадлежать трансмембранной спирали) для этого участка не такое большое и, возможно, из-за того, что он находится слишком близко к участку четвёртой спирали, TMHMM не распознал его как трансмембранную спираль. Возможно, такое снижение значения вероятности принадлежать к трансмембранной спирали произошло потому что в третьей спирали находится довольно большое количество полярных аминокислотных остатков.
© Shvetsova Ekaterina, FBB MSU, 2013
Дата последнего изменения: 07.12.2016