| Учебный сайт Екатерины Швецовой | |||
| Главная | Обо мне | Семестры | Ссылки |
| 1 семестр | 2 семестр | 3 семестр | 4 семестр | 7 семестр | 8 семестр |
Интерпретация ЯМР структуры
В рамках данного практикума проводили сравнение структур рибонуклеазы А быка (BOVINE PANCREATIC RIBONUCLEASE A), полученных разными методами. Структура, расшифрованная методом РСА имеет идентификатор 1A5P (разрешение 1.6 Å), методом ЯМР - 2AAS (32 модели). Обе структуры открыли в одной сессии PyMol и совместили с помощью комманды align. Визуальное изображение совмещения можно увидеть на рис. 1. Заметно, что структуры в целом похожи, различия в основном имеются в районах петель.
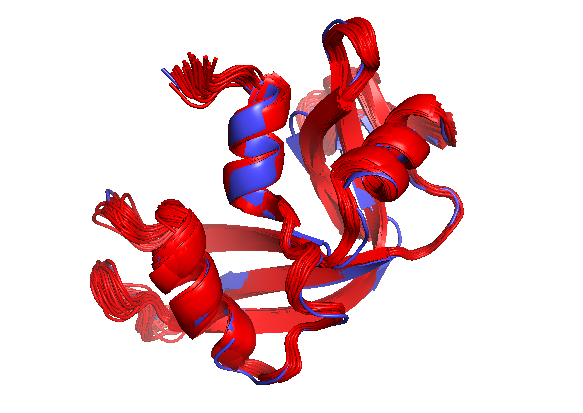
Рис. 1. Визуализация наложения структур 1A5P и 2AAS. Голубым показана структура, расшифрованная методом РСА (1A5P), красным - модели ЯМР (2AAS).
Далее было проведено сравнение водородных связей в структурах. Водородные связи визуализировались с помощью команды (distance hbond, name N*, name O*, 3.5, mode=2) или опции PyMOL (action -> find -> polar contacts). В структуре, расшифрованной методом РСА было выбрано 3 примера водородных связей:- остовная водородная связь в ядре белка: Glu9 (атом N) + Ala5 (атом O) - рис. 2 и 3
- водородная связь боковых цепей в ядре белка: Lys104 (атом NZ) + Ser123 (атом OG) - рис. 4
- водородная связь в петлях, выходящих на поверхность глобулы: Asn94 (атом N) + Lys91 (атом O) - рис. 5
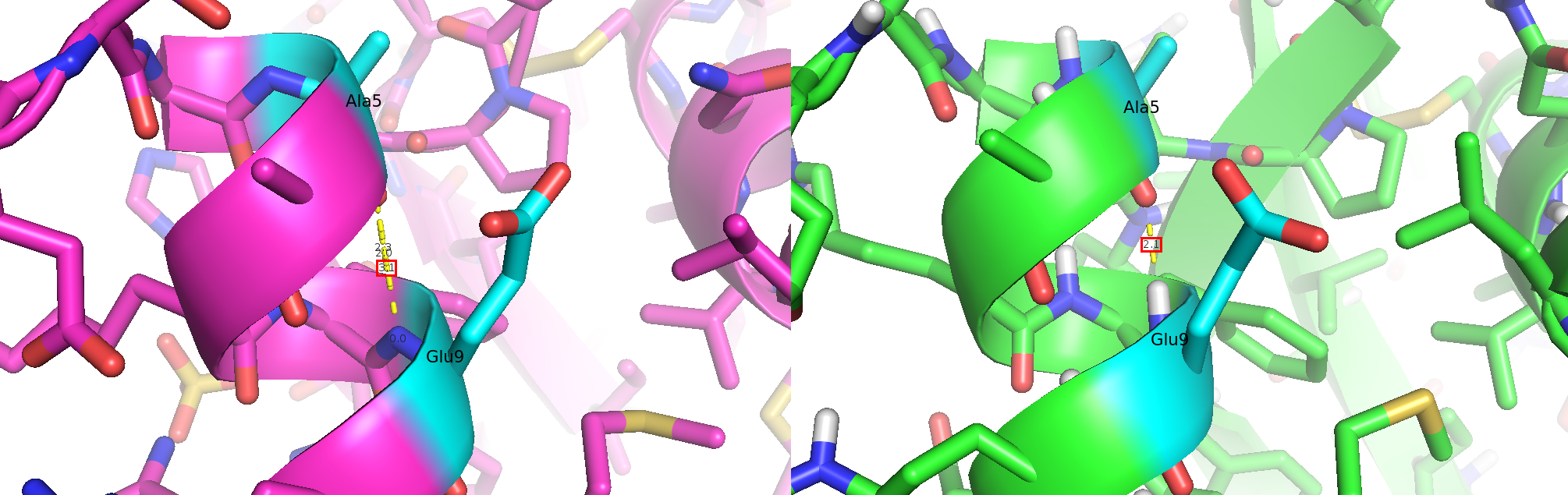
Рис. 2-3. Остовная водородная связь в ядре рибонуклеазы А быка. Слева - по данным РСА, справа - по данным ЯМР (визуализирована одна из моделей).
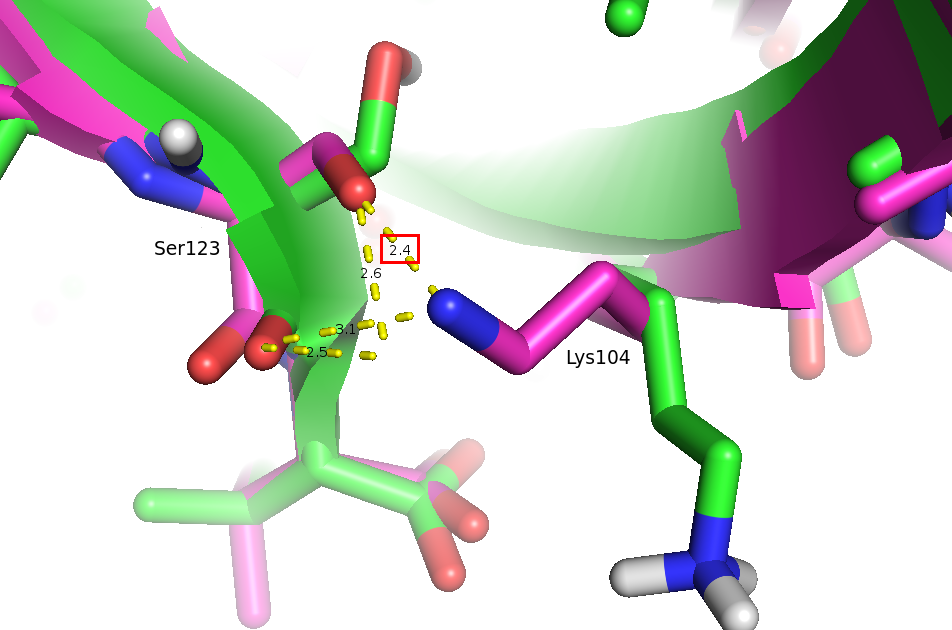
Рис. 4. Водородная связь боковых цепей в ядре рибонуклеазы А быка. Сиреневым выделена структура, расшифрованная с помощью РСА, зелёным - ЯМР (визуализирована одна из моделей).
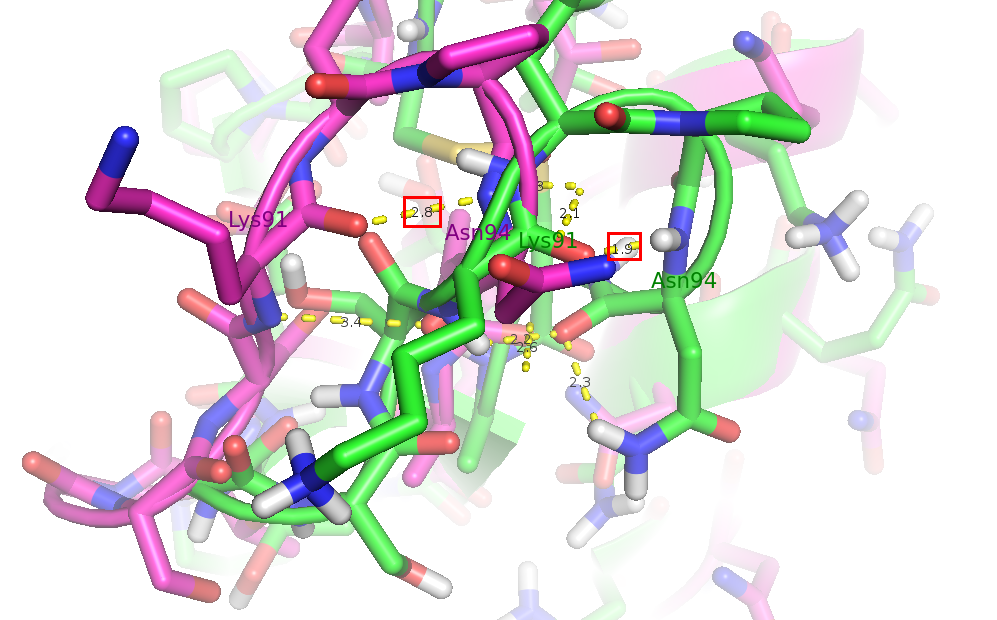
Рис. 5. Водородная связь в петлях, выходящих на поверхность глобулы рибонуклеазы А быка. Сиреневым выделена структура, расшифрованная с помощью РСА, зелёным - ЯМР (визуализирована одна из моделей).
Информация о длинах водородных связей в структуре, расшифрованной РСА и в моделях ЯМР представлена в следующей таблице. Обобщенная информация представлена в таблице 1.Таблица 1. Сравнение водородных связей по данным РСА и ЯМР. Расстояния указаны в ангстремах.
| Донор | Акцептор | Длина связи по данным РСА | Процент моделей ЯМР, содержащих эту связь | Минимальная длина связи по данным ЯМР | Максимальная длина связи по данным ЯМР | Медиана длины связи по данным ЯМР | |
| остовная водородная связь в ядре белка | Glu9 (N) | Ala5 (O) | 3,1 | 100% | 1,9 | 2,2 | 2,1 |
| водородная связь боковых цепей в ядре белка | Lys104 (NZ) | Ser123 (OG) | 2,4 | 0% | - | - | - |
| водородная связь в петлях, выходящих на поверхность глобулы | Asn94 (N) | Lys91 (O) | 2,8 | 90,63% | 1,8 | 2,5 | 2,2 |
© Shvetsova Ekaterina, FBB MSU, 2013
Дата последнего изменения: 29.05.2015