На главную страницу
Электронная плотность, кинематическая теория рассеяния, соответствие модели экспериментальным данным.
Вспомним первый семестр и посмотрим какой у меня был белочек. У меня это THIO_BACSU (2VOC).

Здесь ленточная модель.

А это sticks-модель.
Разрешение системы 1.5 А.
Дальше построем у нашего белка изображение электронной плотности на разных уровнях. Я построил на 1, 2 и 3.

Белок с электроннной плотностью с уровнем 1.

Белок с электроннной плотностью с уровнем 2.

Белок с электроннной плотностью с уровнем 3.

Белок с электроннной плотностью с уровнем 1 (белый) и с уровнем 3 (желтый).
Теперь тоже самое сделаем для трех разных аминокислот. Я выбрал три подряд идущие аминокислоты (22-24 цепи А). Это фенилаланин (ароматика), аланин (алифатика) и аспартат (отрицательно заряжен).

Общая картинка.

Пептид с электроннной плотностью с уровнем 1.

Пептид с электроннной плотностью с уровнем 2.

Пептид с электроннной плотностью с уровнем 3.

Пептид с электроннной плотностью с уровнем 1(белый) и с уровнем 3 (желтый).
Теперь отдельно посмотрим на аминокислоту. Я выбрал 61 глутамин.

Глутамин с электроннной плотностью с уровнем 1.

Глутамин с электроннной плотностью с уровнем 2.
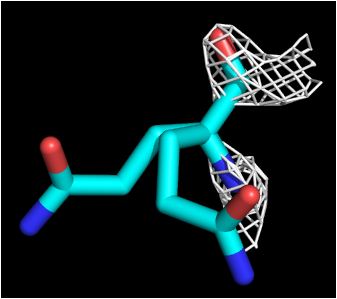
Глутамин с электроннной плотностью с уровнем 3.

Глутамин с электроннной плотностью с уровнем 1(белый) и с уровнем 3 (желтый).
Итак из всех этих рисунков можно сделать такие выводы:
1)Чем больше электронная плотность, тем меньше "радиус изображения" электронной плотности.
2)При больших значениях э.п. не факт, что нам покажут все аминокислоты (картинки с белком).
3)При значениях ближе к 0 границы будут более размытыми и в очень редких случаях нельзя понять, что там за аминоксилота (Этот вывод, только предположение, к примеру для лейцина и изолейцина. Хотя я думаю, что легко понять по э.п. "кто есть кто".).
4)Легче всего определить более электроотрицательные атомы (кислород, азот).
P.S. Я только в конце увидел, что не везде сделал ray на картинках. Sorry =( .
обратно
© Сливко-Кольчик