Исследование ДНК-белковых взаимодействий в структуре комплекса SMAD3 (MH1 домен) и smad-связывающего элемента ДНК.
Краткое описание структуры в файле 1OZJ.pdb
В файле приведены координаты атомов следующих молекул
1. белок SMAD3 (2 MH1-домена)
2. фрагмент связанной с белком двуцепочечной ДНК
Организм: Homo sapiens
Организм экспрессии: Escherichia coli
Для исследования были выбраны цепи A и B белка и цепи C и D, представляющие ДНК со следующей последовательностью:
цепь C [1001] 5' - TCAGTCTAGACATAC - 3' [1015]
цепь D [2015] 3' - AGTCAGATCTGTATG - 5' [2001]
Функции белка, структура которого представлена в файле 1OZJ.pdb
Модулятор траснкрипции, активируемый ТФР-бета (трансформируемым фактором роста) и активин-рецептороподобной киназой 1. Рецепторорегулируемый SMAD.
Исследование структуры ДНК
| | A-форма | B-форма | *Z-форма |
| Тип спирали (правая или левая) |
правая | правая | левая |
| Шаг спирали (Å) |
33.75 | 28.03 | 36.34 |
| Число оснований на виток |
10 | 11 | 9 |
| Ширина большой бороздки (цитозин) |
17.21 | 16.78 | 18.30 |
| Ширина малой бороздки |
11.69 | 7.98 | 9.86 |
excel-файл, описывающий отклонения в величинах торсионных углов данной ДНК
В файле B-форма ДНК.
Нуклеотиды с самыми сильными отклонениями от средних значений торсионных углов
Цепь С: T1007, A1008, C1011, T1013
Цепь D: G2014, T2013, A2009, T2008
Максимально деформирован G2014, возможно, ввиду близости к концу спирали.
Самые большие отклонения у C1011, T1013 наблюдаются для углов гамма и бета, то есть легче всего вращение происходит вокруг связей 5'
и остатка фосфорной кислоты.
Нуклеотидные комплементарные пары A1008-T2008 и T1007-A2009 имеют больше всего контактов с белком
(как "на глаз", так и по результатам работы программы nucplot), что является причиной деформации.
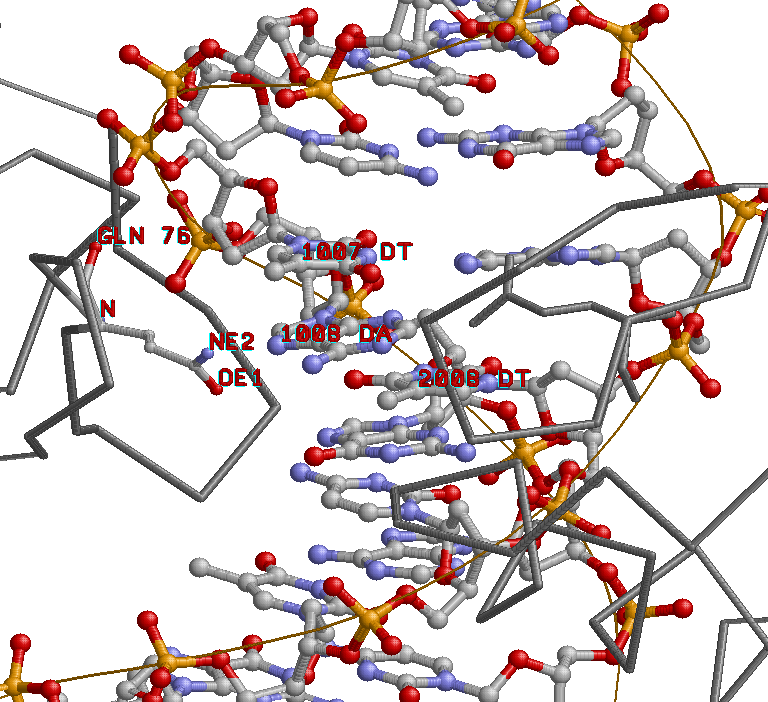
 Исследование природы ДНК-белковых контактов
скрипт, определяющий множества атомов, вовлечённых во взаимодействие
Исследование природы ДНК-белковых контактов
скрипт, определяющий множества атомов, вовлечённых во взаимодействие
| Контакты атомов белка с |
Полярные |
Неполярные |
Всего |
| остатками 2'-дезоксирибозы |
- |
9 |
9 |
| остатками фосфорной кислоты |
9 |
10 |
19 |
| остатками азотистых оснований со стороны большой бороздки |
5 |
5 |
10 |
| остатками азотистых оснований со стороны малой бороздки |
- |
- |
- |
В сторону большой бороздки считаем обращёнными атомы:
С - C4,C5,C6, N4
A - C5, C6, C8, N6, N7
T - C4, C5, C6, C5M, O4
G - C5, C6, C8, N7, O6
В сторону малой -
C - C2, O2
A - O2, N3
T - C2, N2, N3
G - O2
Связывание домена белка с ДНК происходит в области большой бороздки, соответственно, с малой контактов не обнаружено.
Кислород дезоксирибозы также оказался недоступен для аминокислотных остатков.
Получение популярной схемы ДНК-белковых контактов с помощью nucplot
иллюстрация nucplot
Программа указывает на 12 непосредственных взаимодействий аминокислотных остатков с нуклеотидами из 29 предсказанных нами путём измерения расстояний.
Аминокислотный остаток с наибольшим числом контактов с нуклеиновой кислотой - Gln76.
Видим, что он взаимодействует с указанными выше нуклеотидами, вызывая их деформацию.
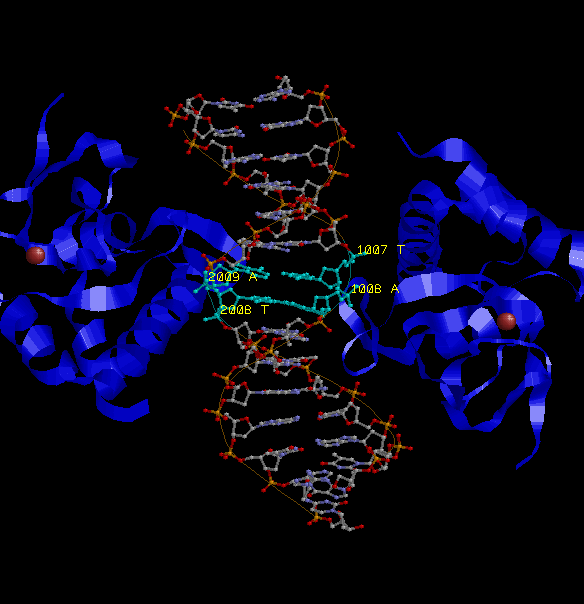
 Характеристика ДНК-связывающего домена MH1
SMAD3 состоит из двух доменов - MH1 и MH2.
Домен MH1 (MAD homology 1) расположен на N-конце белков, родственных MAD, таких как Smadы.
Этот домен отделён от домена MH2 неконсервативным связывающим участком. Из кристаллической структуры MH1 видно, что
высоко консервативная бета-"шпилька" из 11 остатков связывает оптимальную последовательность ДНК GNCN (богатую гуанином и цитозином)
в районе большой бороздки, что необходимо для активации транскрипции целевых генов. Не все MH1, однако, могут связываться с ДНК. SMAD2
неспособен связывать ДНК и содержит в "шпильке" крупный участок, препятствующий этому связыванию. Основная спираль (H2) в MH1 с сигналом
локализации в ядре KKLKK, как выявлено, необходима для импорта Smad3 в ядро. Smadы также используют MH1-домен для взаимодействия с
факторами транскрипции, такими как Jun, TFE3, Sp1 и Runx.
Бета-шпильки выделены голубым
Характеристика ДНК-связывающего домена MH1
SMAD3 состоит из двух доменов - MH1 и MH2.
Домен MH1 (MAD homology 1) расположен на N-конце белков, родственных MAD, таких как Smadы.
Этот домен отделён от домена MH2 неконсервативным связывающим участком. Из кристаллической структуры MH1 видно, что
высоко консервативная бета-"шпилька" из 11 остатков связывает оптимальную последовательность ДНК GNCN (богатую гуанином и цитозином)
в районе большой бороздки, что необходимо для активации транскрипции целевых генов. Не все MH1, однако, могут связываться с ДНК. SMAD2
неспособен связывать ДНК и содержит в "шпильке" крупный участок, препятствующий этому связыванию. Основная спираль (H2) в MH1 с сигналом
локализации в ядре KKLKK, как выявлено, необходима для импорта Smad3 в ядро. Smadы также используют MH1-домен для взаимодействия с
факторами транскрипции, такими как Jun, TFE3, Sp1 и Runx.
Бета-шпильки выделены голубым
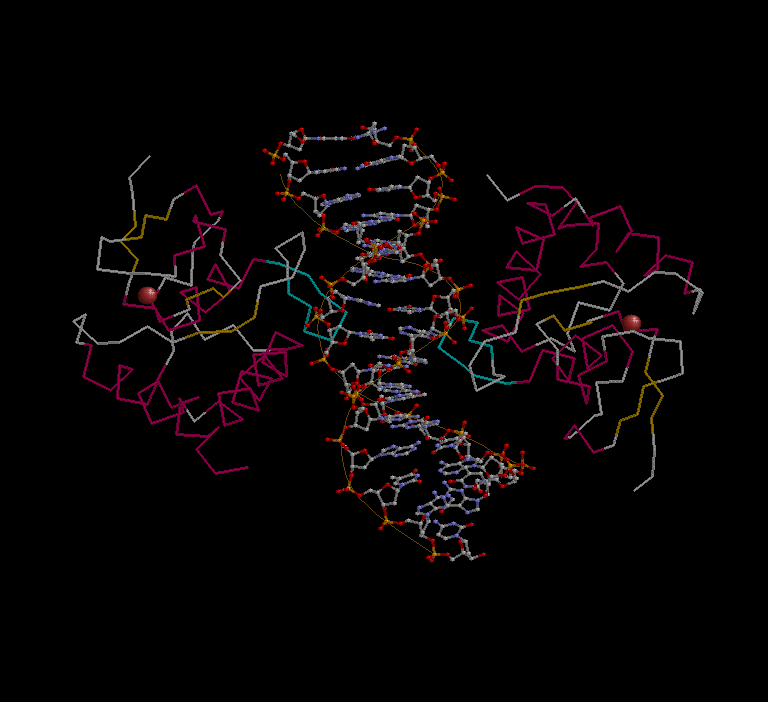
 Исследование природы ДНК-белковых контактов
скрипт, определяющий множества атомов, вовлечённых во взаимодействие
Исследование природы ДНК-белковых контактов
скрипт, определяющий множества атомов, вовлечённых во взаимодействие
 Характеристика ДНК-связывающего домена MH1
SMAD3 состоит из двух доменов - MH1 и MH2.
Домен MH1 (MAD homology 1) расположен на N-конце белков, родственных MAD, таких как Smadы.
Этот домен отделён от домена MH2 неконсервативным связывающим участком. Из кристаллической структуры MH1 видно, что
высоко консервативная бета-"шпилька" из 11 остатков связывает оптимальную последовательность ДНК GNCN (богатую гуанином и цитозином)
в районе большой бороздки, что необходимо для активации транскрипции целевых генов. Не все MH1, однако, могут связываться с ДНК. SMAD2
неспособен связывать ДНК и содержит в "шпильке" крупный участок, препятствующий этому связыванию. Основная спираль (H2) в MH1 с сигналом
локализации в ядре KKLKK, как выявлено, необходима для импорта Smad3 в ядро. Smadы также используют MH1-домен для взаимодействия с
факторами транскрипции, такими как Jun, TFE3, Sp1 и Runx.
Бета-шпильки выделены голубым
Характеристика ДНК-связывающего домена MH1
SMAD3 состоит из двух доменов - MH1 и MH2.
Домен MH1 (MAD homology 1) расположен на N-конце белков, родственных MAD, таких как Smadы.
Этот домен отделён от домена MH2 неконсервативным связывающим участком. Из кристаллической структуры MH1 видно, что
высоко консервативная бета-"шпилька" из 11 остатков связывает оптимальную последовательность ДНК GNCN (богатую гуанином и цитозином)
в районе большой бороздки, что необходимо для активации транскрипции целевых генов. Не все MH1, однако, могут связываться с ДНК. SMAD2
неспособен связывать ДНК и содержит в "шпильке" крупный участок, препятствующий этому связыванию. Основная спираль (H2) в MH1 с сигналом
локализации в ядре KKLKK, как выявлено, необходима для импорта Smad3 в ядро. Smadы также используют MH1-домен для взаимодействия с
факторами транскрипции, такими как Jun, TFE3, Sp1 и Runx.
Бета-шпильки выделены голубым
