Сервис TMHMM используется для предсказания трансмембранных белков. Одной из целей задания было убедиться в корректности его предсказаний.
Мне достался белок 3kcu_A. Это транспортный белок E. Coli.
Для того, чтобы найти гомологи этой цепи, я запустила blastp на сайте EBML EBI с параметрами: количество белков в выдаче - 200; база данных - UniProt Clusters 50%, остальные настройки по умолчанию.
Затем я выровняла белки с помощью алгоритма Muscle (fasta-файл с выравниванием здесь и добавила к получившемуся выравниванию последовательность исходного белка (JalView проект здесь.
При покараске этого выравнивания методом ClustalX видно, что выравнивание не очень хорошее. Некоторые последовательности, которые бы выровнялись особенно плохо, пришлось удалить. (Такие, например, как UniRef50_A0A090T6S4 и UniRef50_A0A0B8Q7K6) Но таких последовательностей было немного.
Затем я разметила исследуемый белок по PDB-файлу (ряд TM_REAL) и белок B7MHL3 c помощью сервиса TMHMM (ряд TM_PREDICTED) - для гомолога.
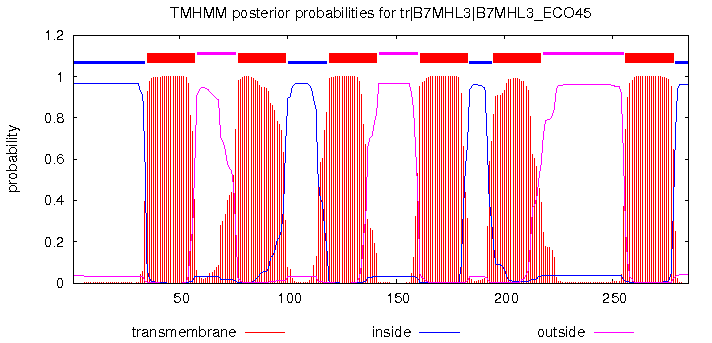
Рис1. Предсказание TMHMM структуры белка 3kcu.
Сервис TMHMM предсказал 6 трансмембранных доменов, как и в исследуемом мной белке. При этом домены разных белков частично перекрывались.
Далее, для удобства, я выбрала раскраску "Hydrophobisity", которая позволяет различать гидрофильные (синие) и гидрофобные (красные) остатки. Затем, я установила порог консервативности (Above Identity Threshold), равный 5%. Порог подбирался экспериментально так, чтобы окраска не была слишком тусклой, но при этом сильно консервативные места визуально легко отличались от менее консервативных.

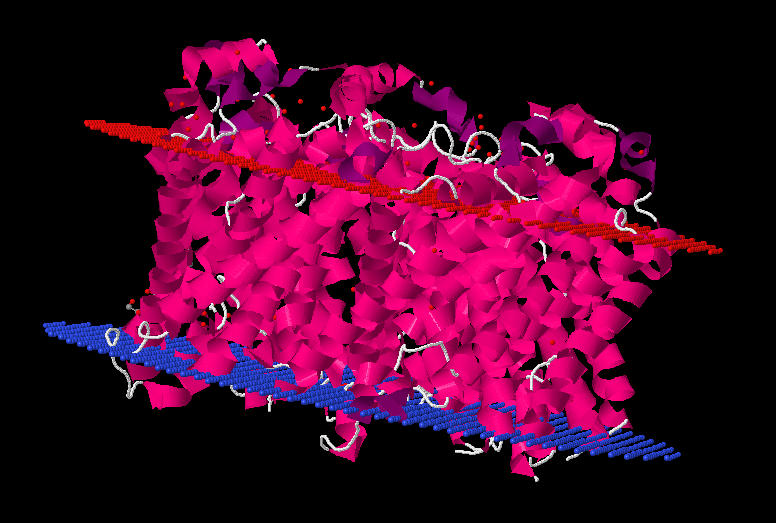
Рис2. Изображение белка 3kcu_A с указанными параметрами. 3D структура исходного белка (PDB Id - 3kcu). Ориентация P-стороной вниз (inside вверху, outside внизу). Раскраска - Hydrophobicity (гидрофобные а.о. - красные, гидрофильные незаряженные - фиолетовые, гидрофильные - синие). Порог консервативности 40%.
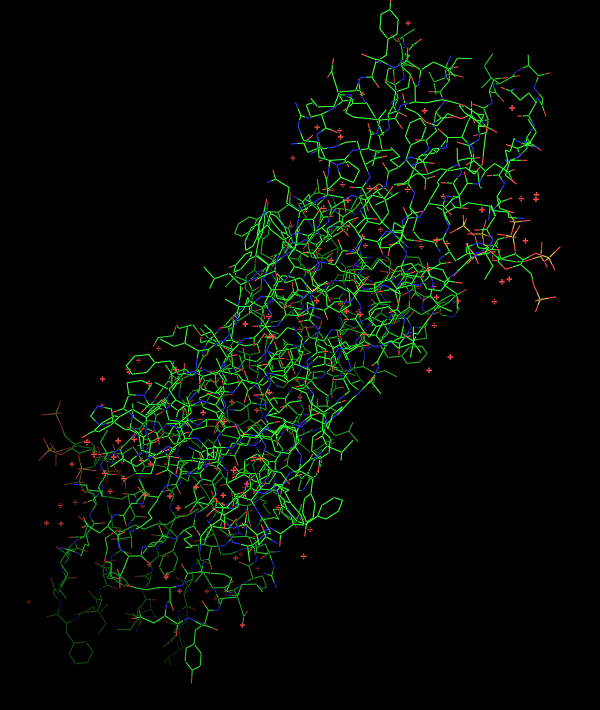
Участки, относящиеся к трансмембранным спиралям более-менее консервативны (по крайней мере по сравнению с участками между спиралями, у которых консервативность намного хуже).
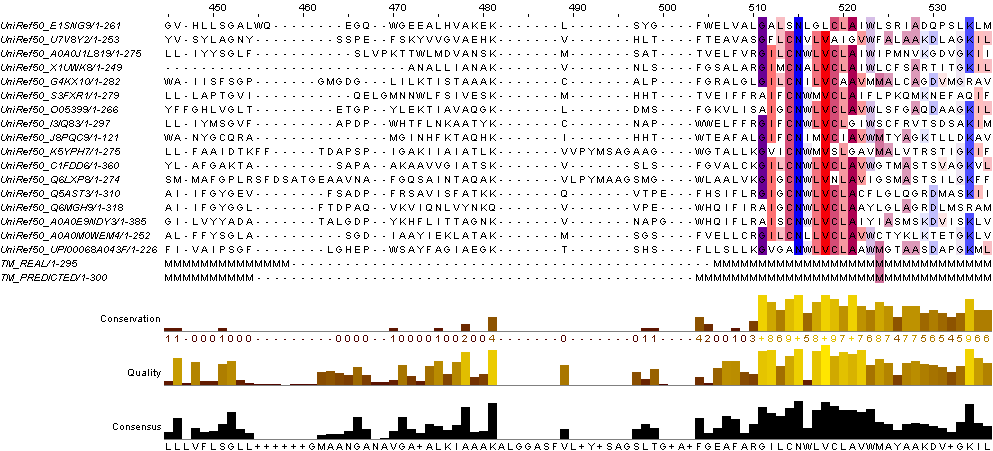
Рис3. Кусок множественного выравнивания, сравнение консервативности трансмембранных и цитоплазматических участков.
В основном трансмембранные спирали содержат гидрофобные остатки (чаще всего встречаются лейцин, изолейци и, валин), но всё же в них встречается достаточное количество полярных/заряженных аминокислот (глицин, цистеин, лизин, аспарагин). Есть даже некоторые консервативные (например, аспарагин(515)). Это может быть связано с тем, что внутри трансмембранного домена белка эти остатки формируют водородные связи между собой, а, т. к. их плотно окружает гидрофобная часть белка, вариантов для размещения полярных остатков немного.
Программа TMHMM довольно достоверно предсказала все шесть трансмембранных спиралей белка. Различия в границах спиралей не такие значительные и, вероятно, в наибольшей степени связаны с тем, что для предсказания использовался не сам белок, а его гомолог.