Вторичная структура
1. Общее описание вторичной структуры SPSE (PDB ID 1VLI)
1. Общее описание вторичной структуры SPSE (PDB ID 1VLI)
В белке:
18 альфа-спиралей
21 бета-складок
38 бета-поворотов
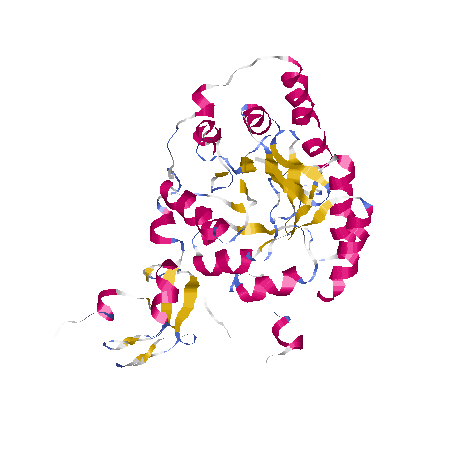
Я считаю, что белок относится к α+β белкам, так как в его структуре нерегулярно черезуются α-спирали и β-листы
2. α-спираль
pdb-описание самой длинной спирали
HELIX 15 15 ASN A 253 GLY A 274 1 22
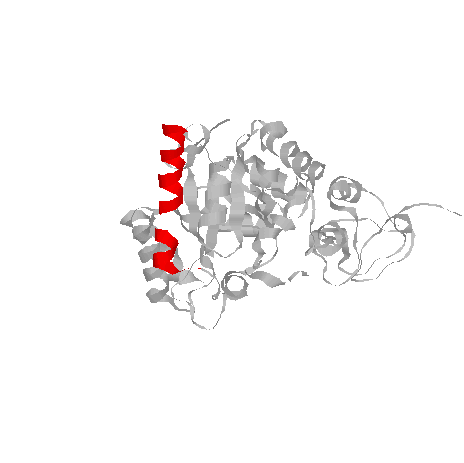
в этой спирали образовался устранимый разрыв из одного аминокислотного остатка, который, видимо, был недоступен для рентгенструктурного анализа белка. Однако на структуре спирали это не отразилось, и исследовать все равно буду ее, так как она самая длинная
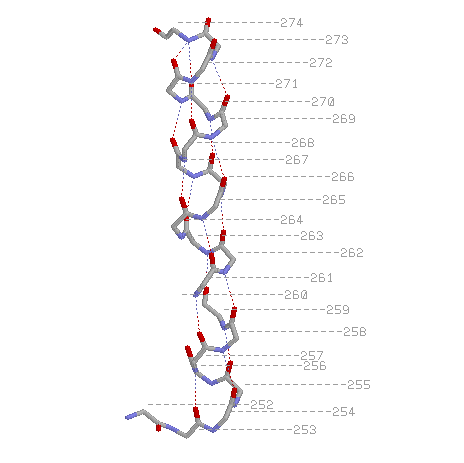
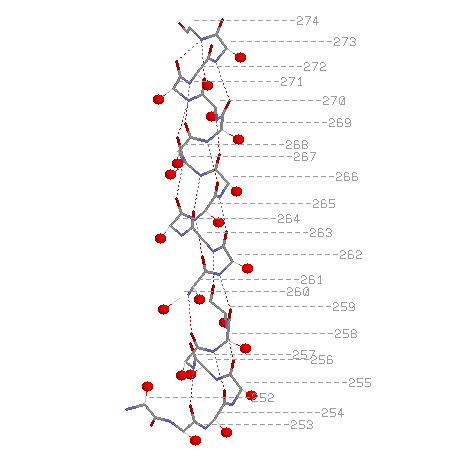
Эти изображения можно получить с помощью скрипта
Водородная связь между кислородом карбоксигруппы i-ого и азотом аминогруппы i+4-ого остатков(считая от N-конца).
Радикалы торчат из спирали наружу
3. β-листы
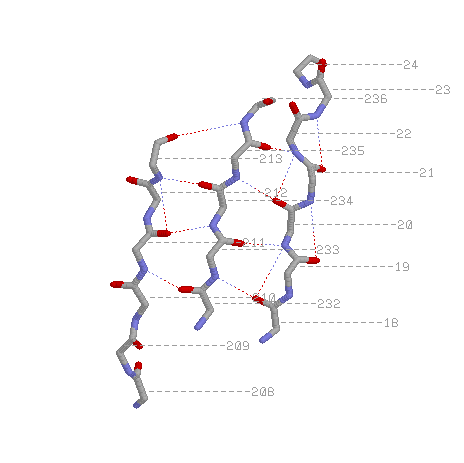
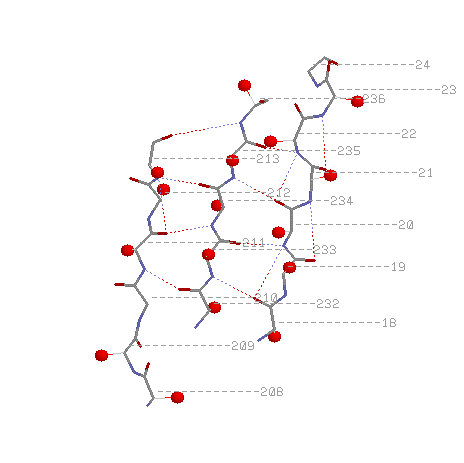
pdb-описание параллельных тяжей:
SHEET 3 B 8 PHE A 18 GLY A 24 1 N ALA A 21 O LYS A 50
SHEET 4 B 8 LEU A 232 HIS A 236 1 O LYS A 235 N GLU A 22
SHEET 5 B 8 VAL A 208 ASP A 213 1 N ASP A 213 O GLU A 234
*левые колонки - координаты тяжа, цифра после них показывает, параллелен(1) или антипараллелен(-1) данный тяж с предыдущим, правые колонки - по какой водородной связи этого тяжа с предыдущим можно определить их относительное положение.
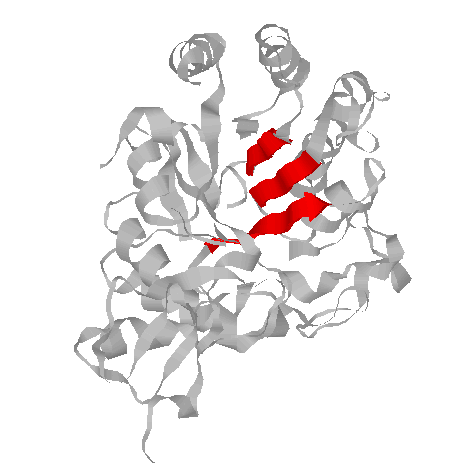
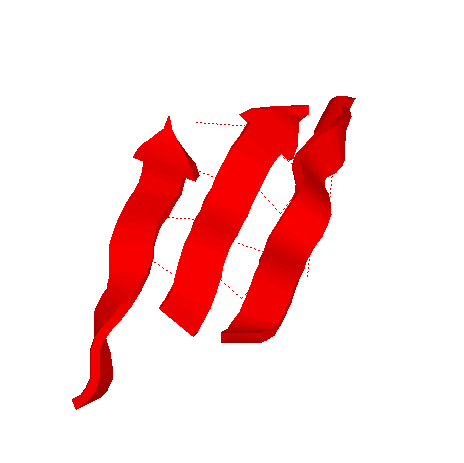
pdb-описание антипараллельных тяжей:
SHEET 1 A 2 ALA A 3 ILE A 6 0
SHEET 2 A 2 LYS A 9 GLY A 12 -1 O LYS A 9 N ILE A 6
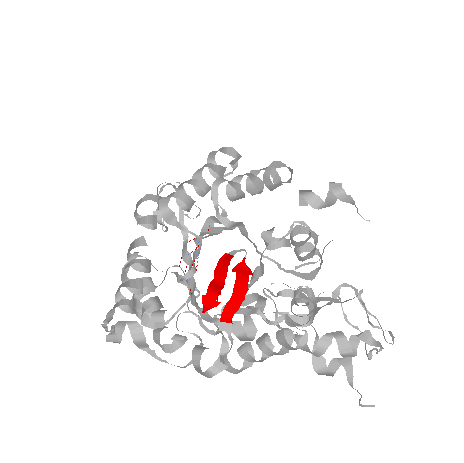
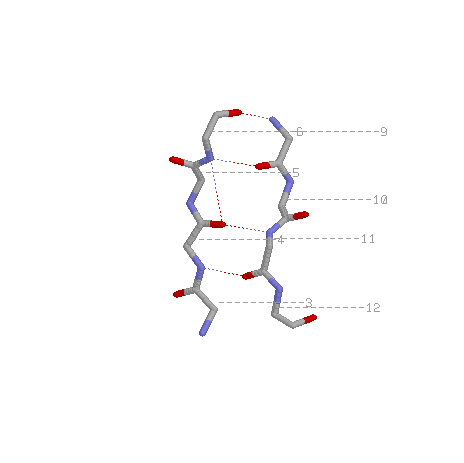
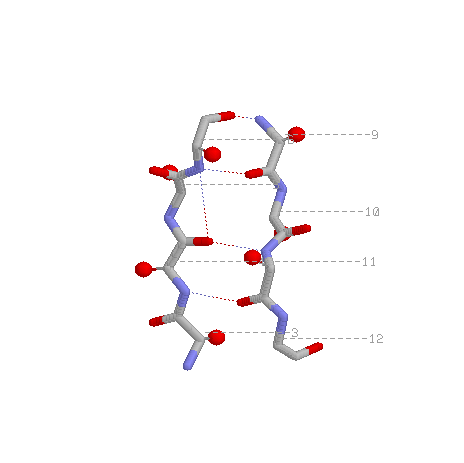
Радикалы вдоль тяжа распологаются поочередно над и под плоскостью листа
4. β-повороты
Выбранный поворот:
ILE 6, ALA 7, PHE 467, ASN 8, LYS 9
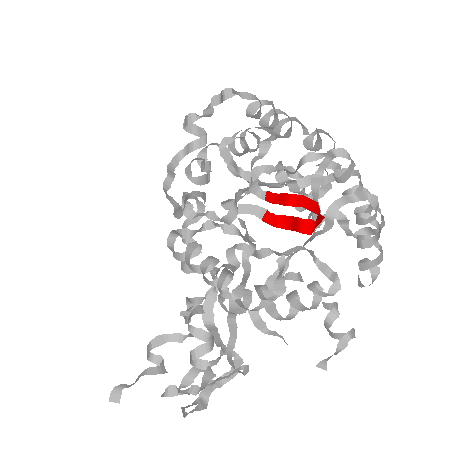
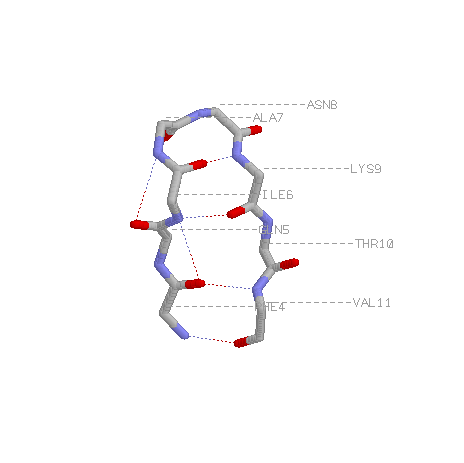
Скрепляющая водородная связь меджду кислородом карбоксильной группы ILE 6 и азотом аминогруппы LYS 9