Поиск несоответствий в PDB файлах
Модель 7GPB
Структура 7GPB - модель гомотетрамера гликогенфосфорилазы.
Разрешение данной модели - 2.90 А. Статью по структуре авторы написали в 1991 году.
Странными в этой модели являются триптофаны, например, Trp67 в цепи D. На Рисунке 1 видно сильное
нарушение планарности боковой цепи триптофана.
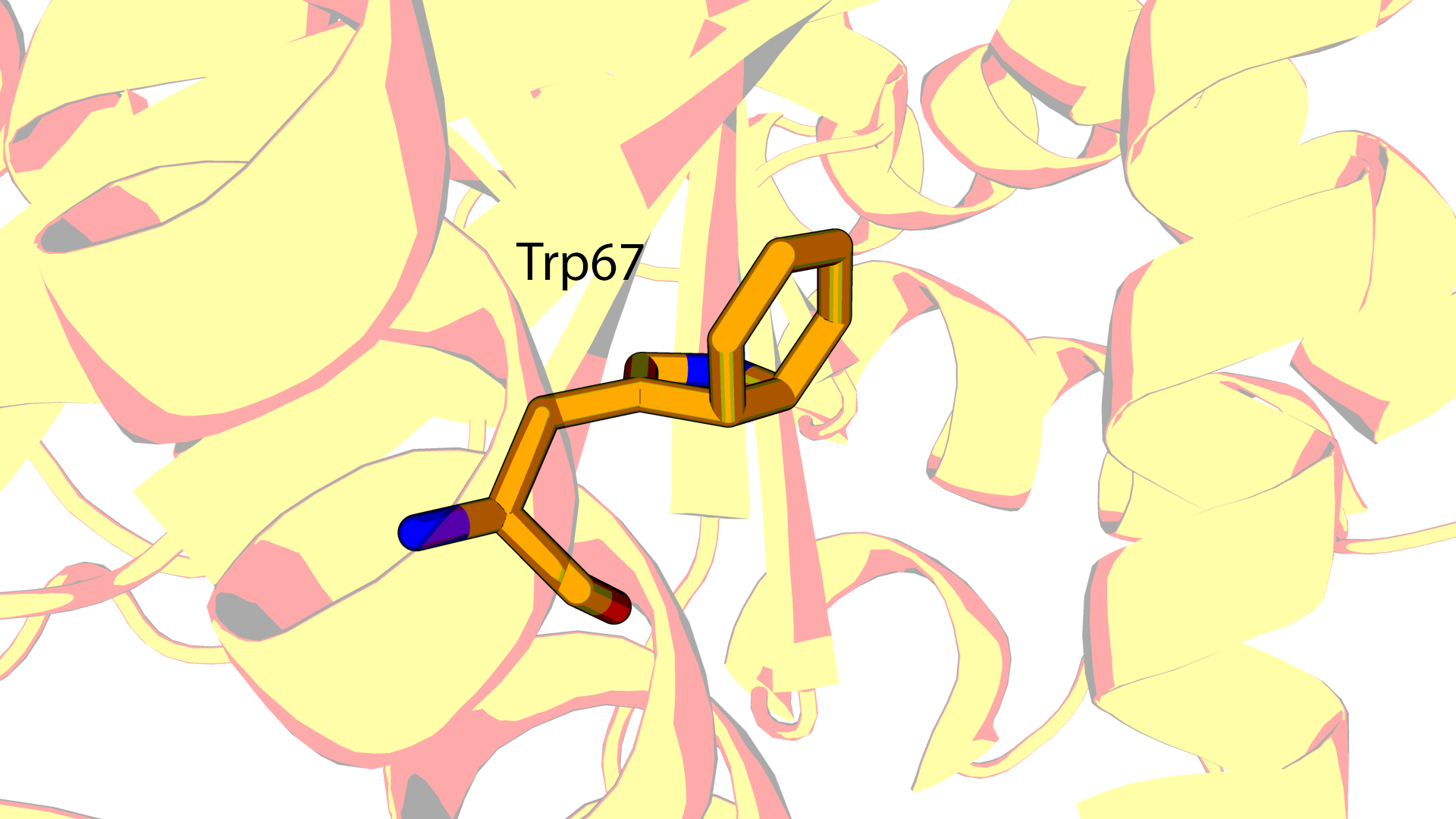
Посмотрим на температурный фактор для атомов индольного кольца у Trp67 цепи D. Он знаительно выше (48.97 - 54.15), чем температурный фактор
Trp825 той же цепи (17.33 - 21.80). Это говорит о том, что при создании модели были допущены противоречия
с законами химии.
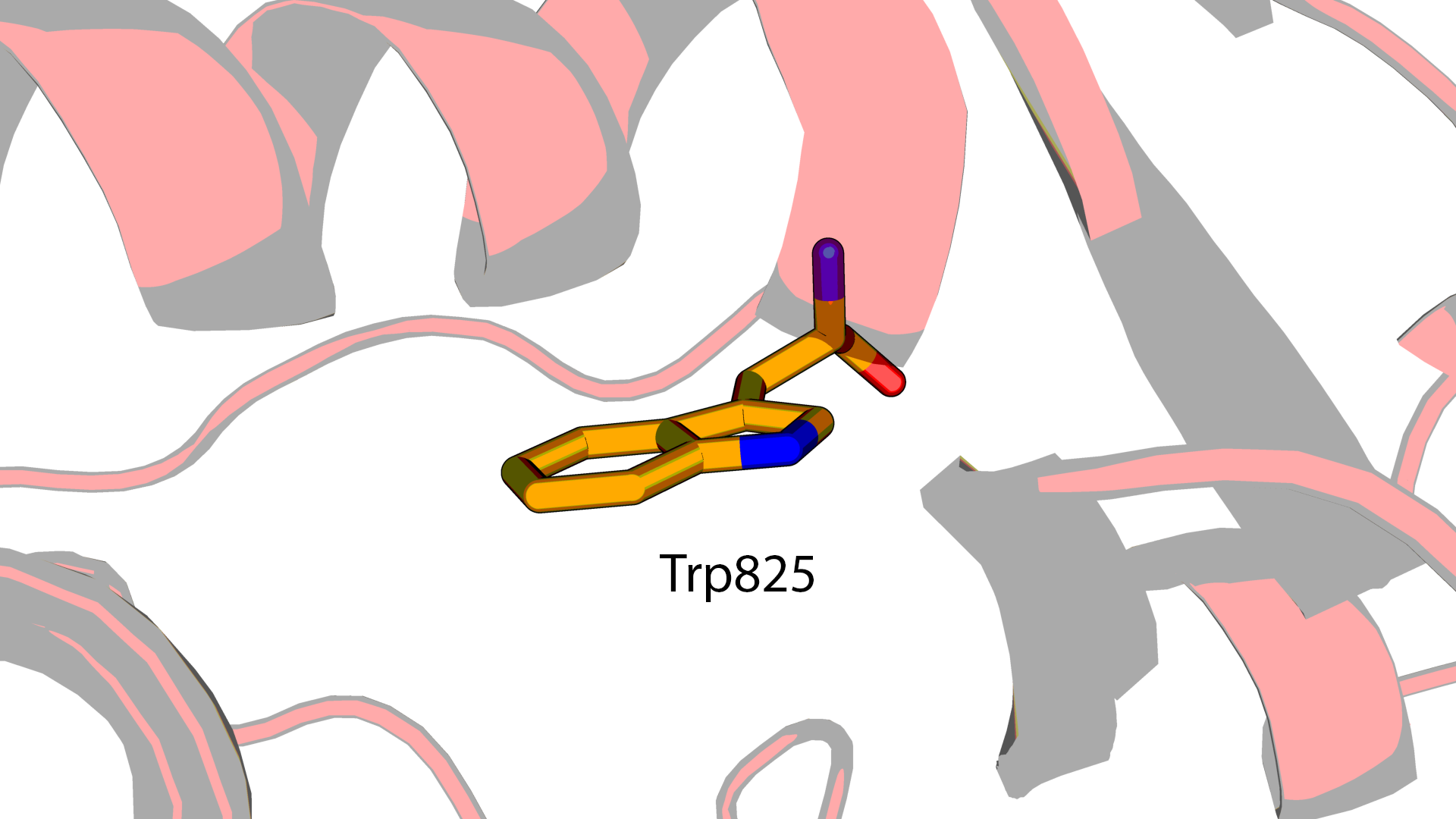
По мнению PDBREPORT остаток TRP67 цепи D - лидер по нарушению планарности
боковых цепей в этой модели.
Модель 5RXN
Модель 5RXN - модель рубредоксина с разрешением 1.2 А. Структура была расшифрована в 1984 году.
В структуре модели можно обнаружить два диастереомера треонина - (2S, 3R) и (2S, 3S), и только первый является типичным для белков.
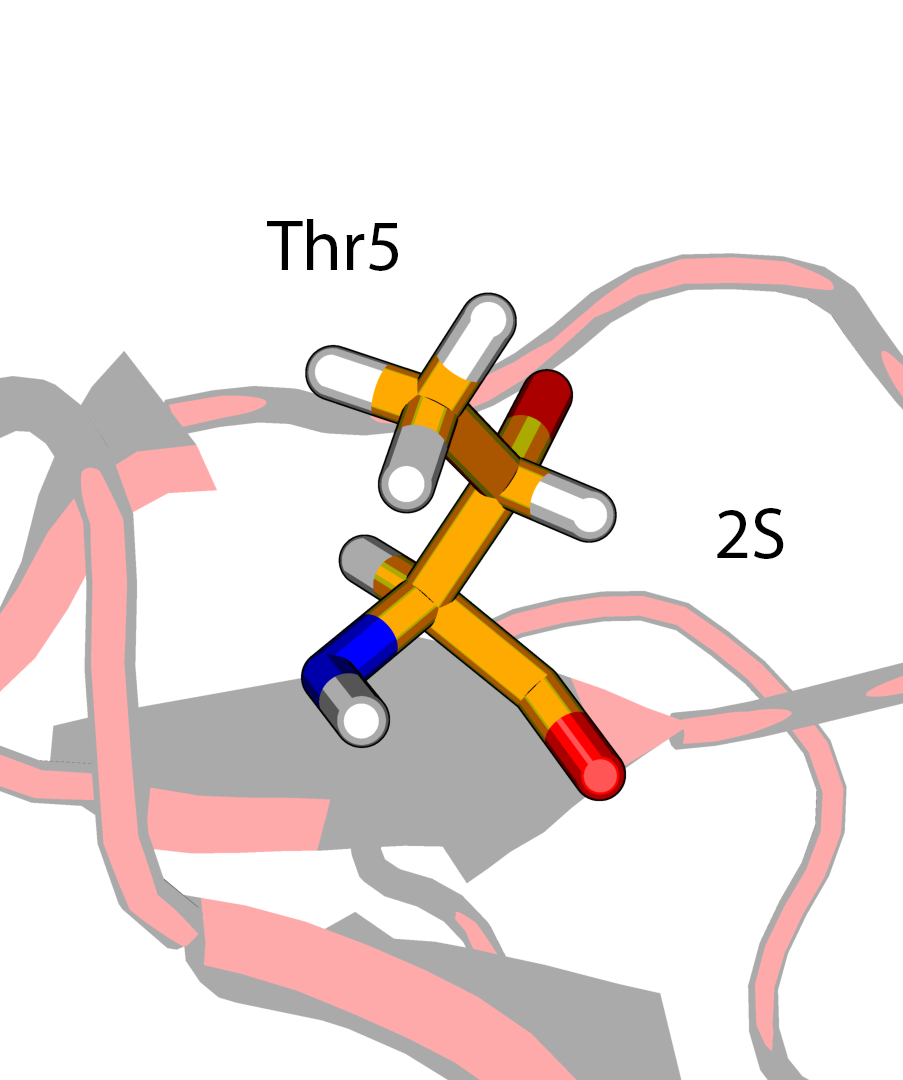
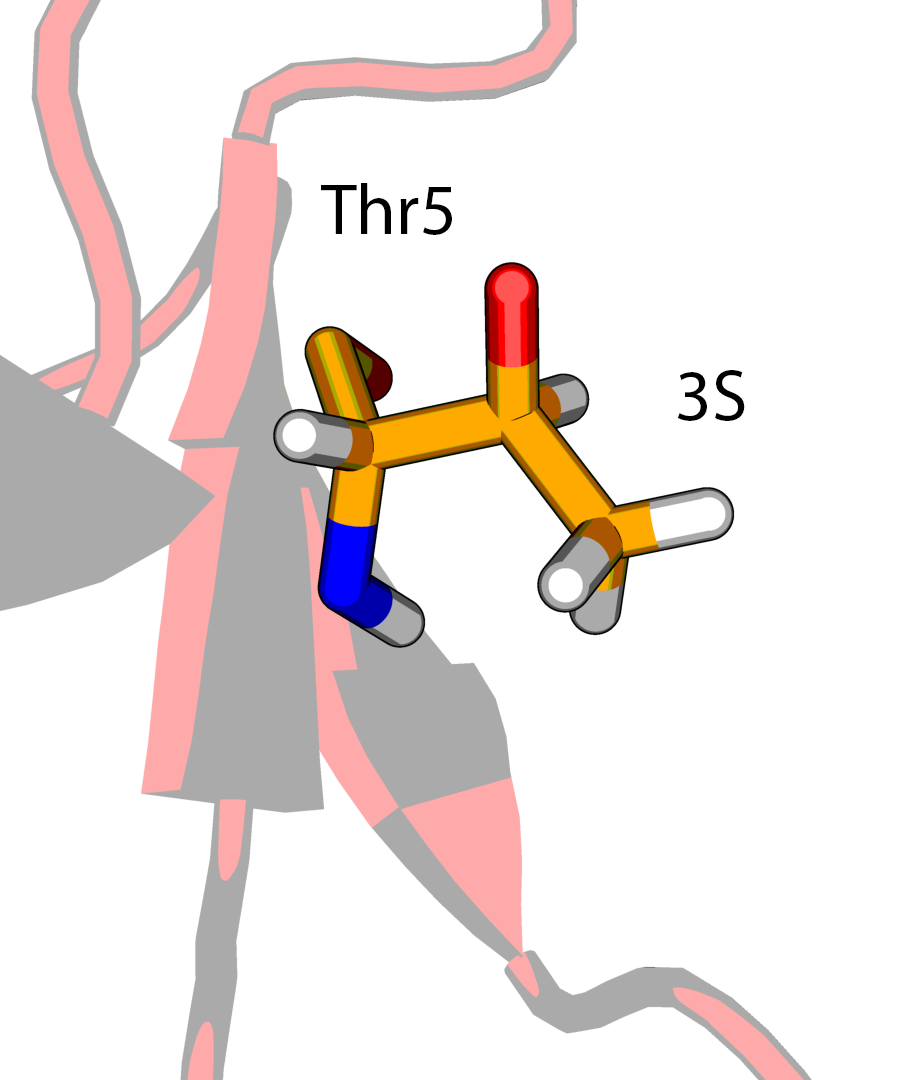
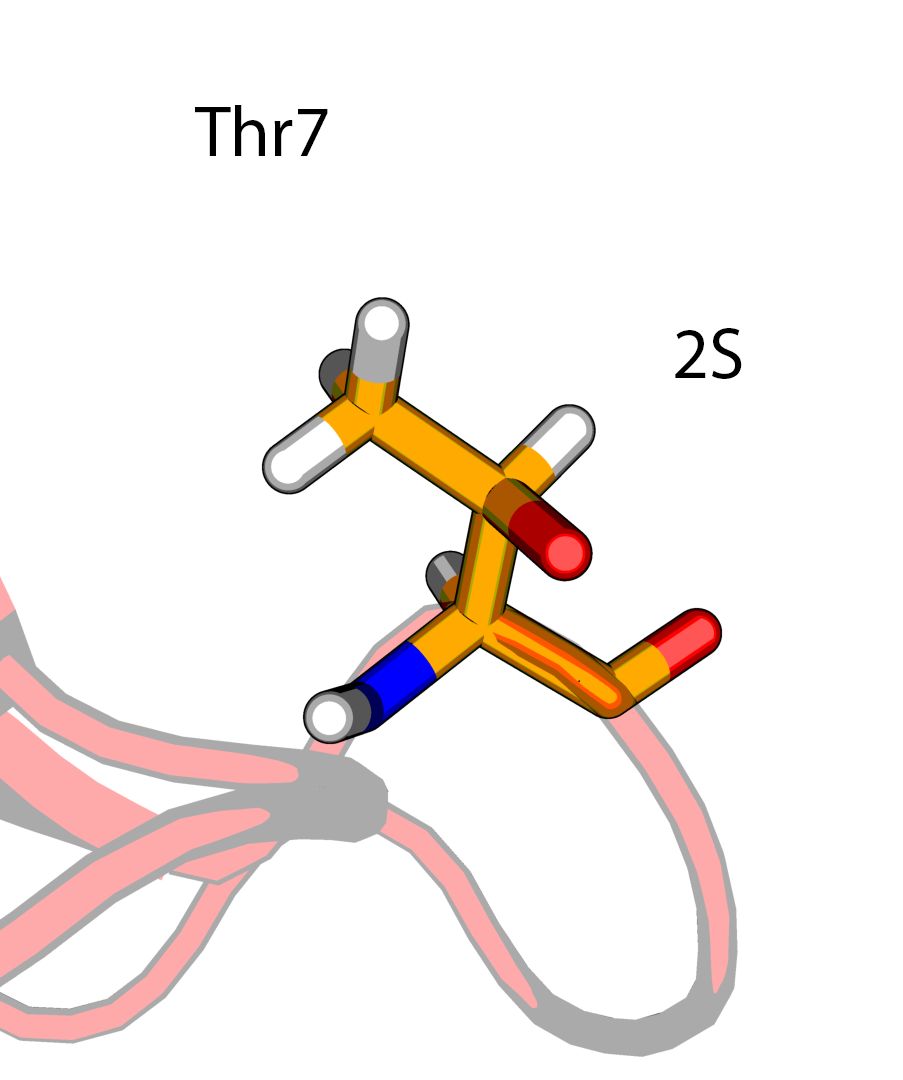
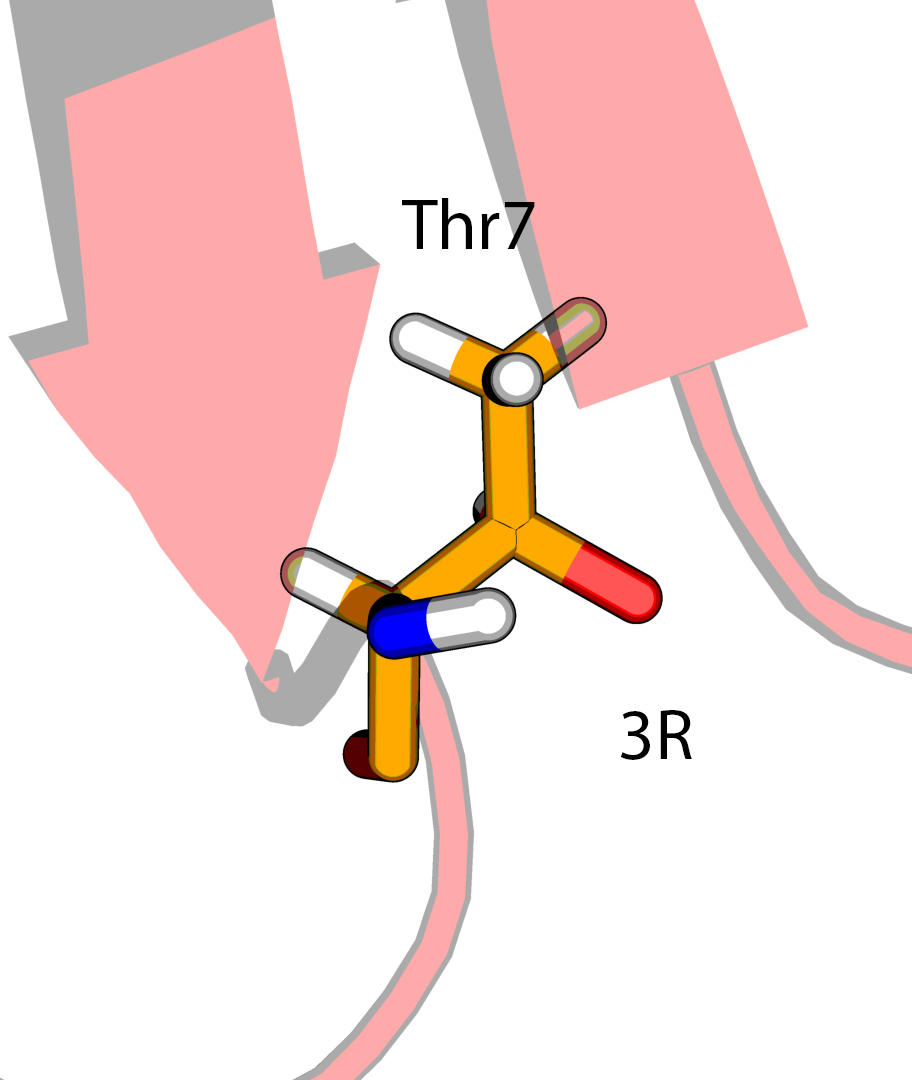
Температурные факторы для атомов боковой цепи Thr5 (2S, 3S) имеют значения выше, чем для Thr7 или Thr28 (2S, 3R). В PDBPEPORT на этот счет пишут:
Error: Threonine nomenclature problem The threonine residues listed in the table below have their O-gamma-1 and C-gamma-2 swapped. 5 THR ( 5-)
Тем самым можно заключить, что выбор стереоизомерии (2S, 3S) в Thr5 в структуре 5RXN ничем не обоснован.
Помимо треонина, хиральностью может обладать изолейцин (из протеиногенных аминокислот).
Модель 1GTO
Модель 1GT0 представляет собой структуру
комплекса ДНК с доменами POU и HMG. Разрешение структуры составляет 2.60 А, а статья, посвященная структуре, вышла в 2003 году.
В цепи C (домен POU) отсутствую аминокислоты с 78 по 96.
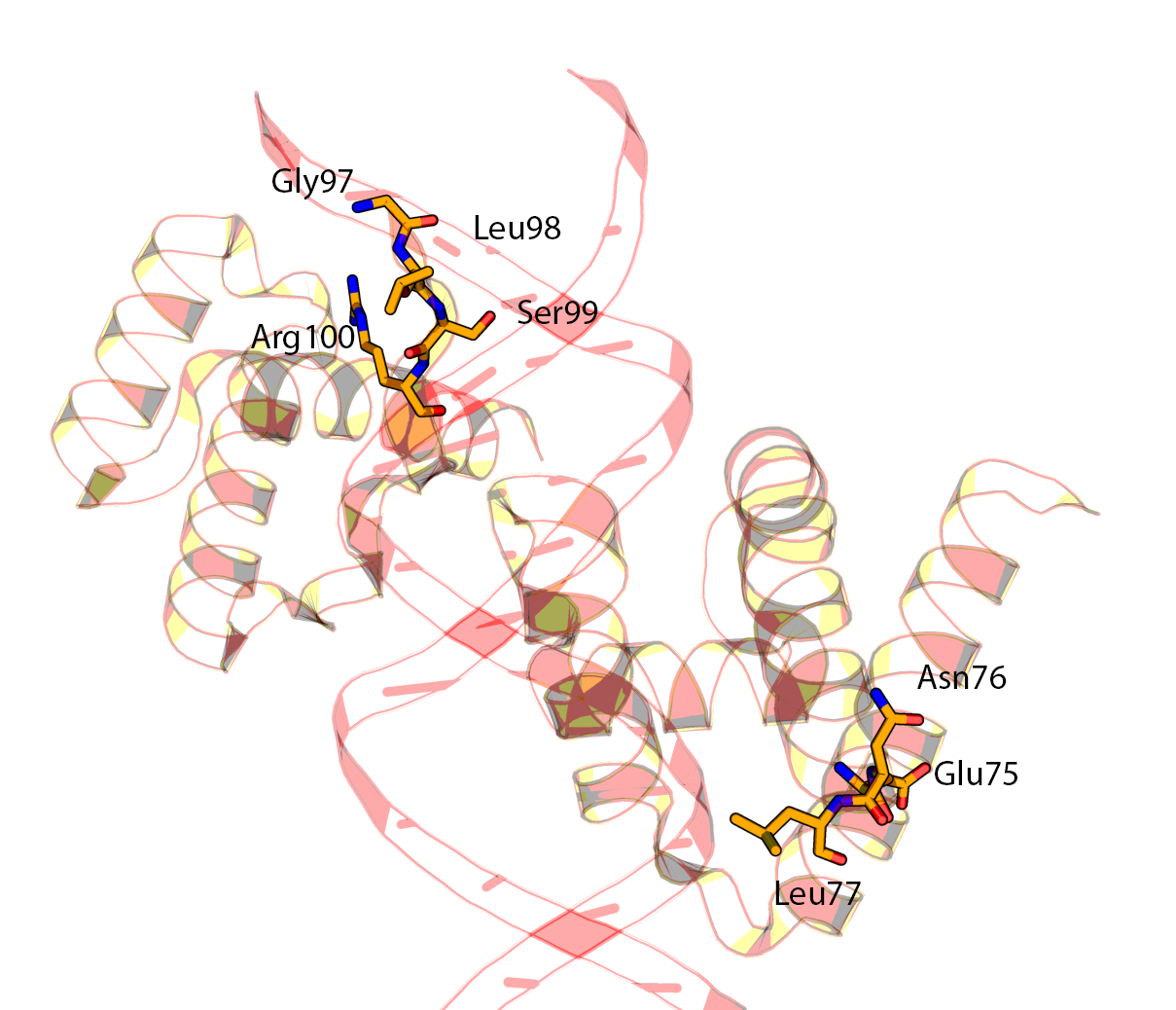
Температурные факторы для остатков "по краям" этого разрыва (75-77 и 97-100) имеют высокие значения (от 80.17 до 97.70).
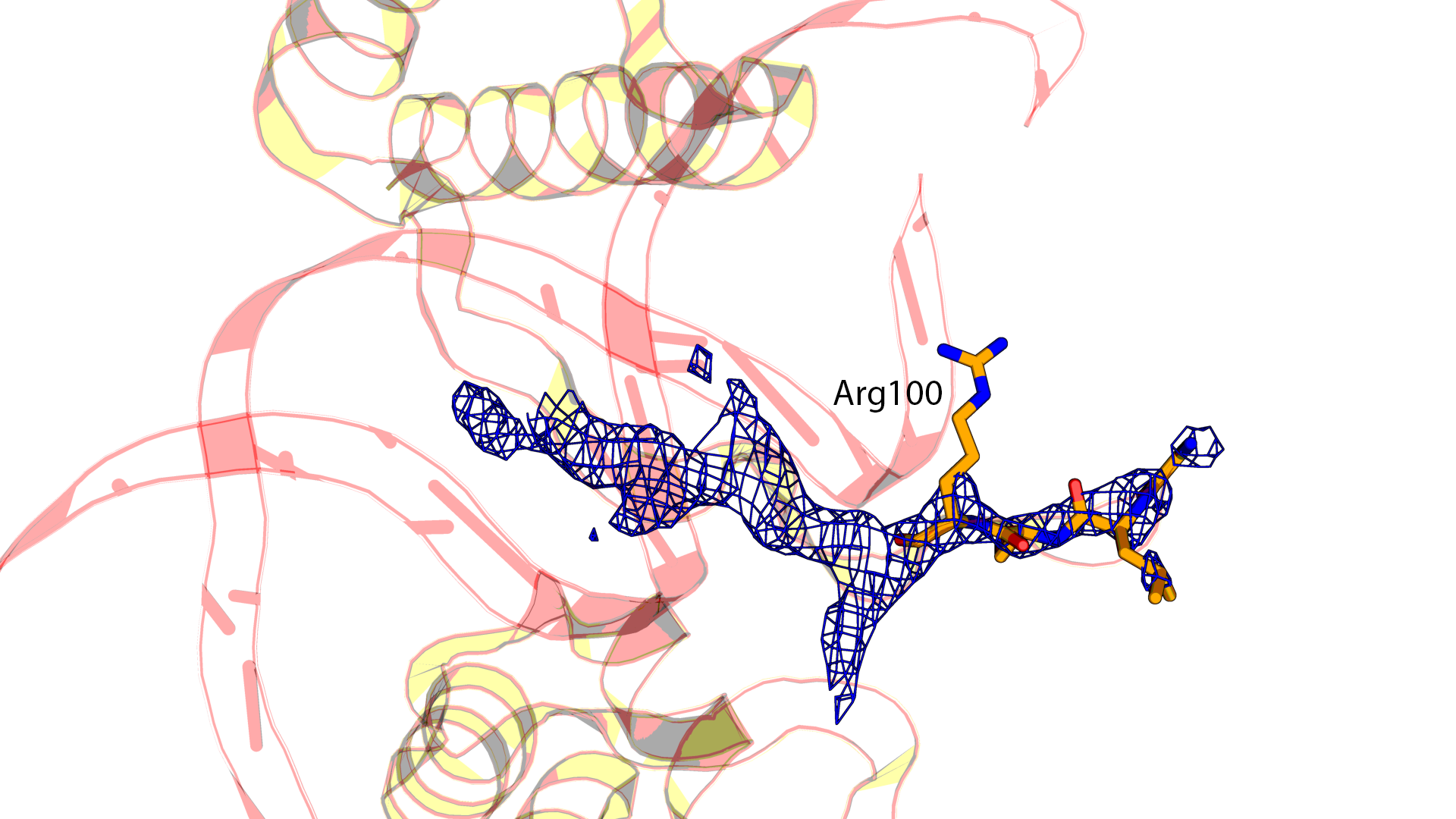
Если визуализировать электронную плотность вокруг остатков 97-100, положение боковой группы Arg100 совсем в нее не вписывается.
Видимо, его положение было выбрано случайно.
B-фактор и заполненность (occupancy) при разных разрешениях
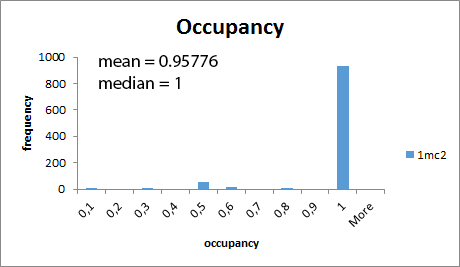
На сайте PDB был произведен поиск структур с разрешением до 1 А и от 2.0 А до 2.5 А (метод получения - X-Ray).
Были выбраны структуры 1MC2 с разрешением 0.85 А
и 4QHF с разрешением 2.1 А. Оба белка состоят из одной
полипептидной цепи с длиной 122 и 110, соответственно.
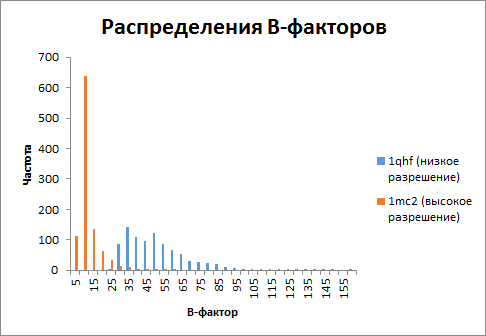
Из гистограммы видим, что температурные факторы выше у структуры с меньшим разрешением.
Также, в менее точной модели структуры (1qfh) коэффициенты заполнения всех атомов равны единицу.
С увеличением точности появляется неоднозначность в положении некоторых атомов структуры, и их коэффициент заполнения уже меньше единицы).