Мостиковые взаимодействия в структуре белка Inorganic Pyrophosphatase (идентификатор PDB 1YGZ) из генома бактерии Helicobacter Pylori штамм J99 в программе Jmol
- Зарядовые
- Цистеиновые
- Водородные
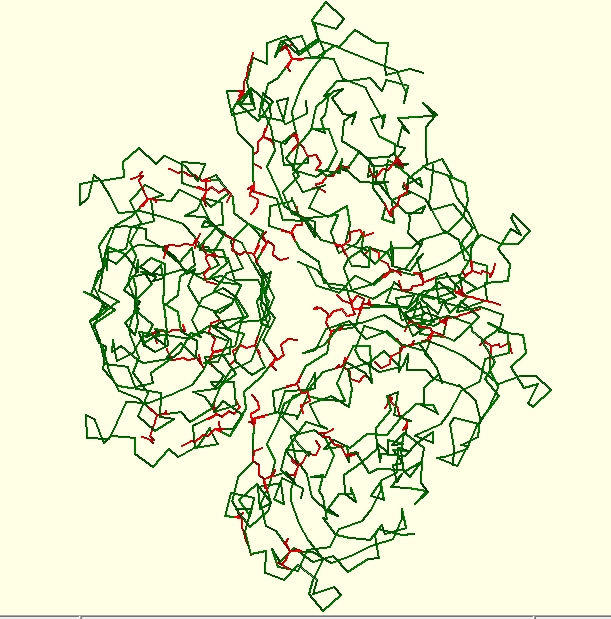
Рисунок 1.Карта расоположения зарядовых мостиков. Красным цветом выделены зарядовые мостики, зеленым - остальная часть белка.
Такую карты несложно сделать для любого белка. Для этого я исполнил следующие команды в Jmol:- Открыл файл, restrict protein || Убираем воду и работаем чисто с белком.
- cartoons off || Отключаем "мультяшное отображение"
- backbone 100 || Оставляем остов без радикалов
- select Glu, Asp || Выделяем отрицательно заряженные аминокислоты - глумативновую и аспарагиновую кислоты.
- Далее я просто разлглядывал структуру на предмет наличия положительно заряженных аминокислот.
- Это можно исполнить 1 командой : select within(GROUP,within(3.5, asp*.od?) and arg*.nh?)
- Эта команда просматривает наличие остатков аспарагиновой кислоты рядом с каким-нибудь из азотов аргинина.
- Далее : select within(GROUP,within(3.5, glu*.od?) and lys*.nz?)
- Эта команда просматривает наличие остатков глутаминовой кислоты рядом с азотом лизина.
- Далее : select within(GROUP,within(3.5, glu*.od?) and arg*.nh?)
- Эта команда просматривает наличие остатков глутаминовой кислоты рядом с азотом аргинина.
- Далее : select within(GROUP,within(3.5, asp*.od?) and lys*.nz?)
- Эта команда просматривает наличие остатков аспарагиновой кислоты рядом с азотом лизина.
- Дальше нахожу номера аминокислот, выделяю и соединяю "якобы водородной связью"
- connect hbond
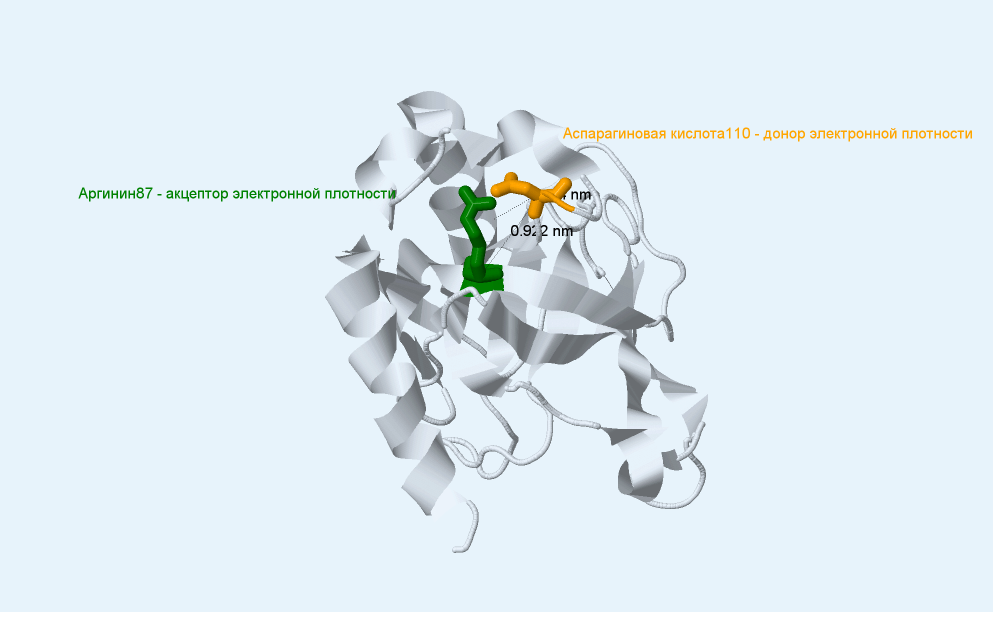
Рисунок 2. Детально естроение зарядового мостика в пространстве между аргинином - 87 и аспарагиновой кислоты - 110 кластера E.
Следующим видом мостиков являются так называемые цистеиновые мостики. Это ковалентные связи, образованные атомами серы двух остатков цистеина. В моем белке цистен полностью отсутствует (select Cys выдает, что выделено 0 атомов). Поэтому в качестве примера я взал инсулин с идентификатором PDB - 4IYD. На рисунке 3 отчетливо видно, что структура белка практически держится за счет этих цистеиновых связей.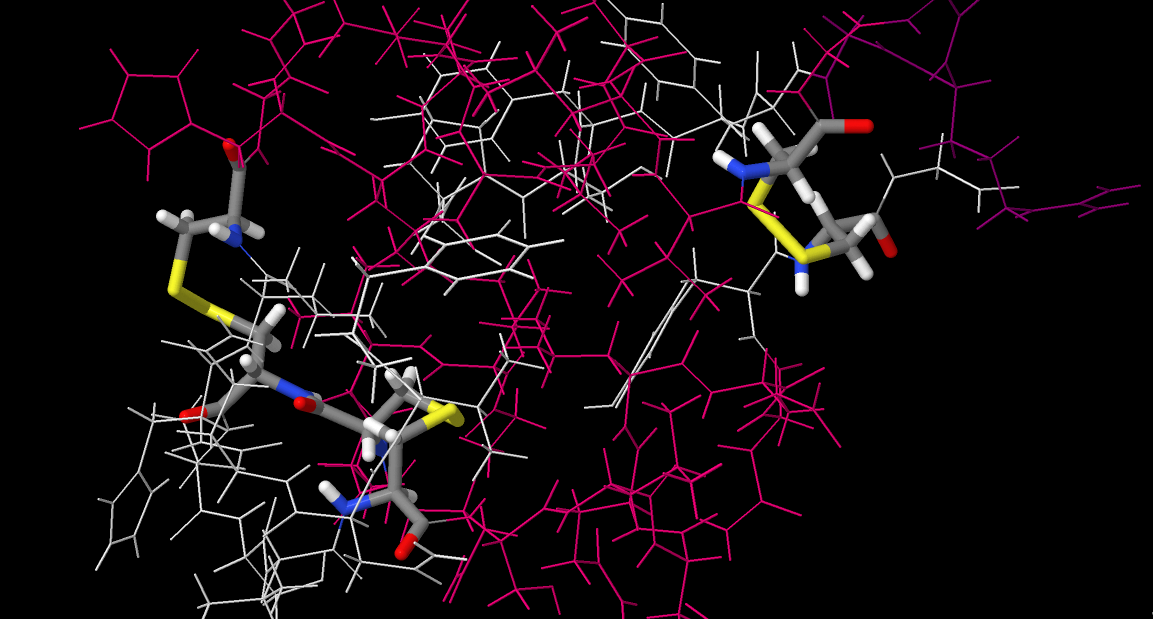
Рисунок 3. Пространственное строение цистеинового мостиа. Жетлым цветом выделены атомы серы, все остальные по стандарту cpk. Длина такой связи 1.95 А. Двугранные угол связи близок к 90 градусам.
Следующий тип взаимодействие водородные мостики - это водородные связи, не являющиеся солевыми мостиками. Они могут возникать между незаряженными остатками аминокислот, остатков и остовом. Пример такого взаимодействия между радикалов аспарагина 159 и остовов показан на рисунке 4.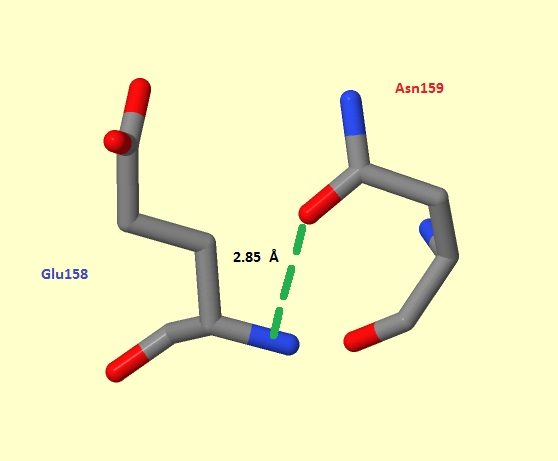
Рисунок 4. Водородная связья, не являющаяся солевым мостиком. Донор плотности - кислород из радикала аспарагина 159, акцептор азот - из главной цепи глутаминовой кислоты 158.