Личный сайт
Трансмембранные белки
База данных OPM
Был выдан белок с PDB ID - 4n4y. Это белок Цитохром С оксидазы из бактерии Thermus thermophilus. Проведен поиск в базе OPM.
Рис. 1. Изображения структуры белка из базы OPM для белка 4n4y, красная линия - снаружи, синяя - внутри.
Для белка было определено следующее:- толщина гидрофобной части мембраны - 31.2 ± 1.1 Å
- 3 трансмембранные субъединицы - это аминокислоты с 21- 47, 67- 89, 104- 129, 143- 162, 185- 210, 223- 245, 267- 285, 292- 314, 347- 372, 379-402, 420-444, 465- 490, 527- 550; 15- 37; 7- 29
- белок расположено во внутренней мембране грамм-отрицательных бактерий
С помощью поиска по уровням классификации был найден белок, в трансмембранной части которого β-листы. Его PDB ID - 3b07 . Это гамма-хемолизин, пороформирующий токсин.

Рис. 2. Изображение структуры белка 3b07 из базы OPM, легенда аналогичная таковой на рисунке 1.
Для него были определены следующие параметры:
- толщина гидрофобной части мембраны - 21.4 ± 1.0 Å
- 8 трансмембранные субъединицы - это аминокислоты с 119- 126, 129- 135; 113-118, 122- 127; 119- 126, 129- 135; 113-118, 122- 127; 119- 126, 129- 135; 113-118, 122- 127; 119- 126, 129- 135; 113-118, 122- 127
- белок секретируется Staphylococcus aureus и находится в мембране
База данных TCBD
К сожалению, к KEGG был представлен лишь один из моих белков - цитохром С оксидаза. Его ЕС - 1.9.3.1. Входит в семейство оксидоредуктаз. Он участвует в окислительном фосфорилировании. Путь представлен на рисунке 3. Его субстратами являются - ферроцитохром С, кислород и протоны. Продукты - феррицитохром С и вода.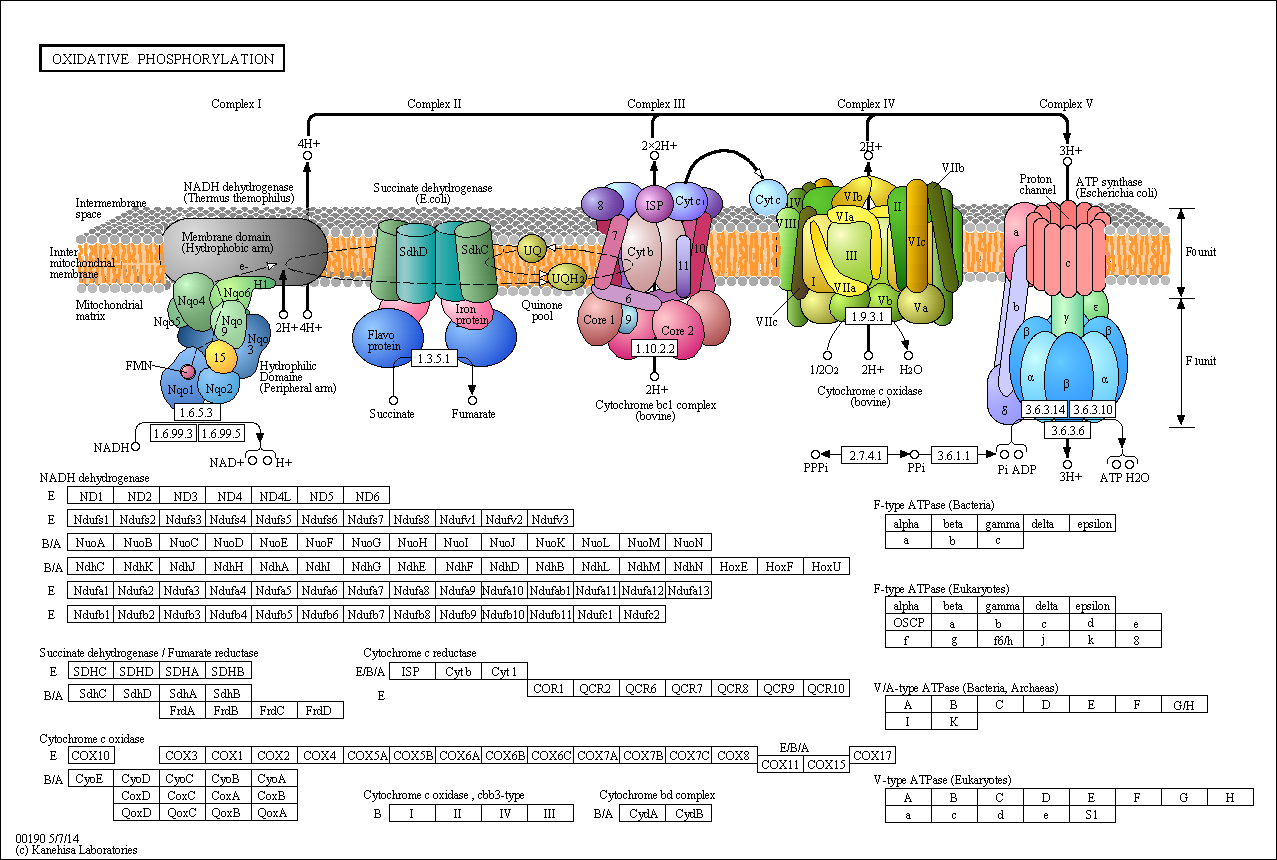
Рис. 3. Карта оксилительного фосфорилирования.
Анализ множественного выравнивания
Для исследования была выбрана 1 субъединица (protein 1). Было выбрано 5 архей, 8 эукариот и 13 бактерий. Файл с последовательностями можно получить по ссылке . Результаты работы TMHMM:
# WEBSEQUENCE Length: 622 # WEBSEQUENCE Number of predicted TMHs: 14 # WEBSEQUENCE Exp number of AAs in TMHs: 314.02911 # WEBSEQUENCE Exp number, first 60 AAs: 22.84247 # WEBSEQUENCE Total prob of N-in: 0.99993 # WEBSEQUENCE POSSIBLE N-term signal sequence WEBSEQUENCE TMHMM2.0 inside 1 26 WEBSEQUENCE TMHMM2.0 TMhelix 27 49 WEBSEQUENCE TMHMM2.0 outside 50 71 WEBSEQUENCE TMHMM2.0 TMhelix 72 94 WEBSEQUENCE TMHMM2.0 inside 95 106 WEBSEQUENCE TMHMM2.0 TMhelix 107 129 WEBSEQUENCE TMHMM2.0 outside 130 155 WEBSEQUENCE TMHMM2.0 TMhelix 156 178 WEBSEQUENCE TMHMM2.0 inside 179 197 WEBSEQUENCE TMHMM2.0 TMhelix 198 220 WEBSEQUENCE TMHMM2.0 outside 221 244 WEBSEQUENCE TMHMM2.0 TMhelix 245 267 WEBSEQUENCE TMHMM2.0 inside 268 273 WEBSEQUENCE TMHMM2.0 TMhelix 274 296 WEBSEQUENCE TMHMM2.0 outside 297 310 WEBSEQUENCE TMHMM2.0 TMhelix 311 333 WEBSEQUENCE TMHMM2.0 inside 334 345 WEBSEQUENCE TMHMM2.0 TMhelix 346 368 WEBSEQUENCE TMHMM2.0 outside 369 382 WEBSEQUENCE TMHMM2.0 TMhelix 383 405 WEBSEQUENCE TMHMM2.0 inside 406 417 WEBSEQUENCE TMHMM2.0 TMhelix 418 440 WEBSEQUENCE TMHMM2.0 outside 441 461 WEBSEQUENCE TMHMM2.0 TMhelix 462 484 WEBSEQUENCE TMHMM2.0 inside 485 553 WEBSEQUENCE TMHMM2.0 TMhelix 554 573 WEBSEQUENCE TMHMM2.0 outside 574 577 WEBSEQUENCE TMHMM2.0 TMhelix 578 600 WEBSEQUENCE TMHMM2.0 inside 601 622

Рис. 4. Графки выдачи TMHMM
Была использова собственная сехма раскраски - красные - синие, гидрофильные - синие. Выравнивание можно посмотреть по ссылке Выравнивание, в котором присутствует реальная структура (TM_REAL) и предсказанная (TM_PREDICTED) доступно по ссылке.

Рис. 5. Белок с окраской по гидрофобности остатков, above identity threshold 70%. Нижняя сторона - p; верхняя - n. Схема доступна по ссылке

Рис. 6. Белок с окраской по гидрофобности остатков, above identity threshold 0%. Нижняя сторона - p; верхняя - n. Схема доступна по ссылке
Участки трансмембранных доменов достаточно консервативны среди белков из выборки. В основном там встречаются гидрофобные аминокислоты, много триптофана, лейцина, пролина. Участки между спиралями тоже имеют консервативность, хоть он и не отображается при identity treshold 60%. Там много аргинина,лизина и гистидина - положительно заряженных аминокислот. В трансмембранных участках отсутствуют положительно заряженные аминокислоты.
При анализе результатов программы TMHMM и базы данных OPM обнаружило удивительное сходство результатов. У TMHMM лишь немного съезжают позиции, на 2-3 а.о, и он нашёл трансмембранный участок, не указанный в аннотации белка в базе данных OPM. А все остальные спирали замечены TMHMM.
Просвиров Кирилл. Дата последнего изменения: 4 октября 2014.