Внутримолекулярные взаимодействия в структуре 2V09
Общая характеристика структуры 2V09
- Идентификатор PDB: 2V09
- Название: оксалат-декарбоксилаза (oxalate decarboxylase)
Оксалат-декарбоксилаза представляет собой гомогексамер, каждая субъединица содержит только одну полипептидную цепь. На рисунке 1 изображена структура одной из субъединиц
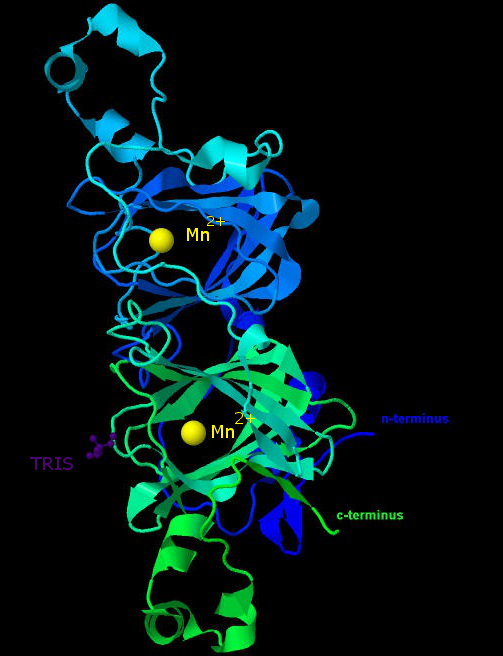 Рис.1 Структура субъединицы оксалат-декарбоксилазы. Цепь белка покрашена градиентом от синего (N-конец, N-terminus) к зелёному (C-конец, C-terminus). Жёлтыми сферами обозначены
ионы марганца, фиолетовым - молекула ТРИС.
Рис.1 Структура субъединицы оксалат-декарбоксилазы. Цепь белка покрашена градиентом от синего (N-конец, N-terminus) к зелёному (C-конец, C-terminus). Жёлтыми сферами обозначены
ионы марганца, фиолетовым - молекула ТРИС.Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом PDB 2V09
В белке есть как альфа-спирали, так и бета-листы. Вторые заметно преобладают. Все альфа-спирали в белке имеют максимально протяжённый участок без излома не более 2,5-3 витков (рис 2). Далее рассматривается альфа-спираль, образованная аминокислотными остатками с 176 по 185. Шаг спирали равен 5.45 ангстрем (на два витка приходится расстояние 10.9 ангстрем (рис.3): 10.9 ангстрем/2 = 5.45). На один виток спирали приходится 3.6 аминокислотных остатка (на 2.5 витка приходится 9 остатков, десятый остаток уже выходит из каркаса спирали, образуя изгиб (рис.5)) Имеющий номер n аминокислотный остаток образует водородные связи с остатками с номерами n + 4 и n - 4 (рис.6).
В бета-листе, образованном остатками 58-155 все бета-тяжи антипараллельны соседним (рис.6): по мере увеличения номеров остатков в бета тяже номера остатков, с которыми они соединены водородными связями, уменьшаются. В ленточной модели представления 3D структуры белка направление от N-конца к С-концу (увеличение номеров остатков) обозначается стрелкой. Этот бета-лист образует частично замкнутую вогнутую поверхность (рис.7).
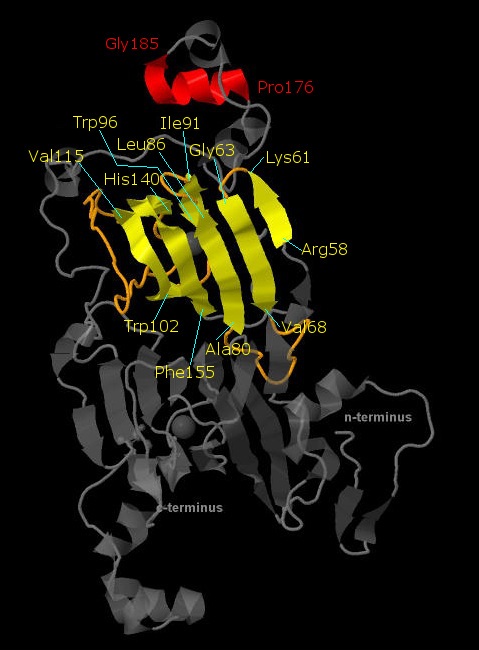 Рис. 2 Элементы вторичной структуры в цепи А оксалат-декарбоксилазы. Красным выделена одна из альфа-спиралей. Жёлтым выделен один из бета-листов (линкеры между бета-тяжами выделены оранжевым).
Подписаны начало и конец у альфа-спирали и каждого бета-тяжа.
Рис. 2 Элементы вторичной структуры в цепи А оксалат-декарбоксилазы. Красным выделена одна из альфа-спиралей. Жёлтым выделен один из бета-листов (линкеры между бета-тяжами выделены оранжевым).
Подписаны начало и конец у альфа-спирали и каждого бета-тяжа.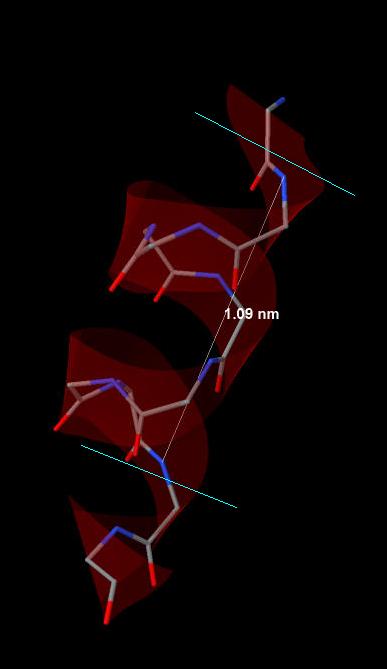 Рис.3 Длина двух витков выбранной альфа-спирали. Атомы элементов покрашены стандартно
Рис.3 Длина двух витков выбранной альфа-спирали. Атомы элементов покрашены стандартно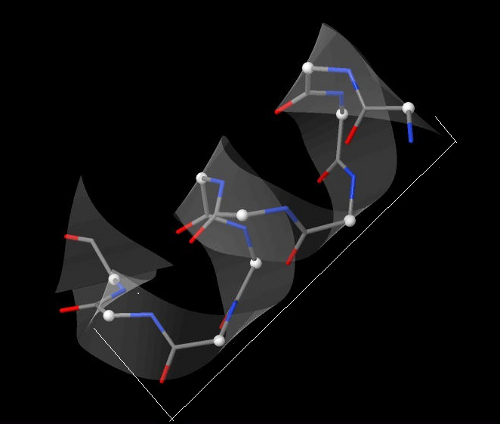 Рис. 4 Альфа-спираль. Элементы покрашены стандартно, С-alpha изображены белыми сферами. Обозначенный отрезок спирали - 2.5 витка.
Рис. 4 Альфа-спираль. Элементы покрашены стандартно, С-alpha изображены белыми сферами. Обозначенный отрезок спирали - 2.5 витка.
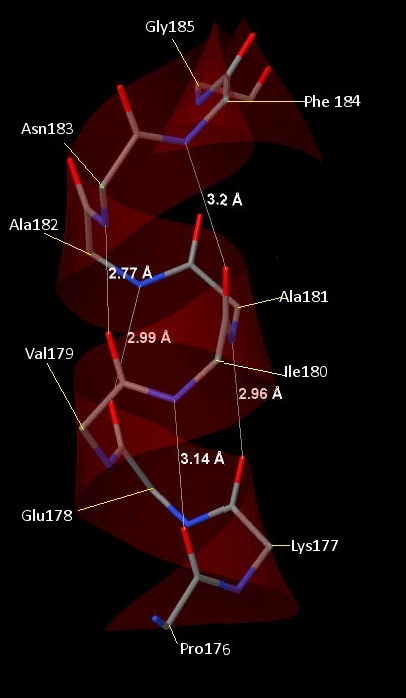 Рис. 5 Водородные связи в альфа-спирали. Элементы покрашены стандартно. Водородные связи обозначены белыми линиями, их длины указаны. Остатки подписаны по С-alpha атомам.
Рис. 5 Водородные связи в альфа-спирали. Элементы покрашены стандартно. Водородные связи обозначены белыми линиями, их длины указаны. Остатки подписаны по С-alpha атомам.
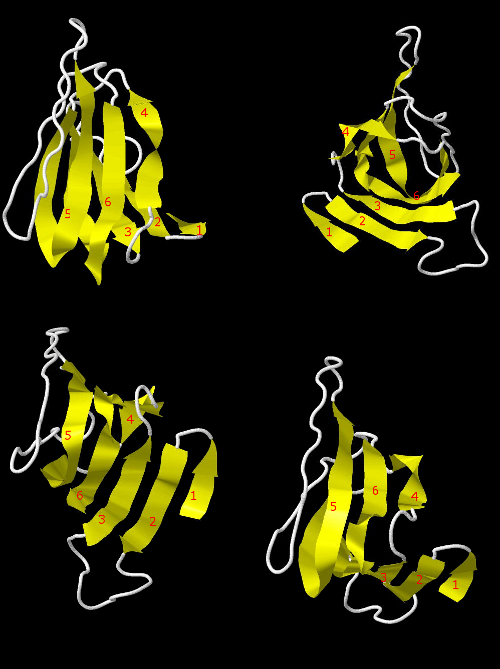 Рис. 6 Антипараллельньный бета-лист (с разных сторон). Тяжи показаны жёлтым и пронумерованы (по расположению в цепи белка от N-конца к С). Линкеры показаны белым.
Рис. 6 Антипараллельньный бета-лист (с разных сторон). Тяжи показаны жёлтым и пронумерованы (по расположению в цепи белка от N-конца к С). Линкеры показаны белым.
 Рис. 7 Бета-лист, вид сбоку. Тяжи показаны жёлтым и пронумерованы (по расположению в цепи белка от N-конца к С). Линкеры показаны белым.
Рис. 7 Бета-лист, вид сбоку. Тяжи показаны жёлтым и пронумерованы (по расположению в цепи белка от N-конца к С). Линкеры показаны белым.
Внутримолекулярные взаимодействия боковых групп белка в цепи A белка с кодом PDB 2V09
Дисульфидных мостиков в белке нет, т.к. нет остатков цистеина. Благодаря взаимодействию положительно заряженных аминокислотных остатков (лизин,аргинин,гистидин) и отрицательно заряженных (глутамат, аспартат) образуются солевые мостики. На рис. 8 показаны все солевые мостики белка (17 штук), в т.ч. двойные, на рис. 9 показано их расположение в третичной структуре белка, на рис. 10 крупно приведён соляной мостик между 23 остатком (аргинин) и 28 (аспартат)
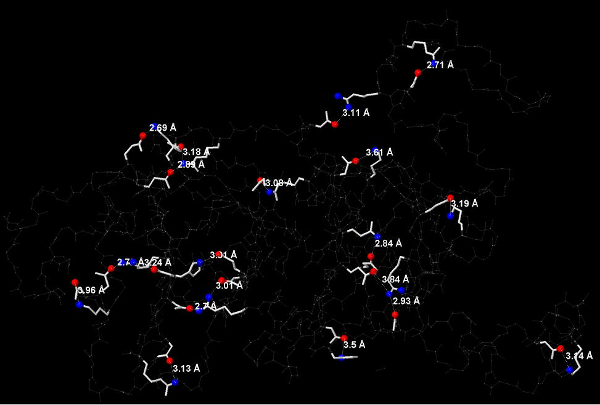 Рис. 8 Солевые мостики в цепи А. Остатки, соединённые мостиками, показаны белыми линиями, остальной белок показан тонкими белыми линиями (без радикалов) Атомы,
участвующие в образовании мостиков, показаны соответственно синими сферами(азот) и красными(кислород), водород не показан, обозначены длины солевых мостиков.
Рис. 8 Солевые мостики в цепи А. Остатки, соединённые мостиками, показаны белыми линиями, остальной белок показан тонкими белыми линиями (без радикалов) Атомы,
участвующие в образовании мостиков, показаны соответственно синими сферами(азот) и красными(кислород), водород не показан, обозначены длины солевых мостиков.
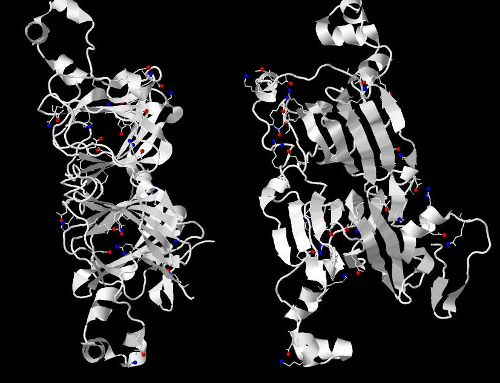
Рис. 9 Солевые мостики в третичной структуре цепи А. Атомы, участвующие в образовании мостиков, показаны соответственно синими сферами(азот) и красными(кислород), водород не показан.
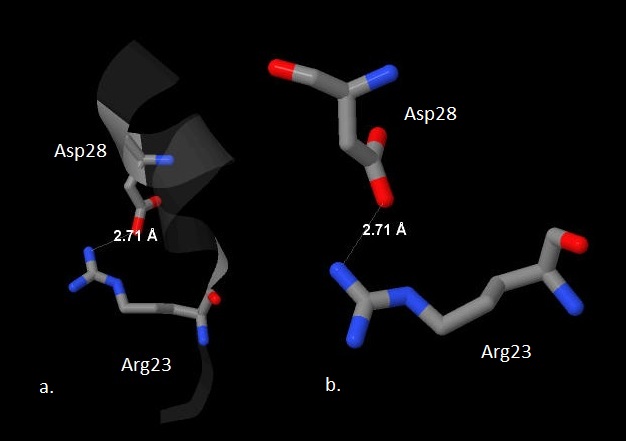 Рис. 10 Солевой мостик между Аргинином-23 и аспартатом-28.
Элементы покрашены стандартно. Солевой мостик обозначен белой линией, его длина подписана.
a. В цепи белка. b. Крупно.
Рис. 10 Солевой мостик между Аргинином-23 и аспартатом-28.
Элементы покрашены стандартно. Солевой мостик обозначен белой линией, его длина подписана.
a. В цепи белка. b. Крупно.