В этом практикуме я работала со структурой дигидрофолат редуктазы мыши с её ингибитором и NADPH (3D80)
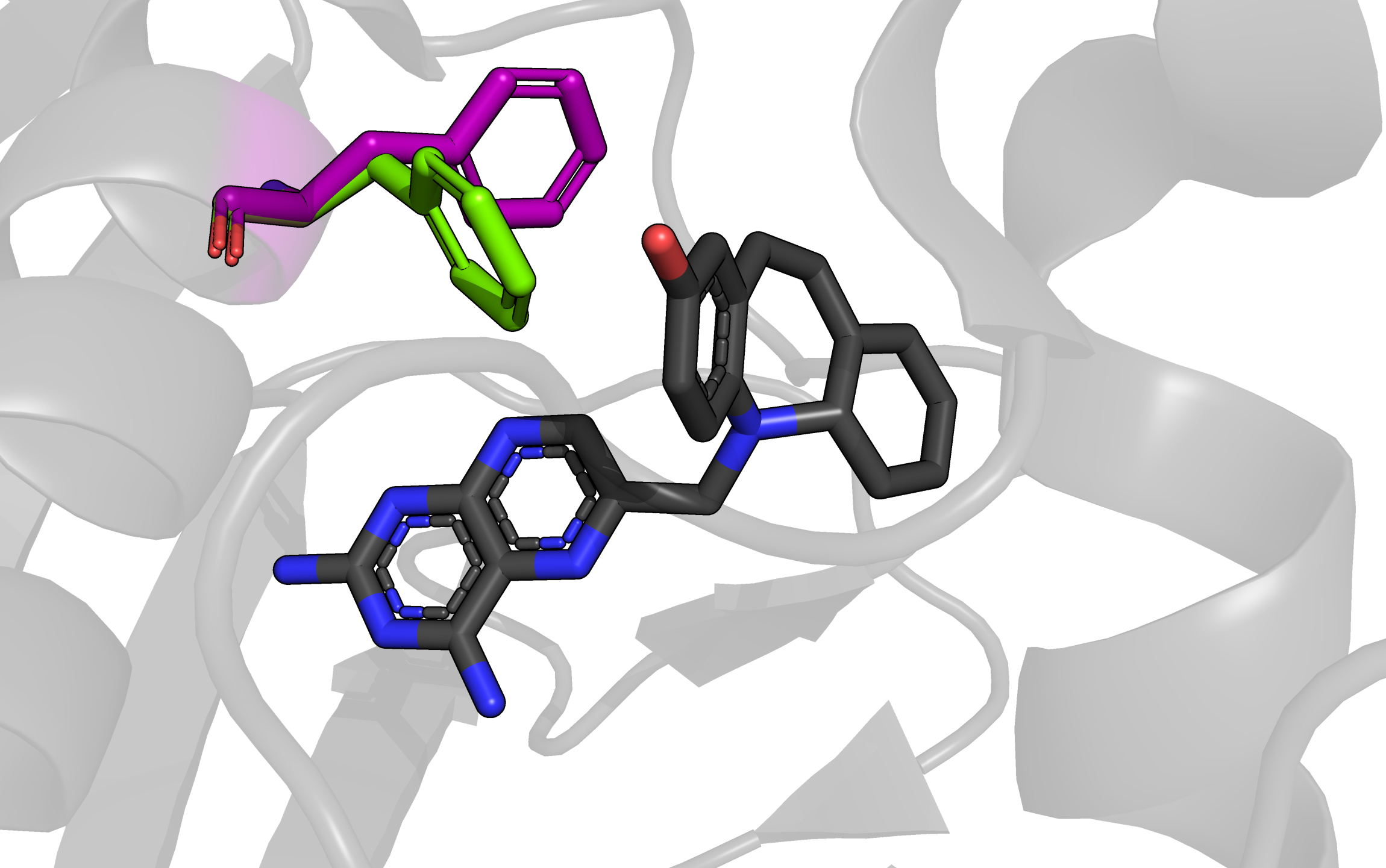
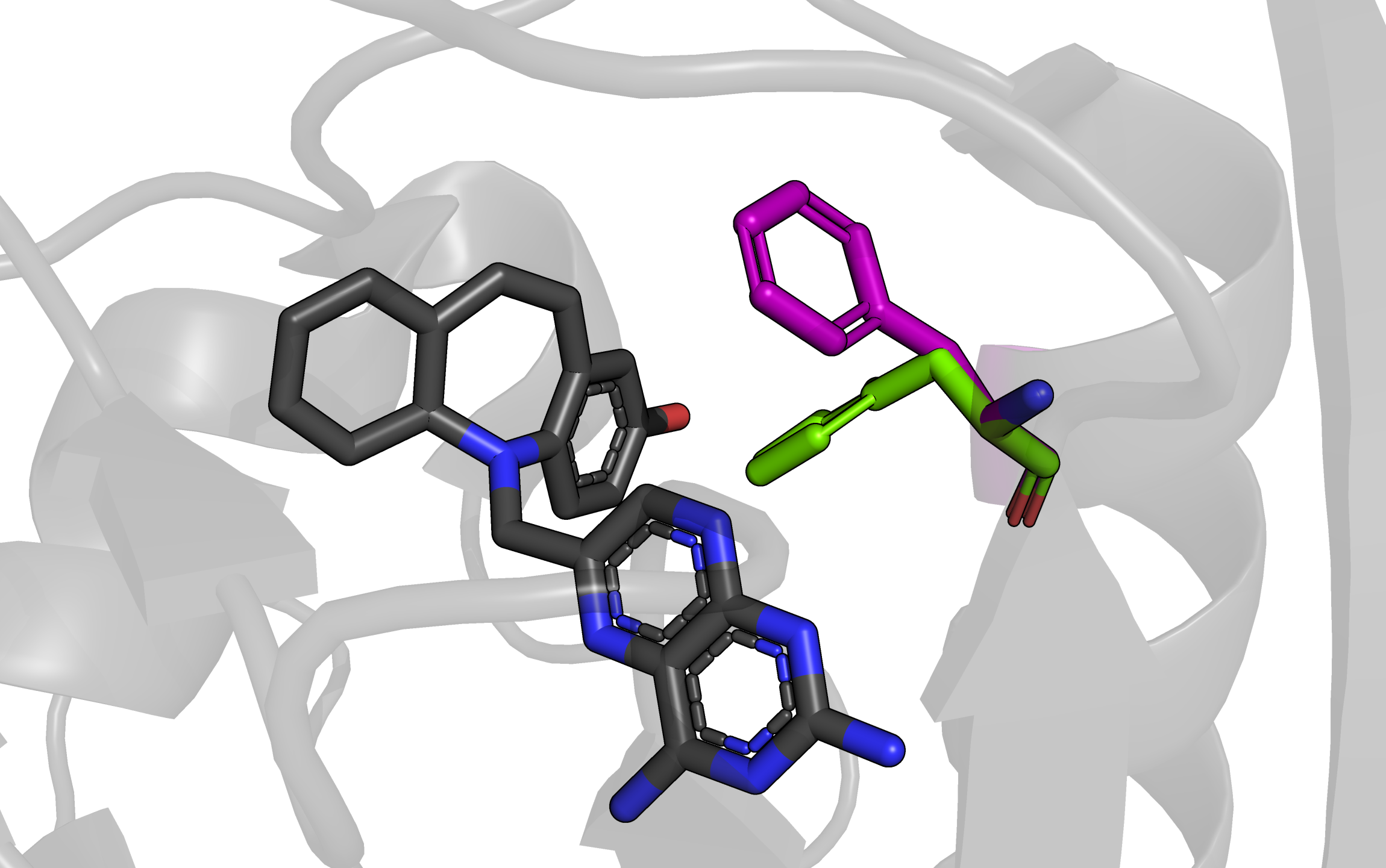
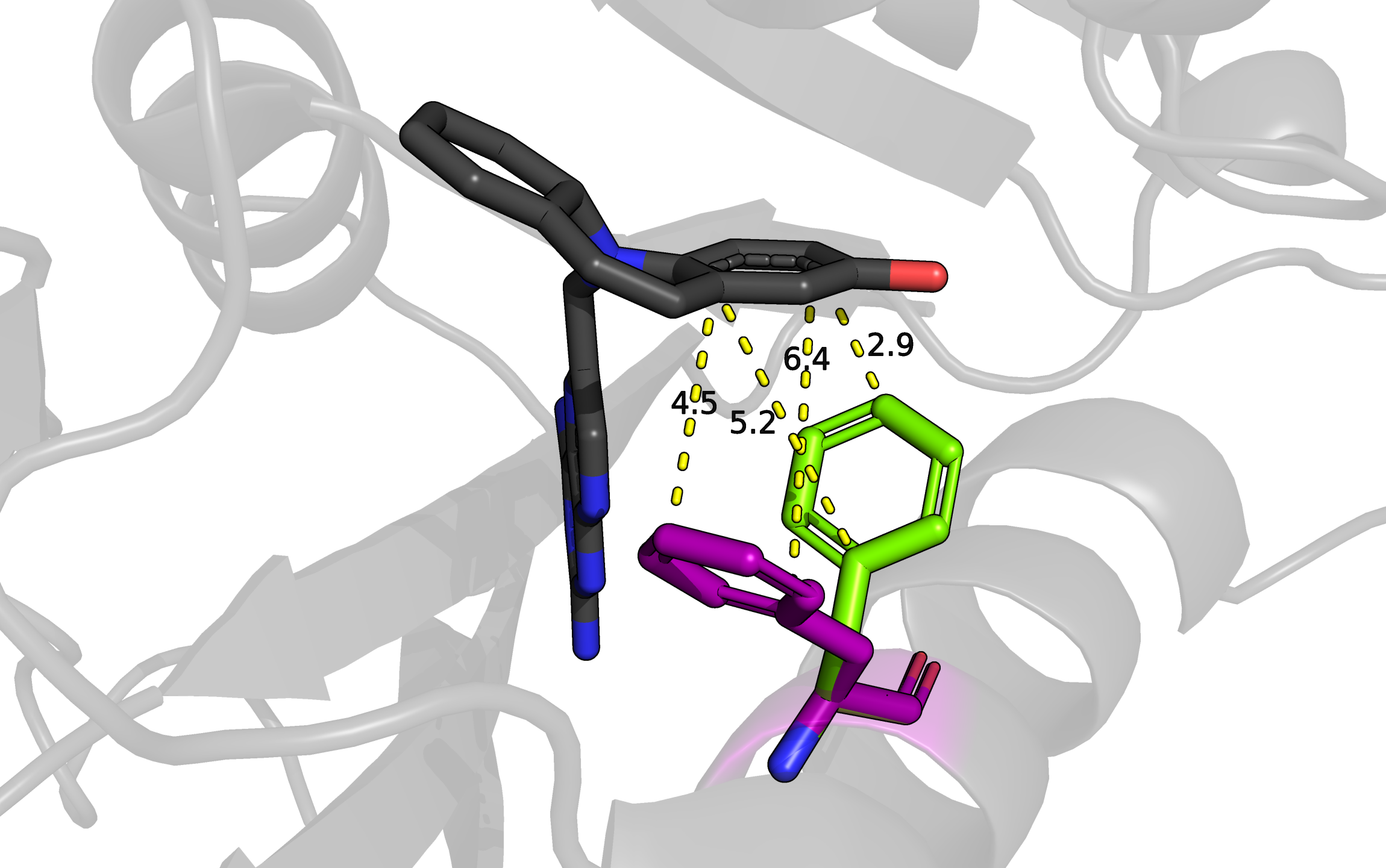
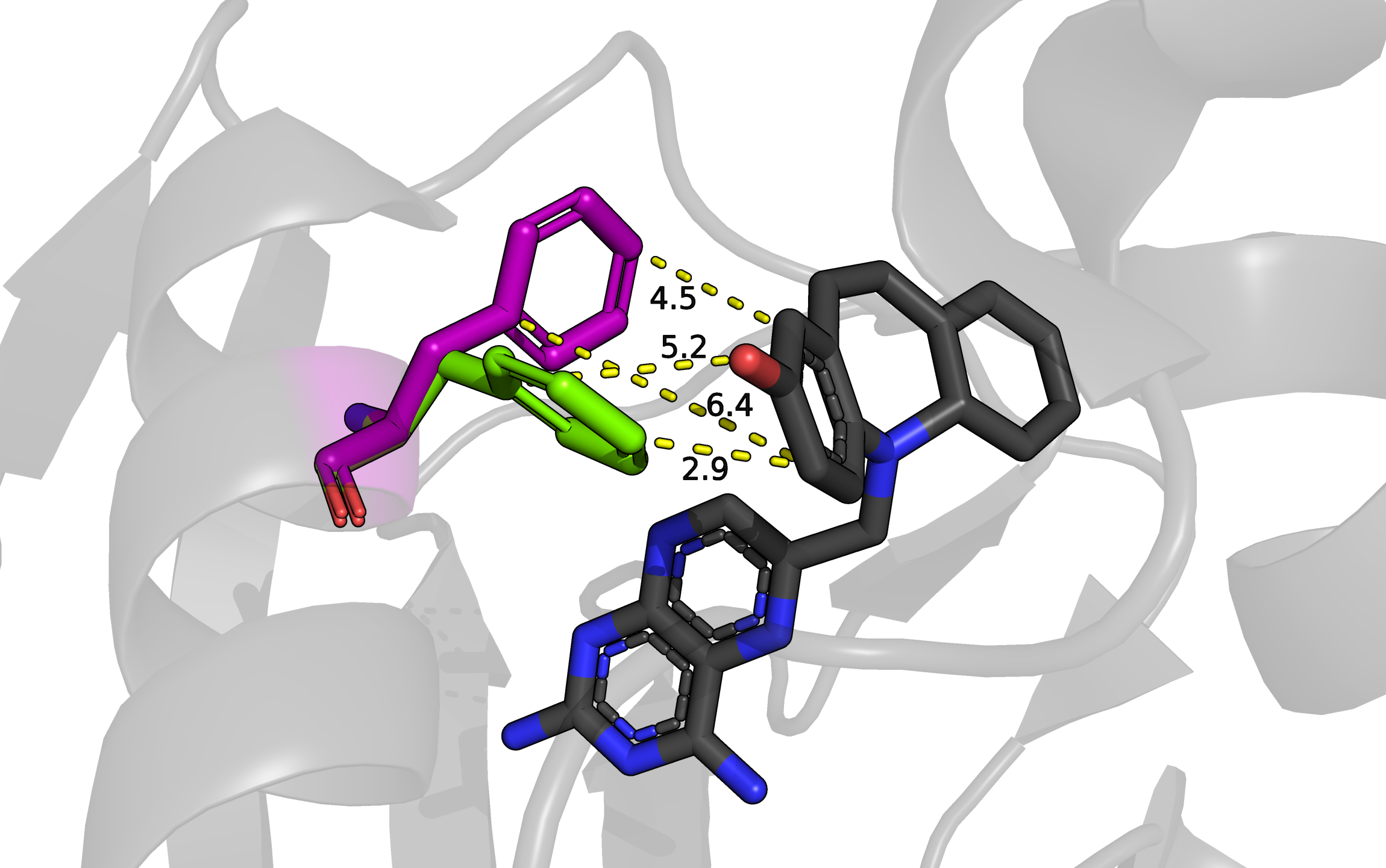
На рисунке изображен остаток фенилаланина 31, у которого есть 2 альтернативных положения, они показаны фиолетовым (положение A) и зеленым (положение B). Рядом находится молекула ингибитора фермента (2,4-Diamino-6-(2'-hydroxydibenz[b,f]azepin-5-yl)methylpteridine), показана черными sticks'ами. Создается впечатление, что оба альтлока слабо стабилизированы. Расстояние от альтлока A (фиолетовый) до ближайших атомов ароматического кольца ингибитора - от 4,5 до 6,4 Ангстрем. Это рассояние кажется слишком большим для значительного влияния пи-стэкинга. Ароматическое кольцо альтлока A (зеленый) находится ближе к кольцу лиганда: расстояния между атомами от 2,9 до 5,2 Ангстрем, такие значения подходят, чтобы рассматривать здесь влияние пи-стэкинга. Однако кольца находятся под достаточно большим углом друг к другу, к тому же со сдвигом в сторону, поэтому вряд ли там возможно значительное взаимодействие, обусловленное пи-стэкингом. Из всего этого можно сделать вывод, что эти альтлоки примерно равнозначны, но, возможно, положение B (зеленый остаток) стабилизировано лучше из-за более близкого расположения колец. Из информации в pdb файле для этой структуры населенность обоих альтлоков равна 0.5.
Величина b-фактора отражает точность, с которой мы можем предположить положение атома (чем больше b-фактор атома, тем меньше точность определения его положения). Таким образом, b-фактор связан с подвижностью атома.
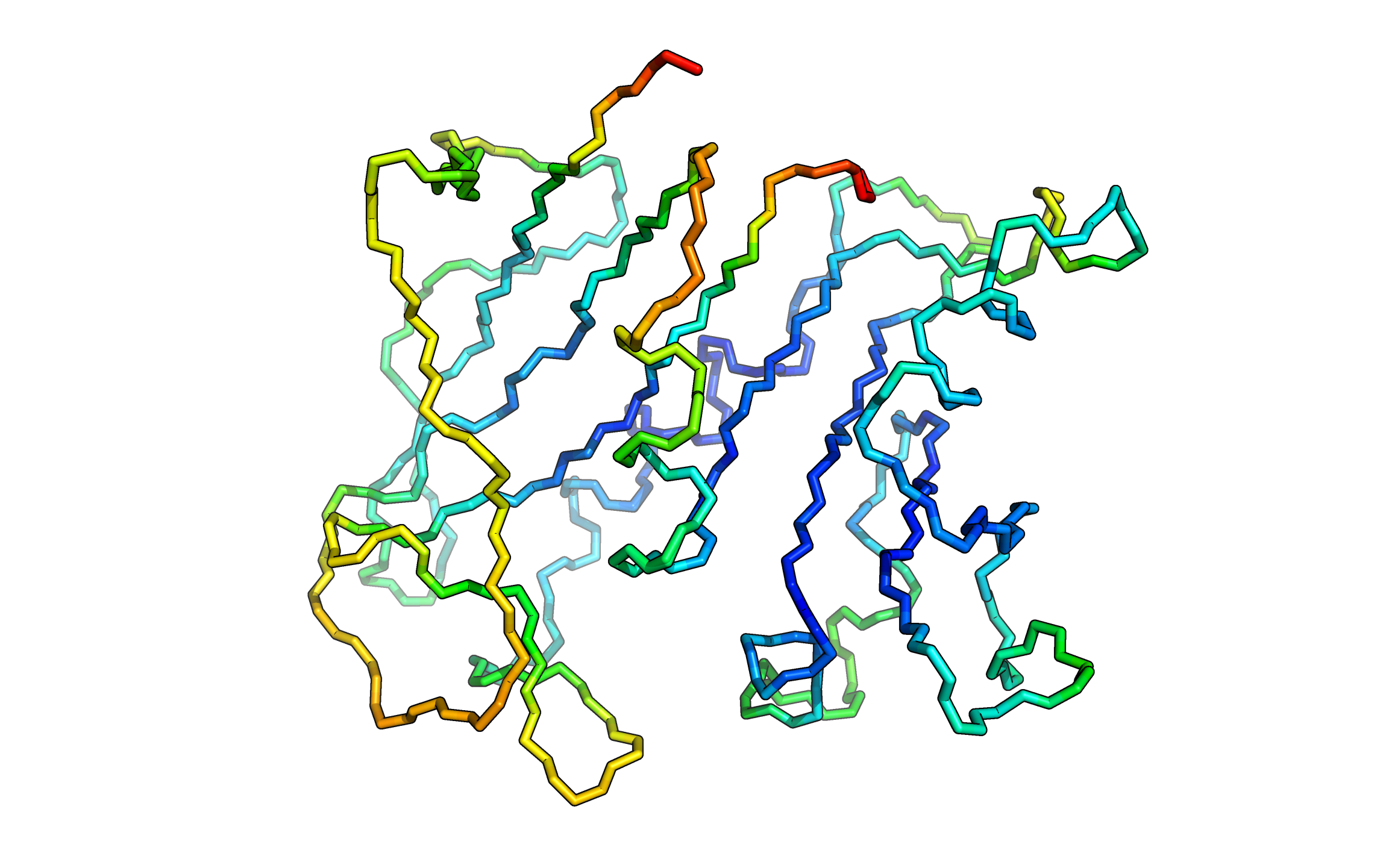
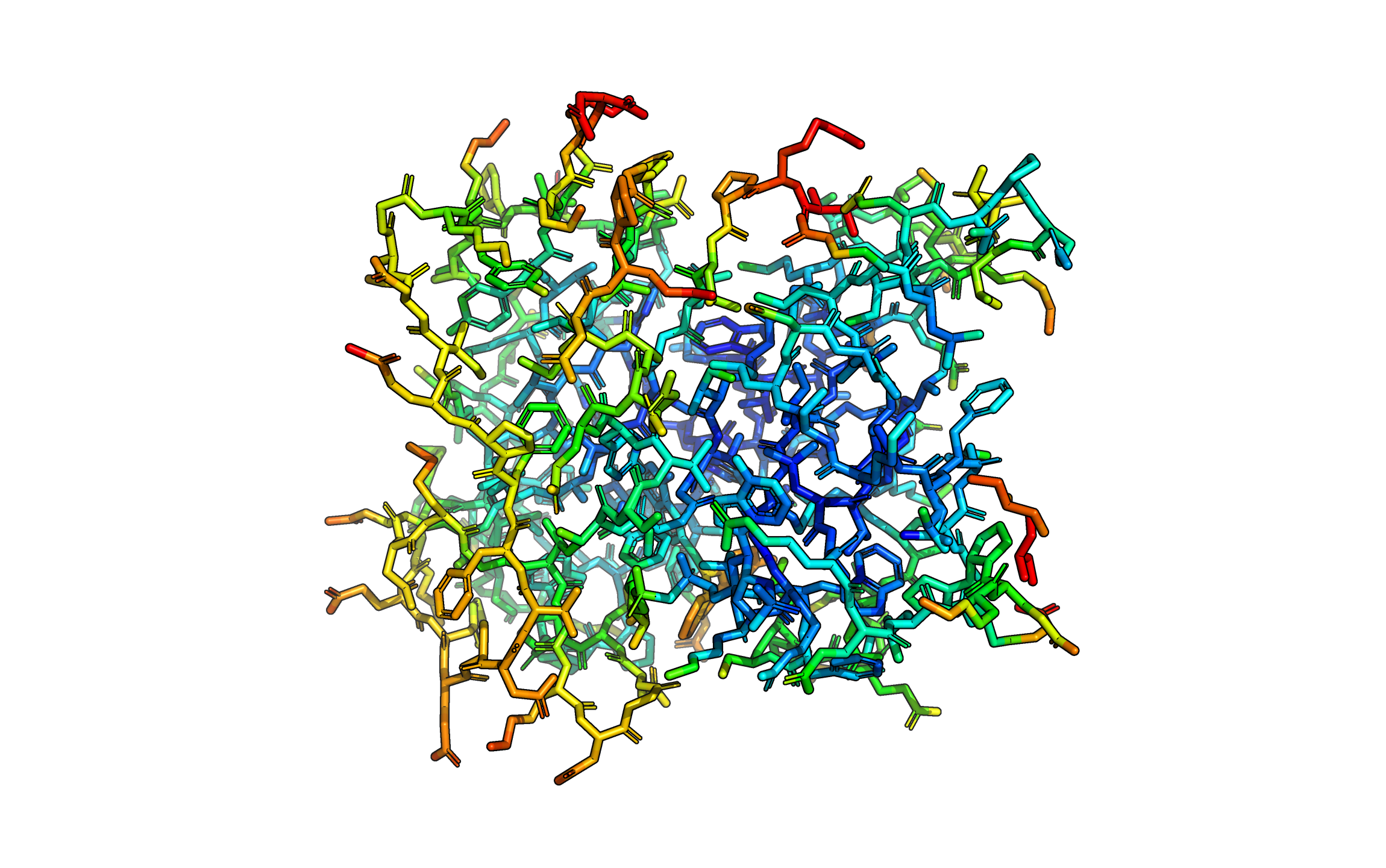
На рисунке выше изображен остов фермента, рассмотренного выше. От синего к красному увеличивается значение b-фактора. Крайние значения - 6 и 35. Заметно, что участки на поверхности белка обладают большими значениями b-фактора, чем участки в середине молекулы, а наибольшие значения наблюдаются на концах цепи.
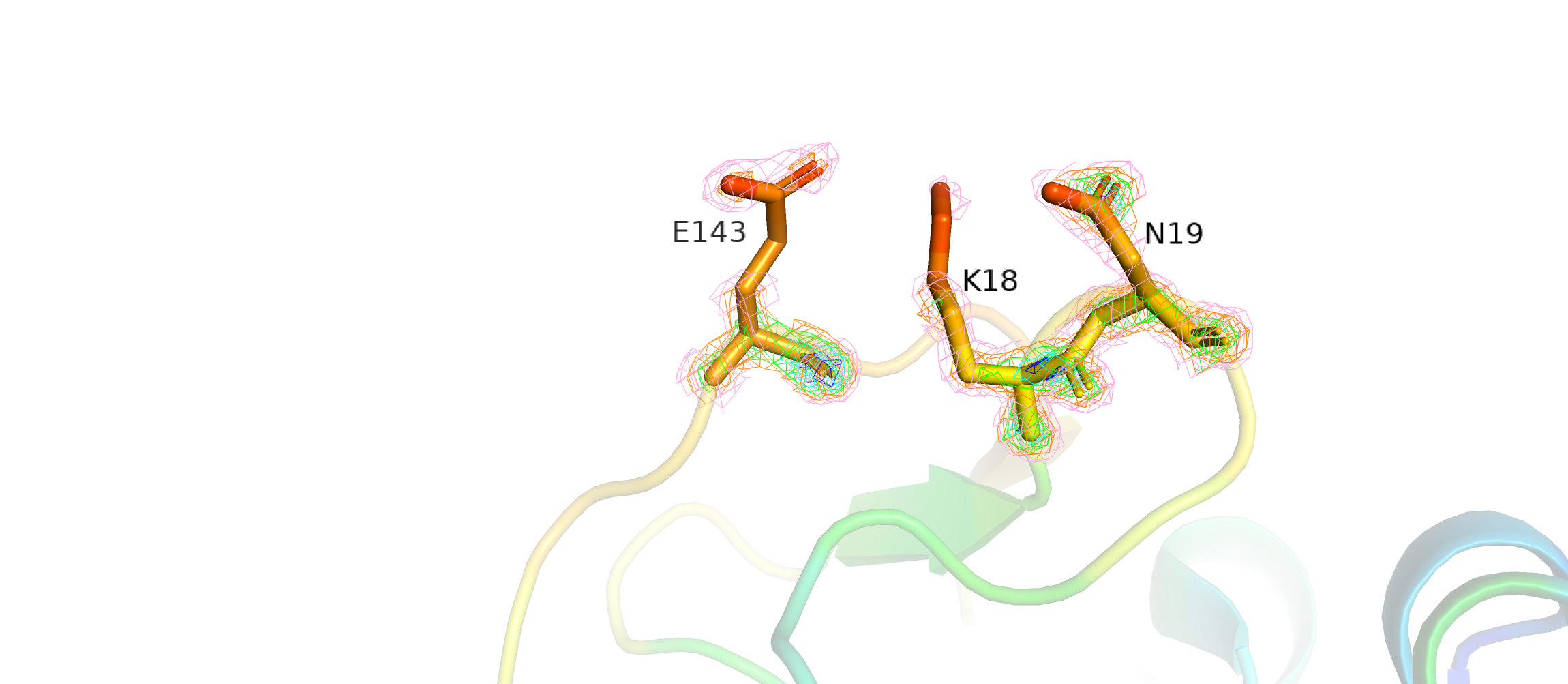
На рисунке выше показана электронная плотность атомов на уровнях подрезки от 1 до 3 с шагом в 0,5. Было бы логично предположить, что с увеличением уровня подрезки электронная плотность будет пропадать первым делом с самых подвижных атомов, так как там она сильнее размыта. Так и происходит, например, у остатков глутамата и лизина. Немного другая картина на остатке аспартата: на уровне подрезки 2,5 (голубая сетка) на боковой цепи остается значительная плотность, а на её остове плотности уже нет.
Рассмотрим структуру кристалла моего белка и расположение соседей вокруг него.
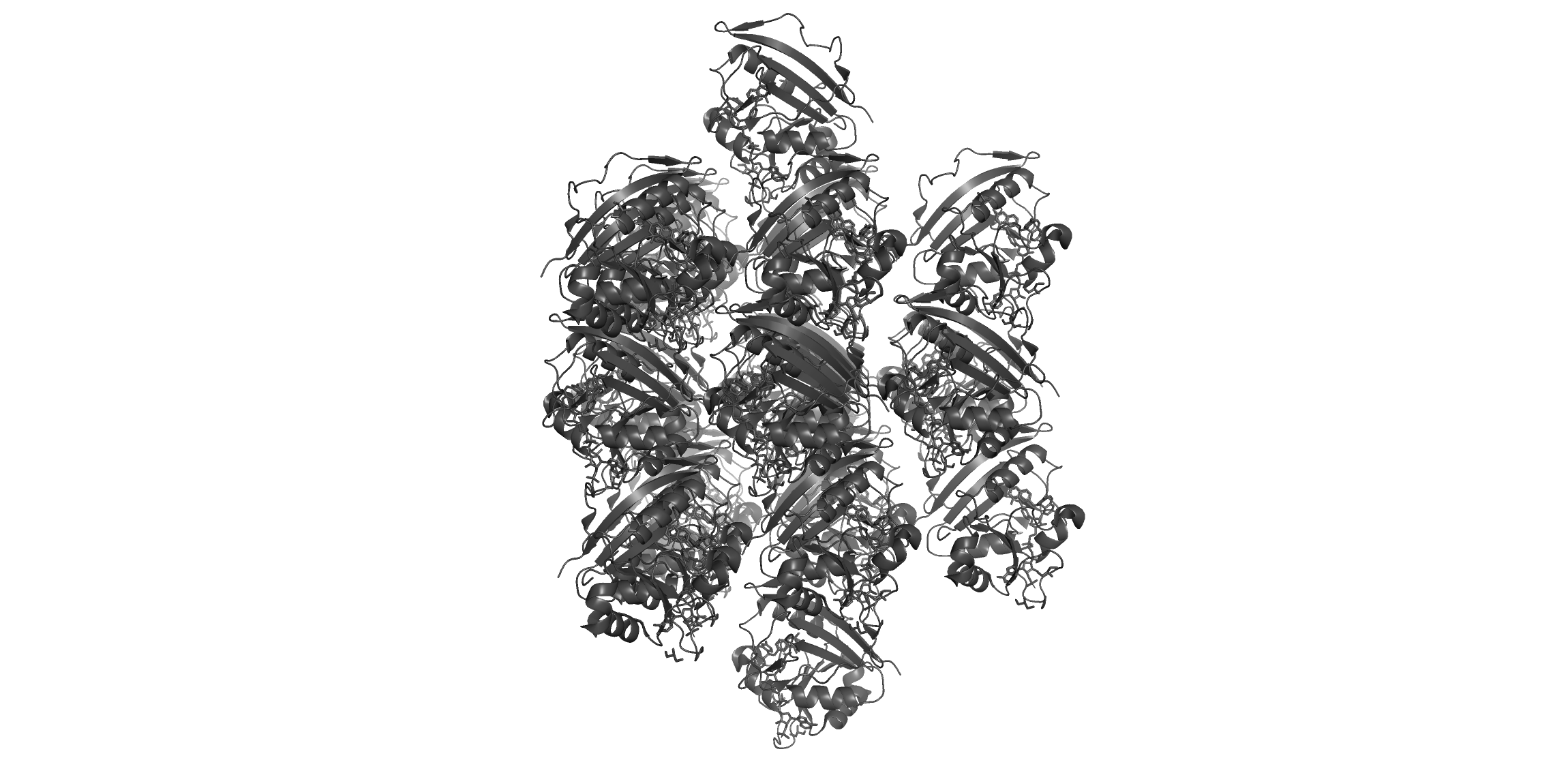
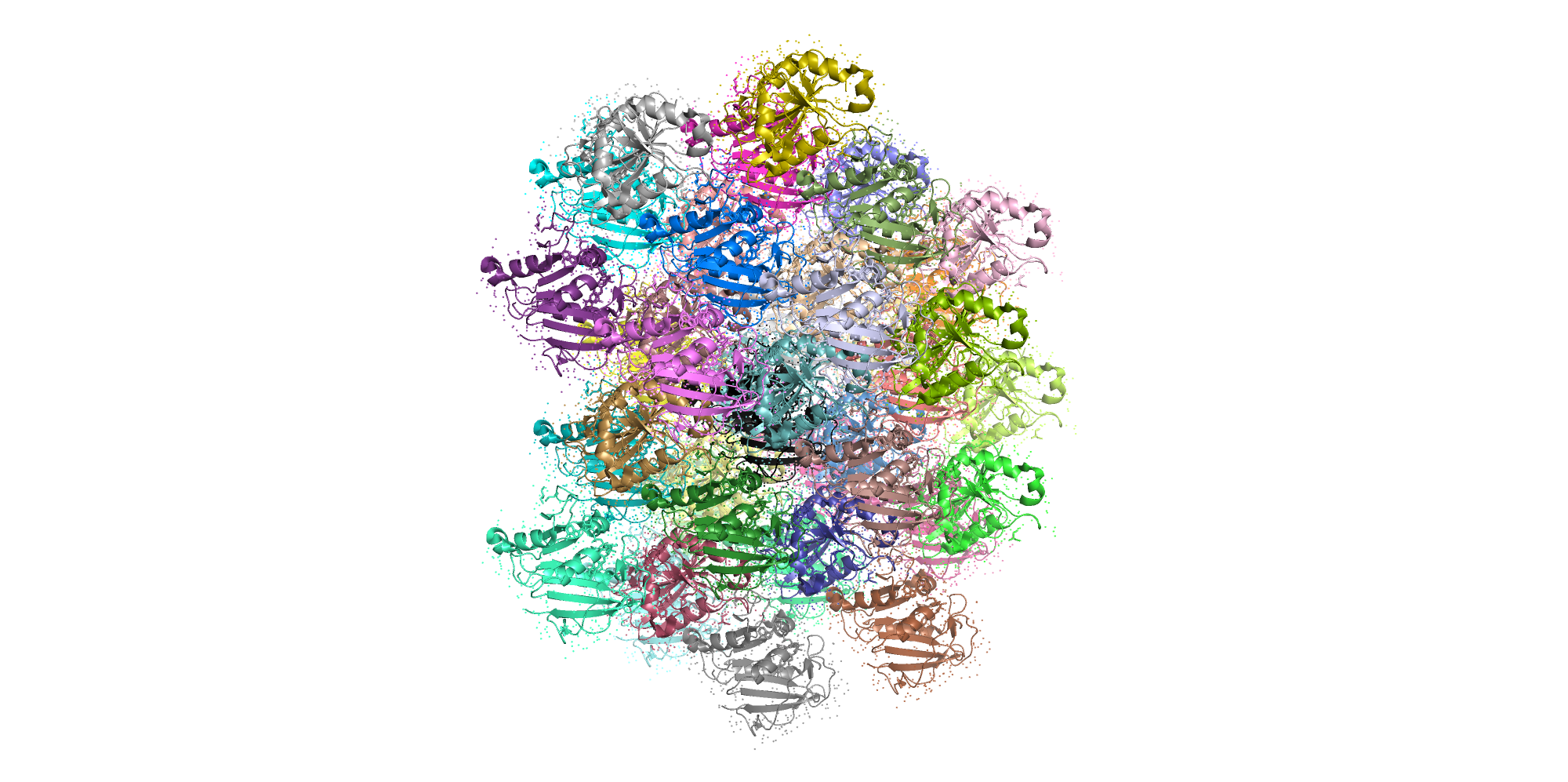
Кристалл белка
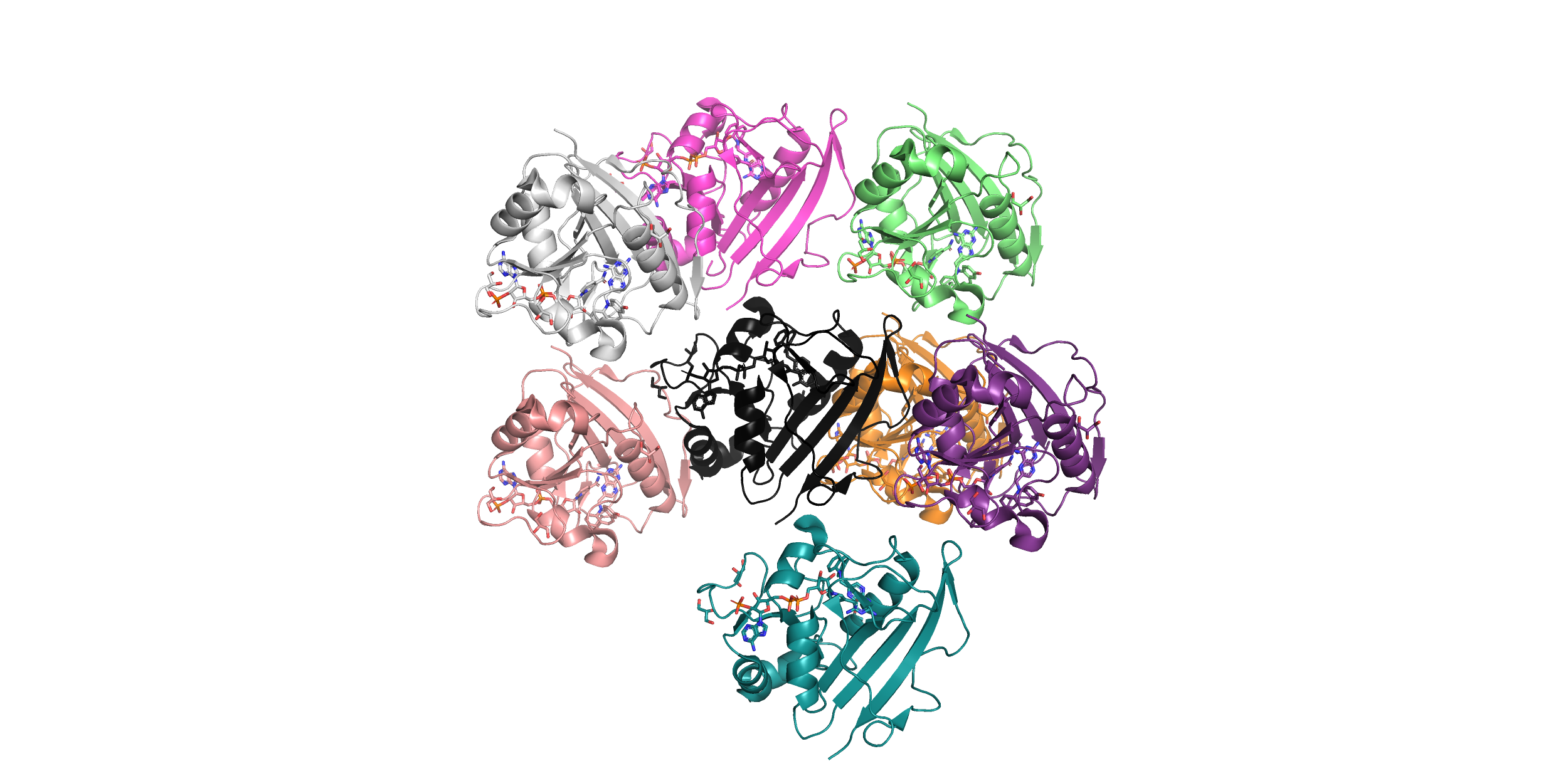
Ниже изображены ближайшие соседи исходной молекулы (7 штук), с которыми она соприкасается. Для получения картинки я использовала отсечку по расстоянию 12 Ангстрем, после чего удалила не соприкасающиеся с исходной (черной) структурой молекулы.
© Антоненкова Юлия, 2017