В этом задании требовалось сравнить контакты лиганда с белком, найденные в рамках практикума 1, с теми, что выдает программа ProteinsPlus + PoseView. Выдача программы в виде рисунка - ниже.
Программа нашла один контакт: водородную связь между кислородом лиганда и азотом остова
глицина. В практикуме 1 я выделяла этот контакт как возможный наряду с еще одним контактом:
водородной связью между тем же кислородом лиганда и азотом остова в цистеине.
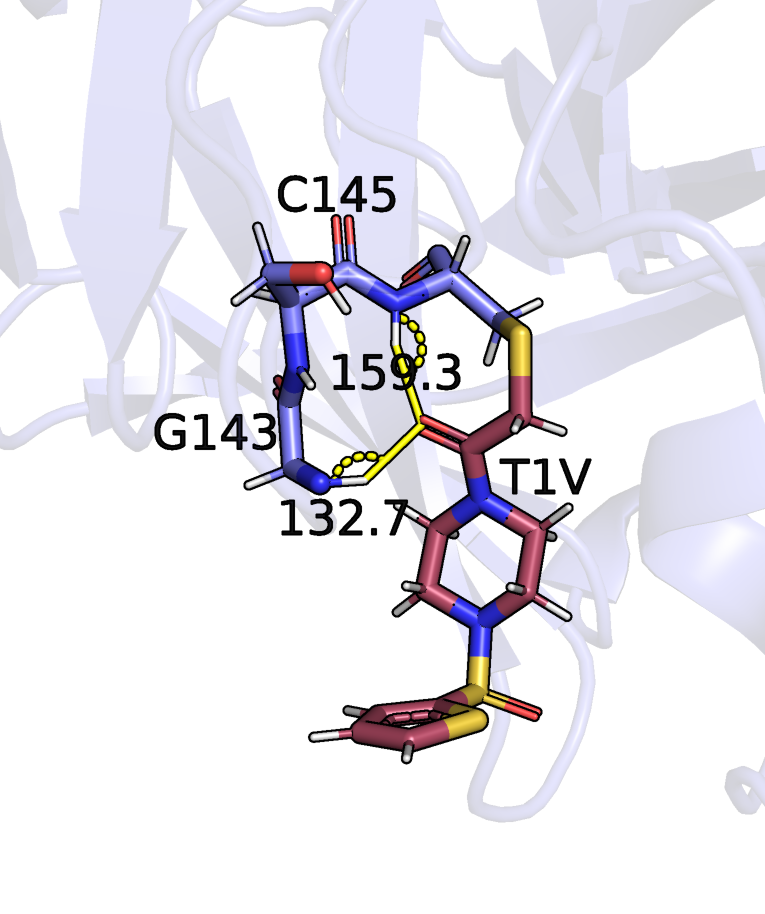
Сравненим эти два возможных контакта (рисунки ниже).
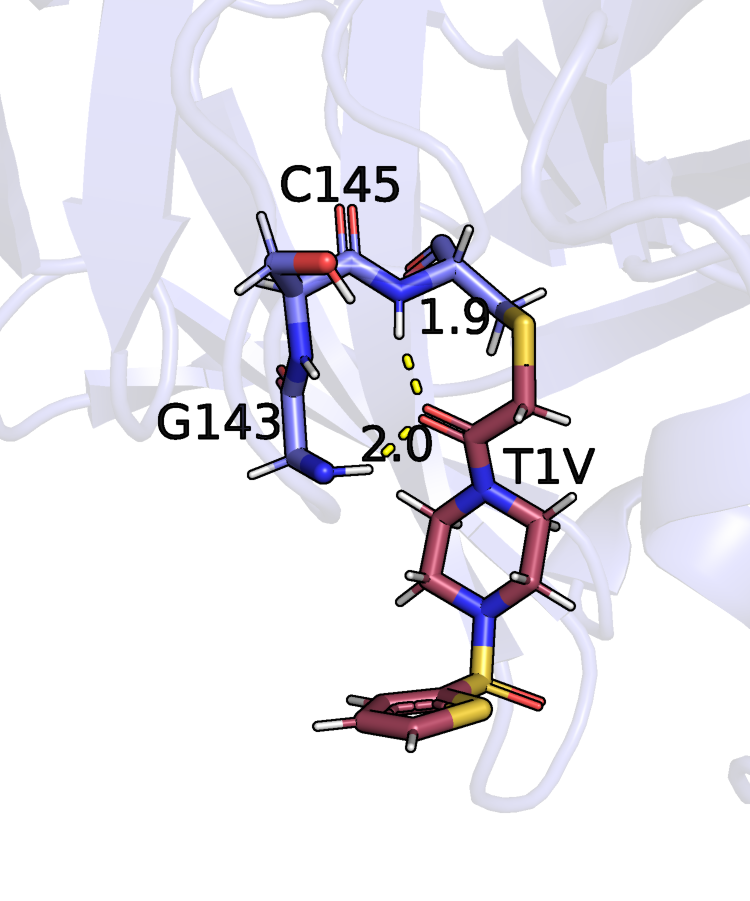
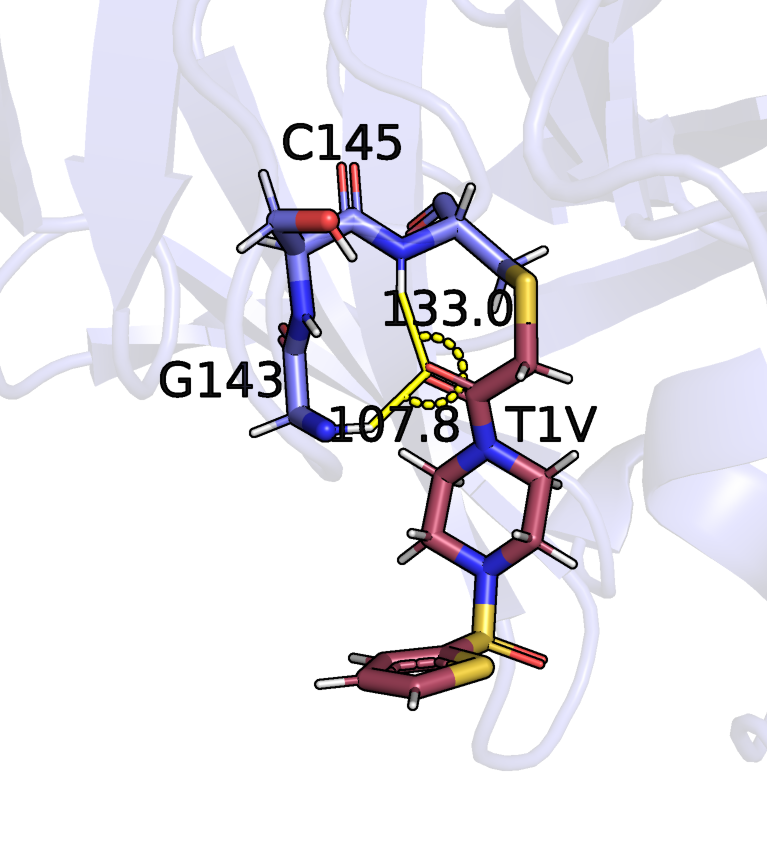
1. На левом рисунке отмечены расстояния между
кислородом лиганда и водородами, которые могут образовывать связь: оба расстояния подходят для
выделения водородной связи, к тому же различаются только на 0.1 Ангстрем.
2. На средней картинке отмечены углы C-O-H, на которые в случае взаимодействия
с водородом отклоняется одна из неподелённых электронных пар кислорода лиганда. "Идеальным"
я считала угол 120 градусов, исходя из данных статьи [1], тогда оба угла в структуре отклоняются
от идеального на 12.2 и 13 градусов, разница несущественная.
3. Угол водородной связи O-H-N (правый рисунок) с цистеином ~160 градусов, что гораздо ближе к "идеальному" углу 180 градусов,
чем ~133 градуса в связи с глицином. Так как по остальным параметрам сравнения
эти варианты связей примерно равны, можно считать, что из-за различий в угле водородной связи
более вероятна водородная связь с цистеином, чем с глицином. То есть, я не могу
согласиться с тем, что выдает программа.
[1] Charting Hydrogen Bond Anisotropy.
Diogo Santos-Martins and Stefano Forli, J.Chem.Theory Comput. 2020, 16, 2846-2856
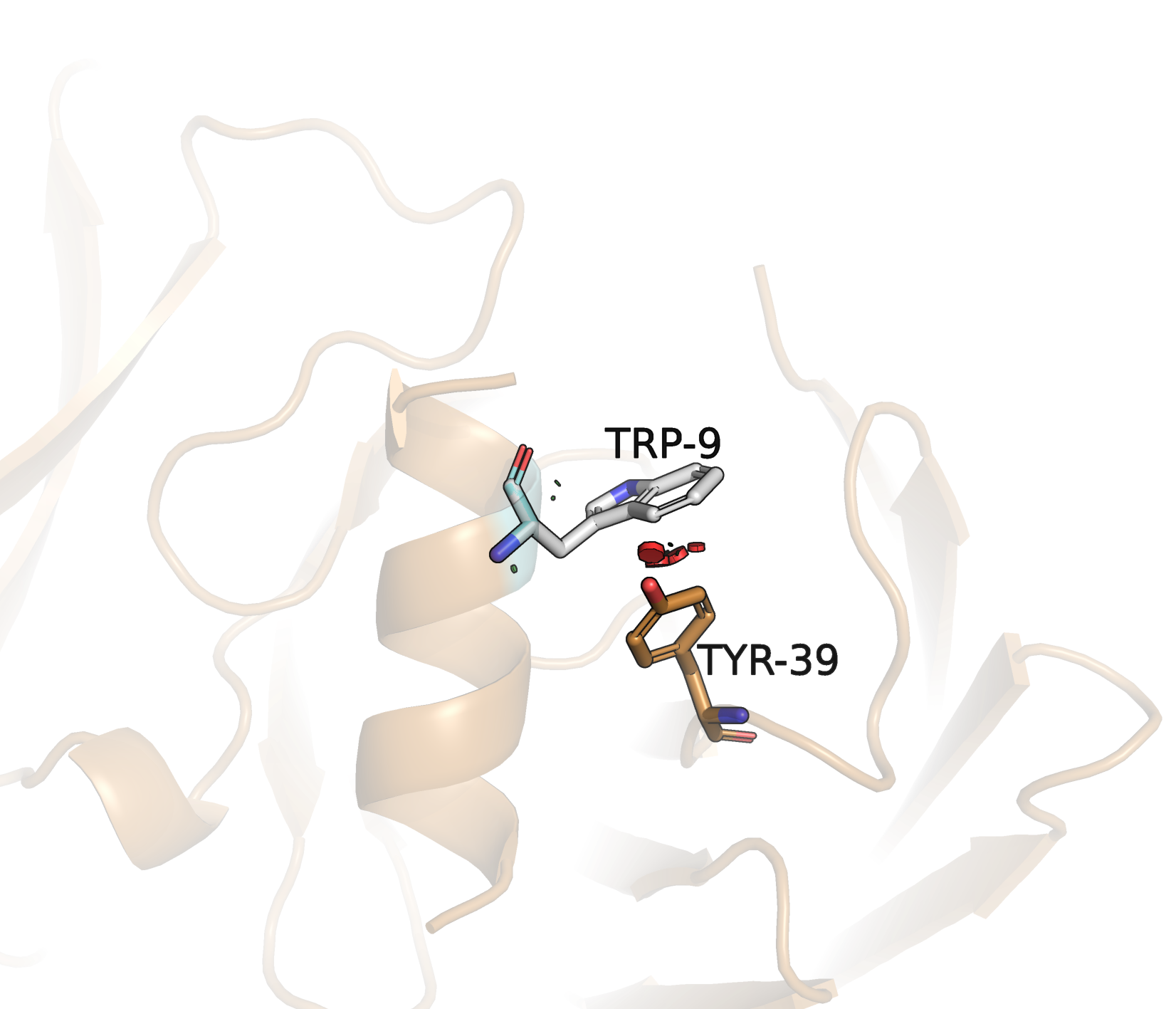
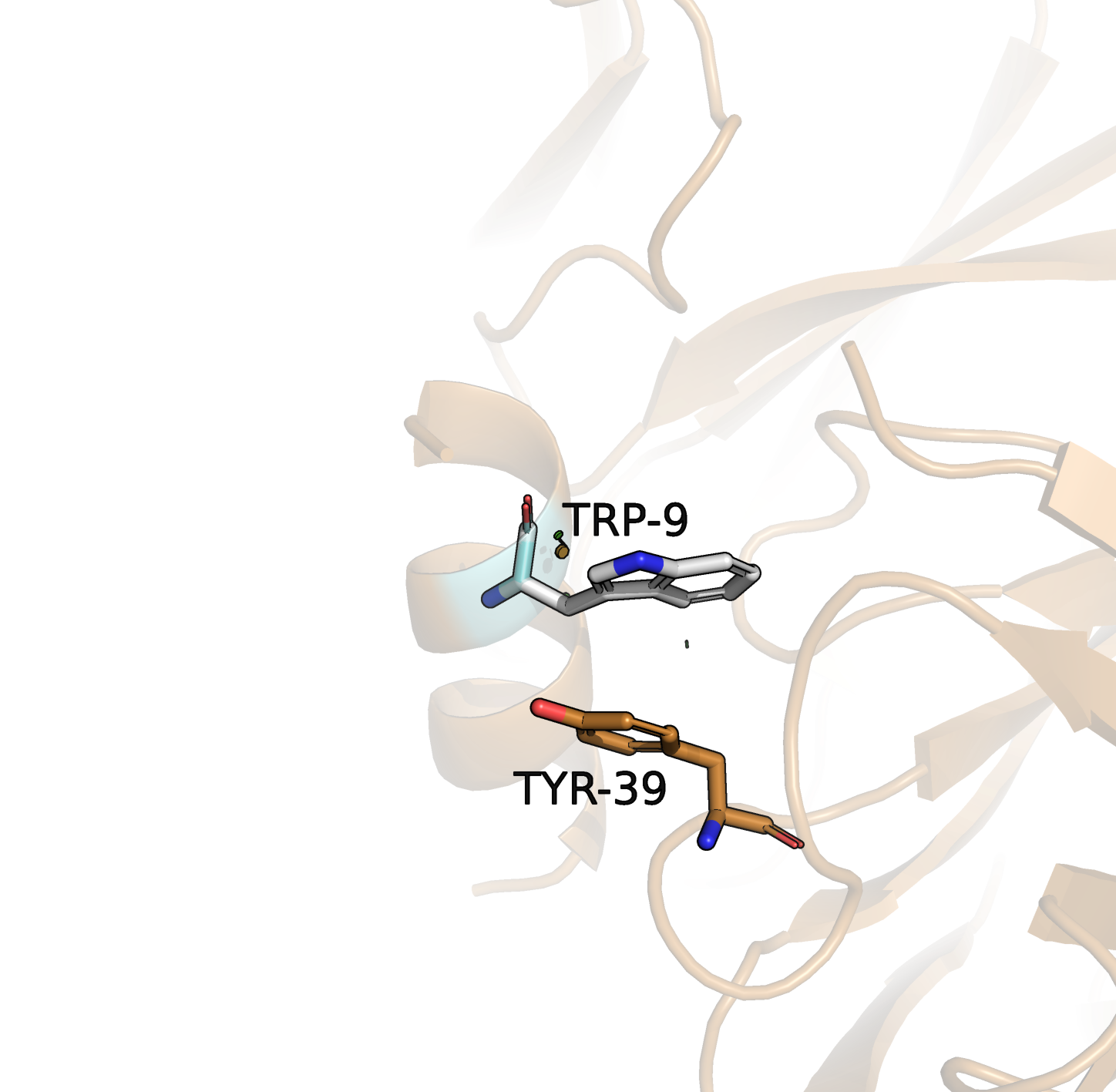
Остаток, измененный на глицин, отмечен голубым цветом. В непосредственной близости от него есть только тирозин антитела, выделенный на рисунке. В тирозин антитела входит ароматическое кольцо, которое может участвовать в пи-стекинге, образуя сильную связь, что и необходимо во взаимодействии антитела с антигеном, поэтому в качестве вариантов на место глицина я рассматривала ароматические аминокислоты: тирозин, фенилаланин, триптофан.
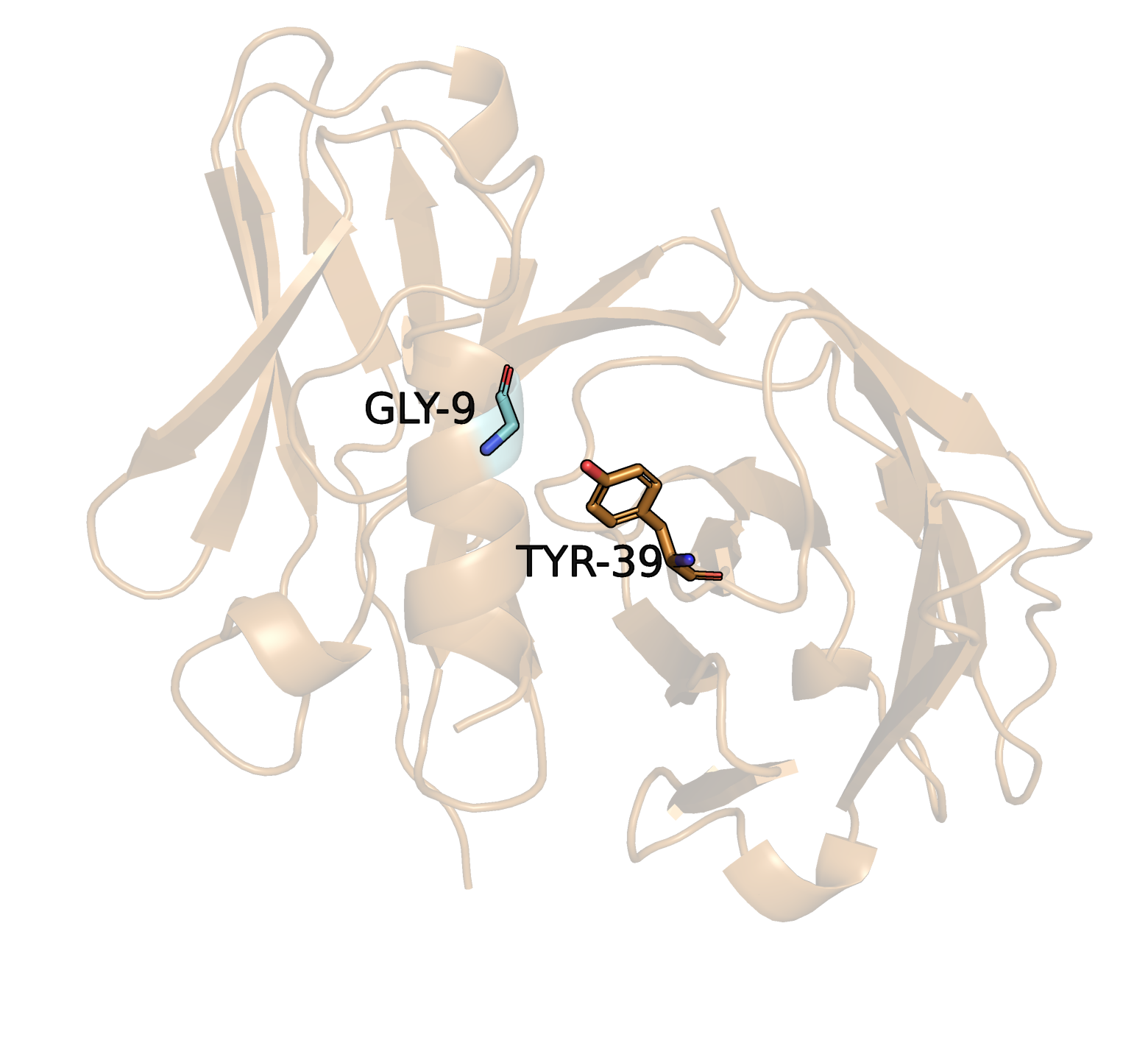
Рассмотрим 4 варианта расположения остатков, подошедшие лучше всего.
| Остаток | Ротамер | Напряжённость | Процент встречаемости | |
|---|---|---|---|---|
| 1 | Tyr | 4/4 | 12.75 | 2.3 |
| 2 | Phe | 4/4 | 19.53 | 3.0 |
| 3 | Trp | 2/6 | 15.01 | 28.3 |
| 4 | Trp | 5/6 | 11.17 | 7.1 |
Ниже представлены рисунки, иллюстрирующие эти варианты, в соответствующем таблице порядке. Видно, что наименее выгодное положение у первого триптофана (левый нижний рисунок): кольца триптофана и тирозина находятся под слишком большим углом; исходя их этого, я исключила из рассмотрения этот ротамер триптофана, несмотря на его относительно большой процент представленности. Если сравнить оставшиеся варианты (1, 2, 4), то по обоим параметрам (напряженность и встречаемость) "выигрывает" вариант 4: триптофан. Визуально видно, что его кольца расположены примерно параллельно кольцу тирозина (в отличие от колец тирозина и фенилаланина, которые расположены по небольшим углом), что обеспечит более сильную связь. На основании этого я предполагаю, что изначально в структуре был триптофан (вариант 4) в положении, указанном на 4 рисунке (обведен в рамку).
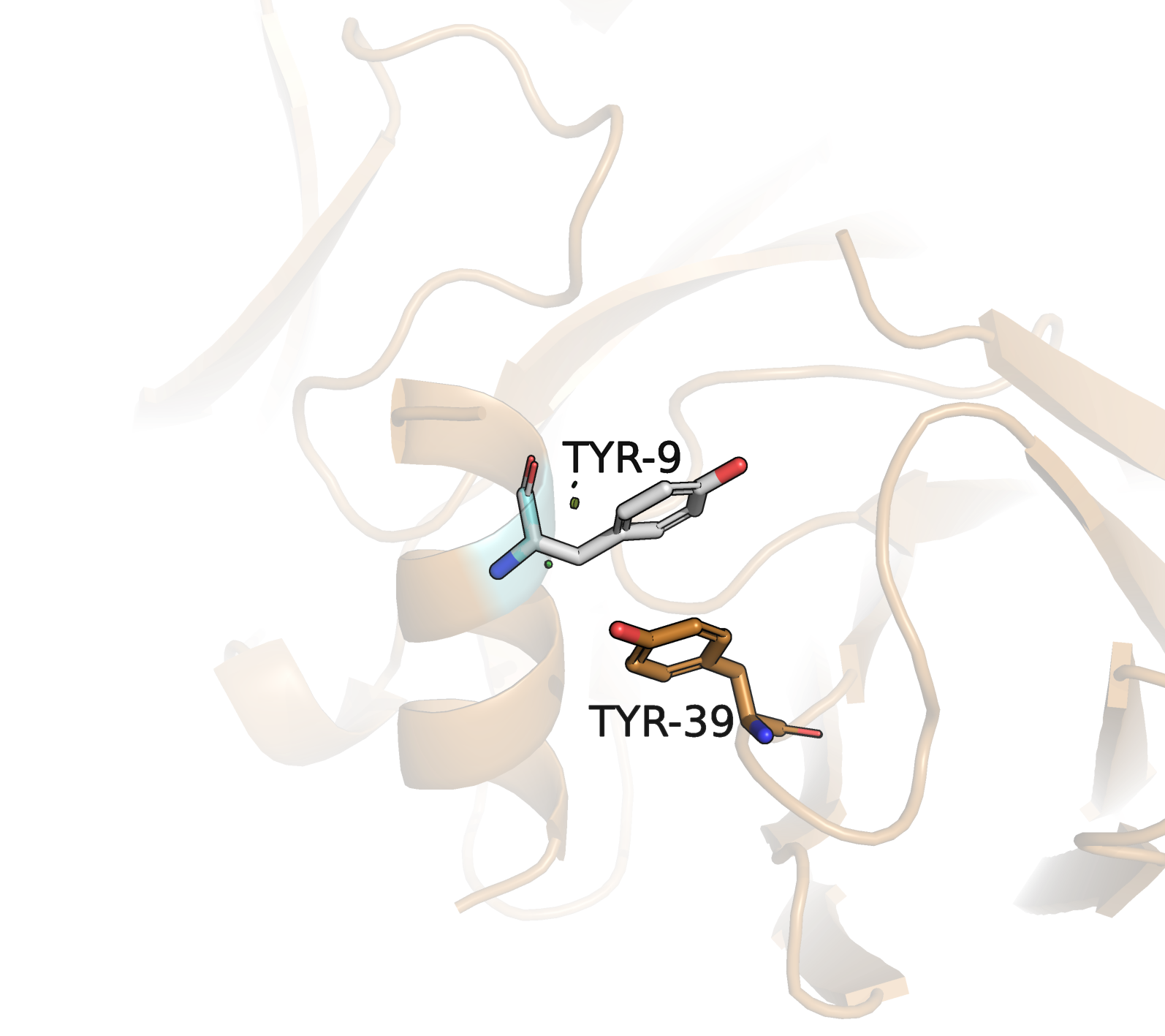
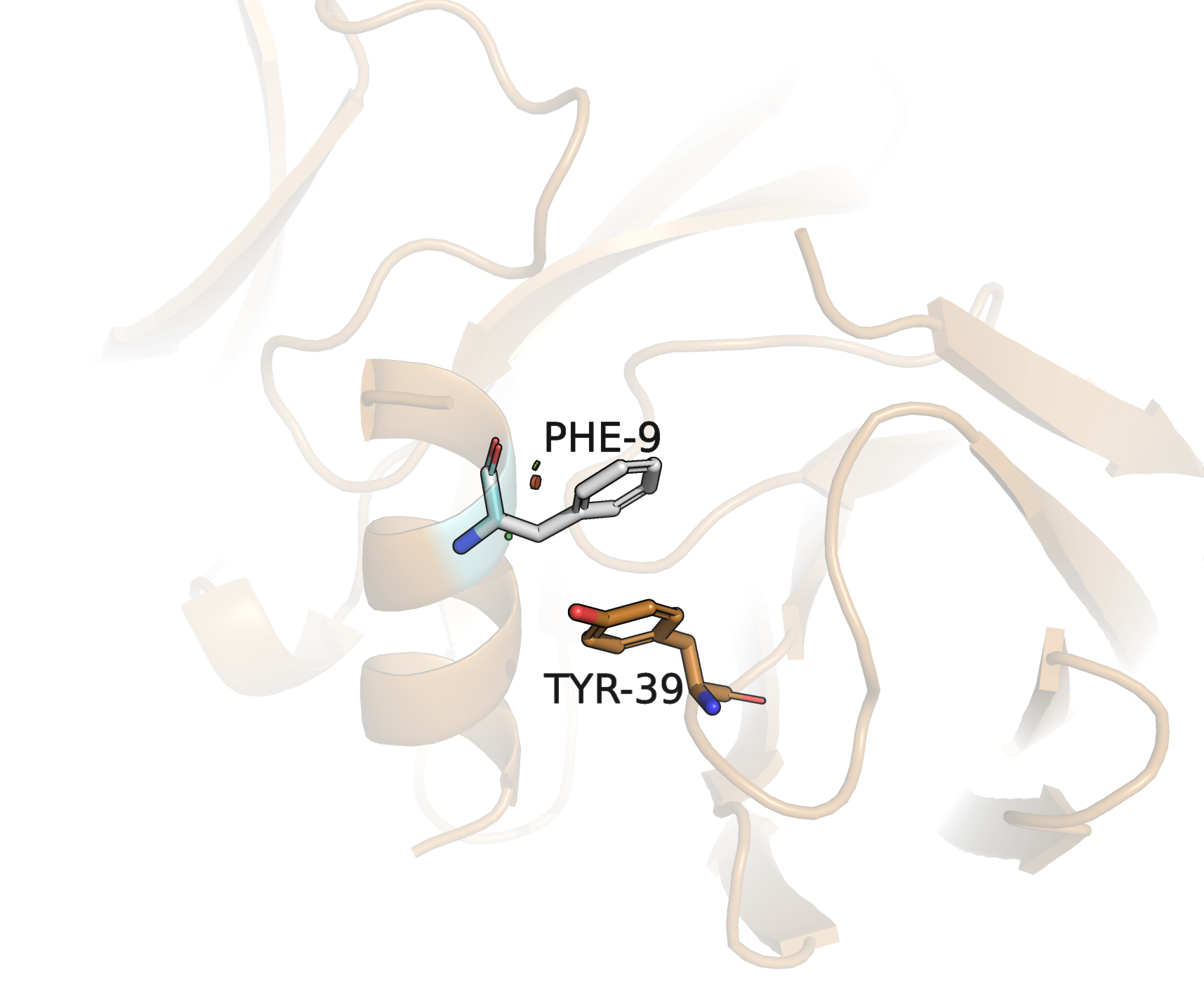
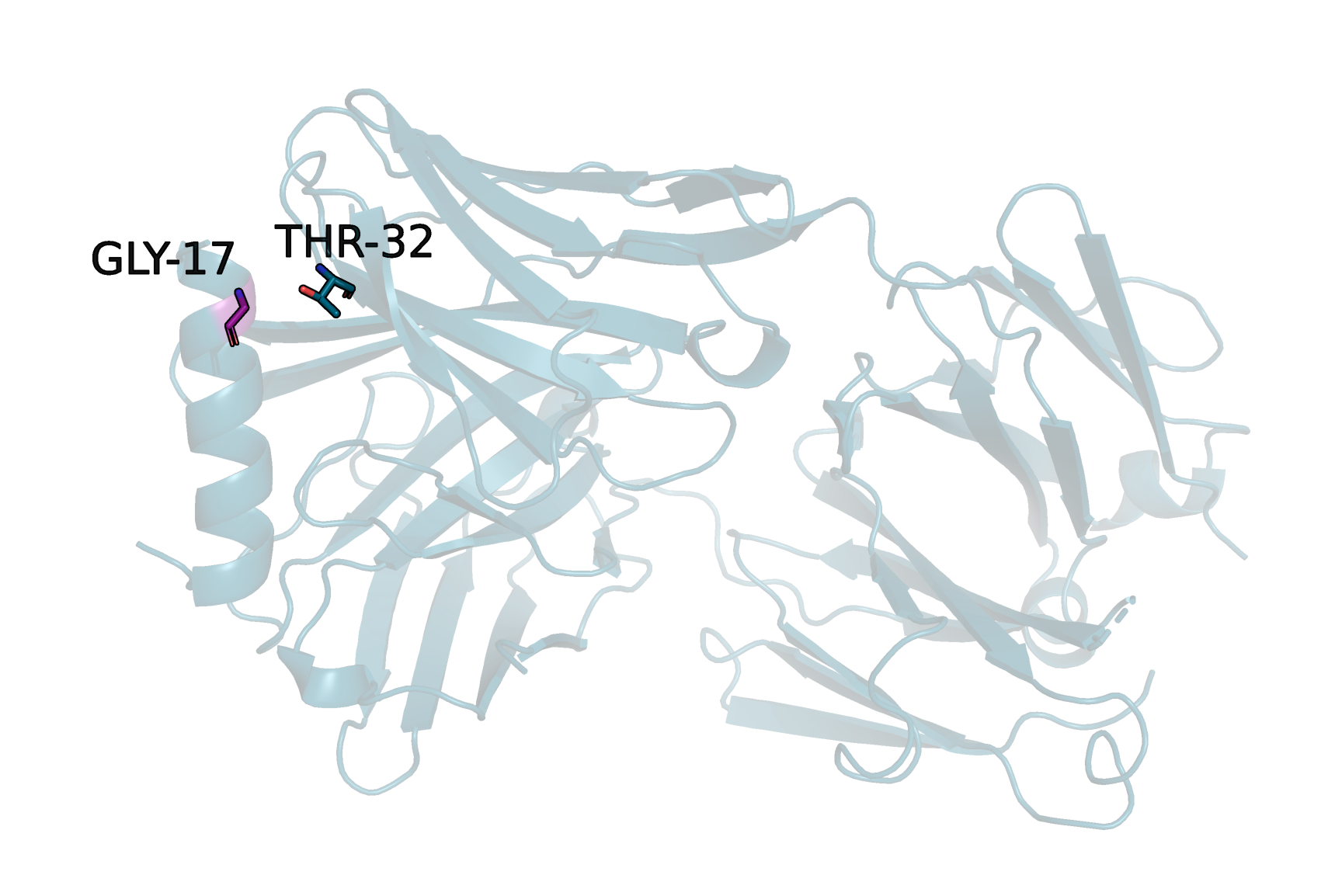
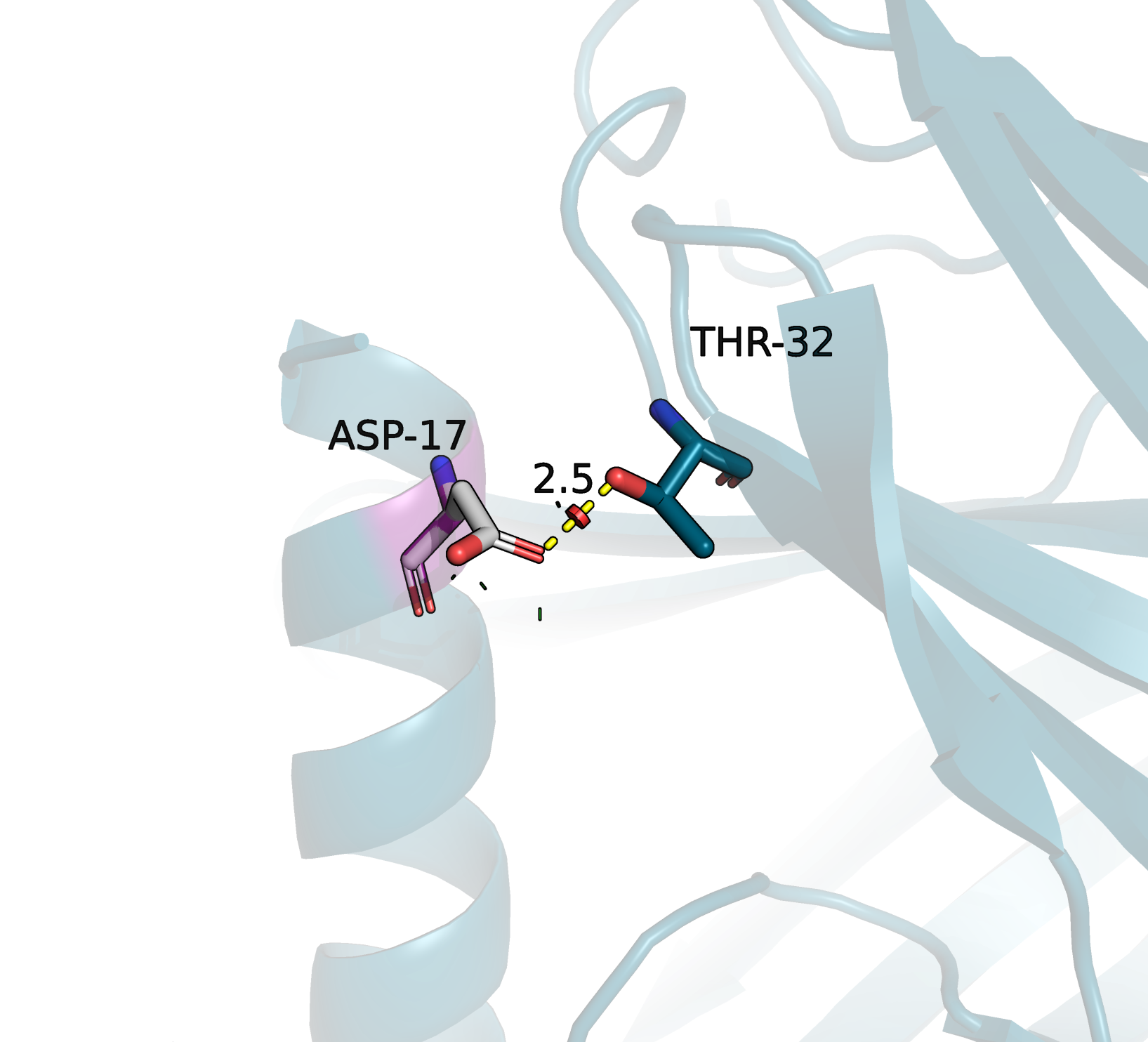
Остаток антигена, замененный на глицин, отмечен на рисунке фиолетовым цветом. Рядом находится только треонин антитела. У треонина есть группа -OH, значит остаток, взаимодействующий с ним, должен быть донором электронов для образования водородной связи. Для такой роли подходит группа =O, которая есть в аспартате, глутамате, аспарагине и глутамине. Глутамат и глутамин оказались слишком большими для имеющегося пространства, поэтому далее они не рассматривались. Также возможно образование пи-водородной связи, если донором выступит ароматическое кольцо тирозина, фенилаланина или триптофана. Однако они тоже не вмещаются в имеющееся пространство.
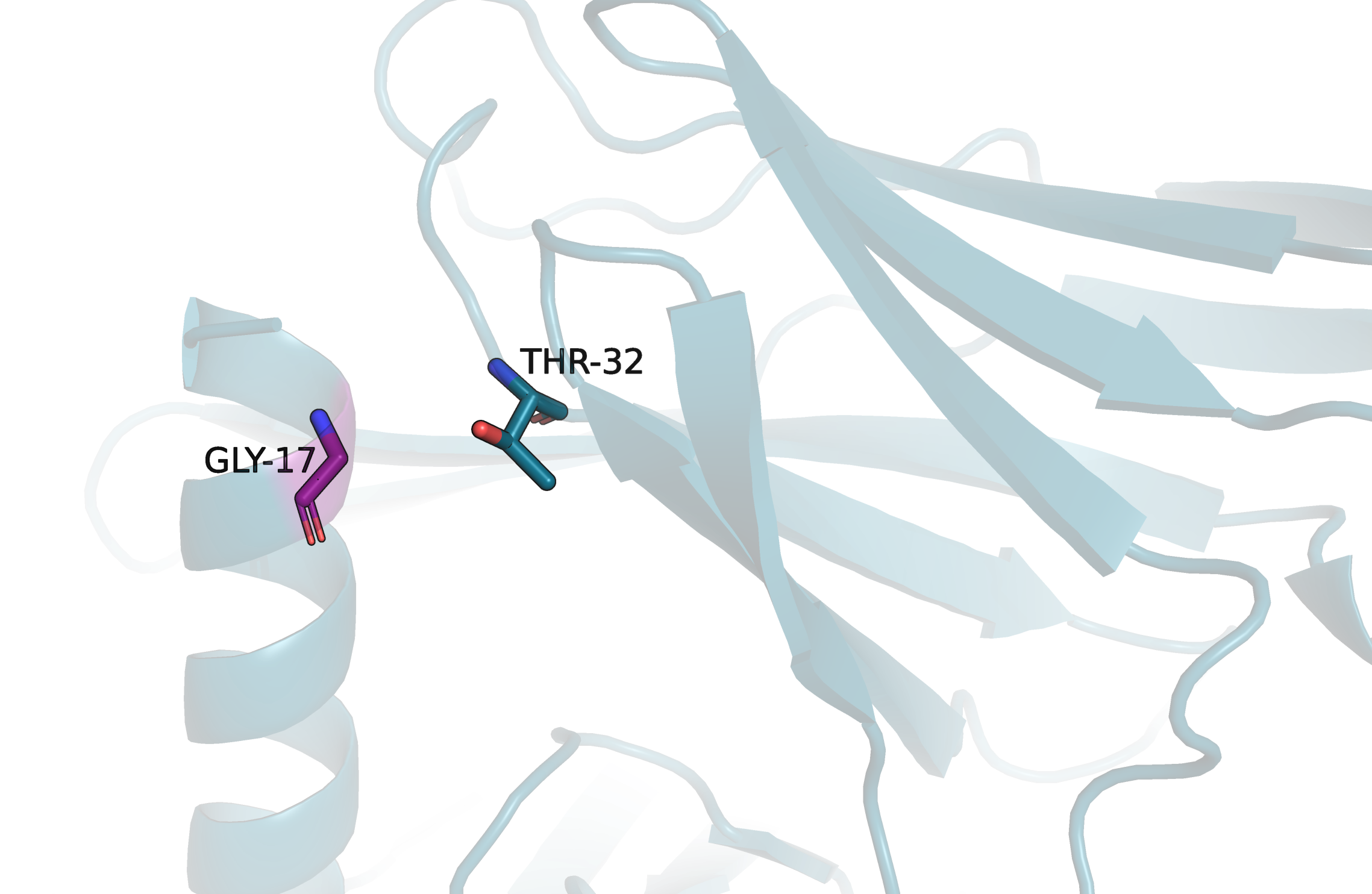
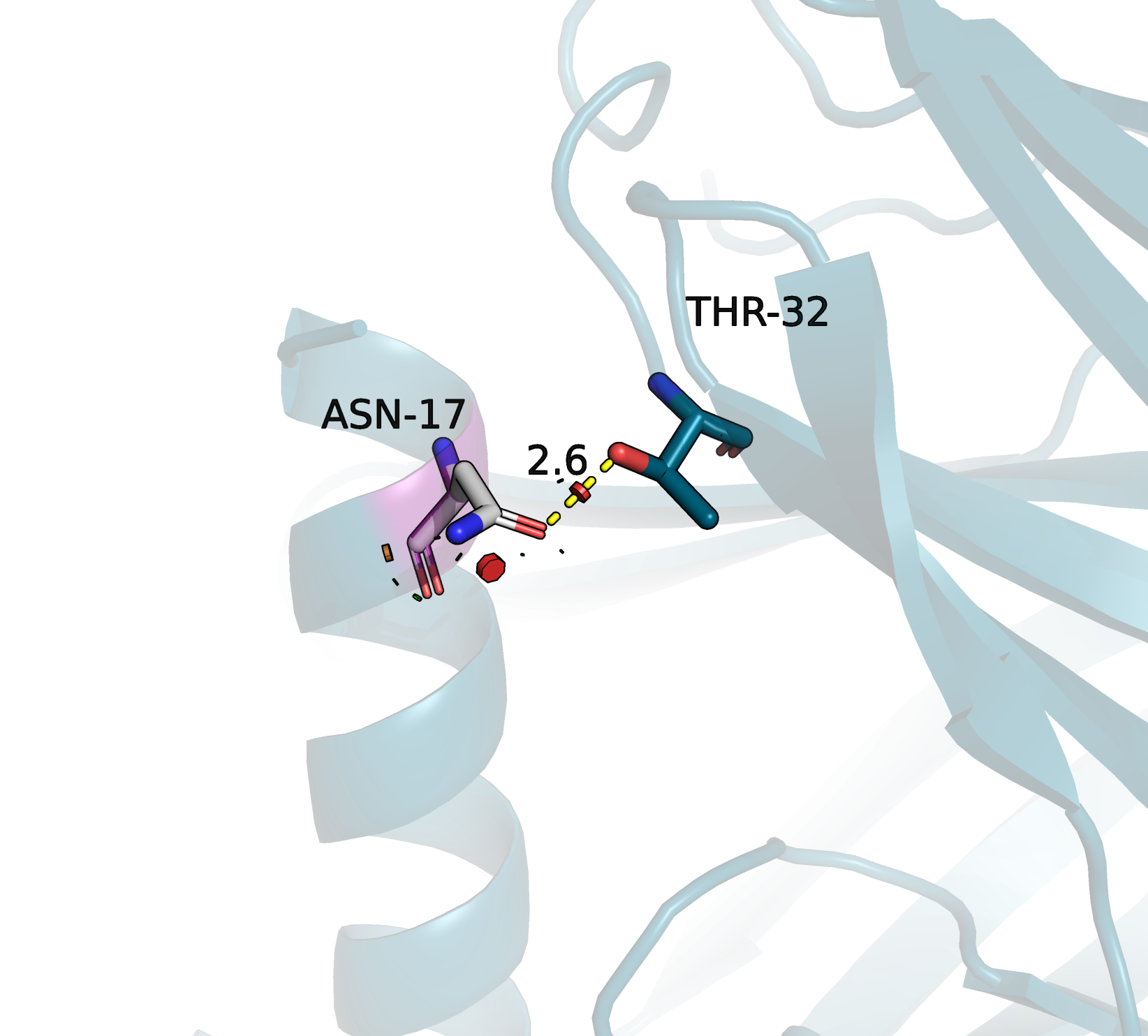
Рассмотрим оставшиеся два варианта.
| Остаток | Ротамер | Напряжённость | Процент встречаемости | |
|---|---|---|---|---|
| 1 | Asp | 3/7 | 20.08 | 8.4 |
| 2 | Asn | 3/11 | 20.42 | 9.7 |
На рисунках видно, что положение остатков и расстояния между взаимоействующими атомами отличается минимально. К тому же, напряженности и встречаемости остатков тоже очень похожи. В этой ситуации я бы выбрала аспартат, потому что, так как при нормальных условиях группа -C(O)O- депротонирована, ее электронная плотность захватывает больше пространства, чем группа -C(O)NH2, и сможет образовать более сильную связь с учетом неидеального расположения взаимодействующих групп.
© Антоненкова Юлия, 2017