О себе |
I семестр |
II семестр |
III семестр |
VII семестр |
Сайт ФББ
Разметка вторичной структуры
Задание 1. Знакомство с укладками
Для этого практикума были выданы 10 pdb-записей структур белков, имеющих не более
40% попарного сходства. После выравнивания с помощью команды super они выглядят так (два левых рисунка):
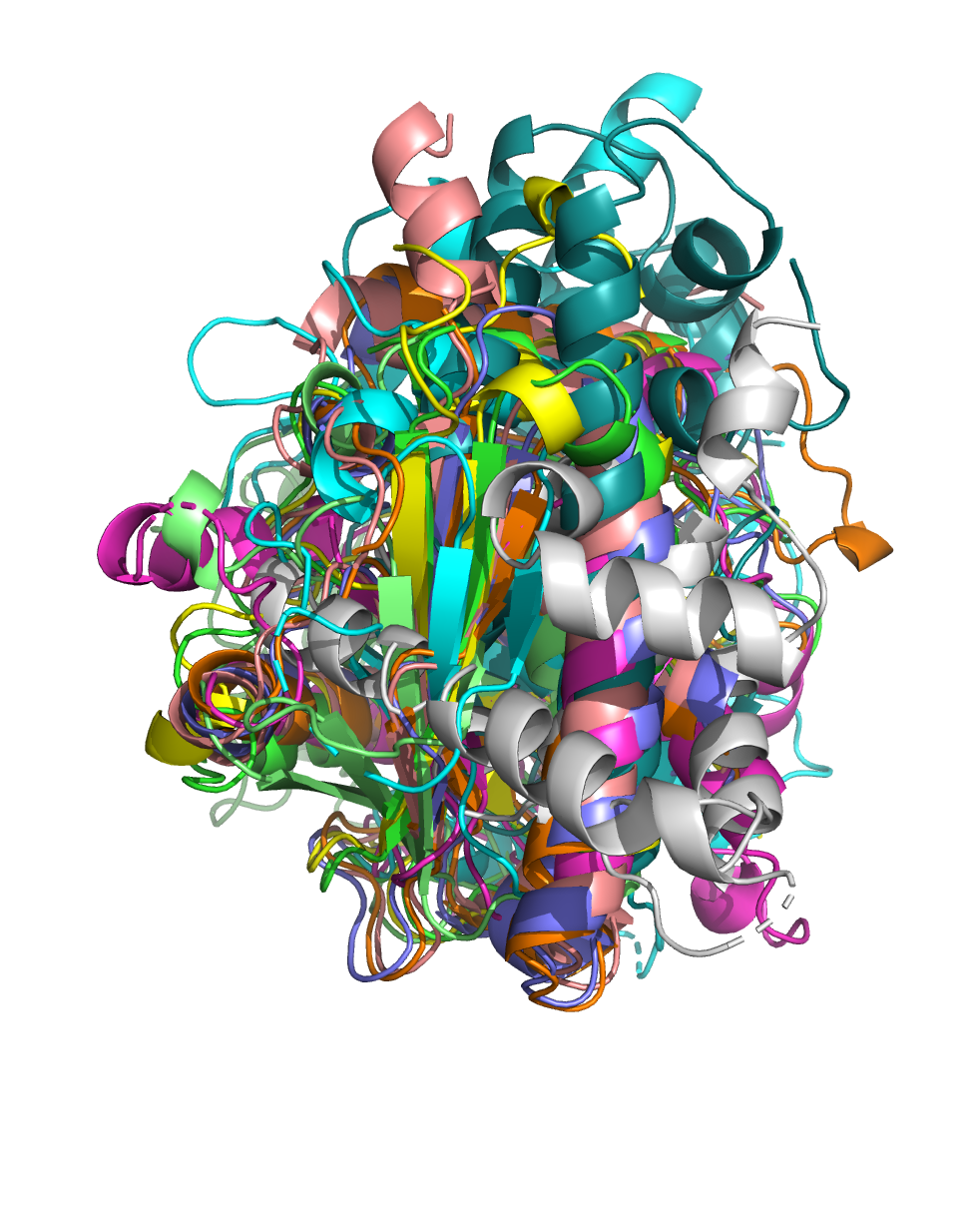
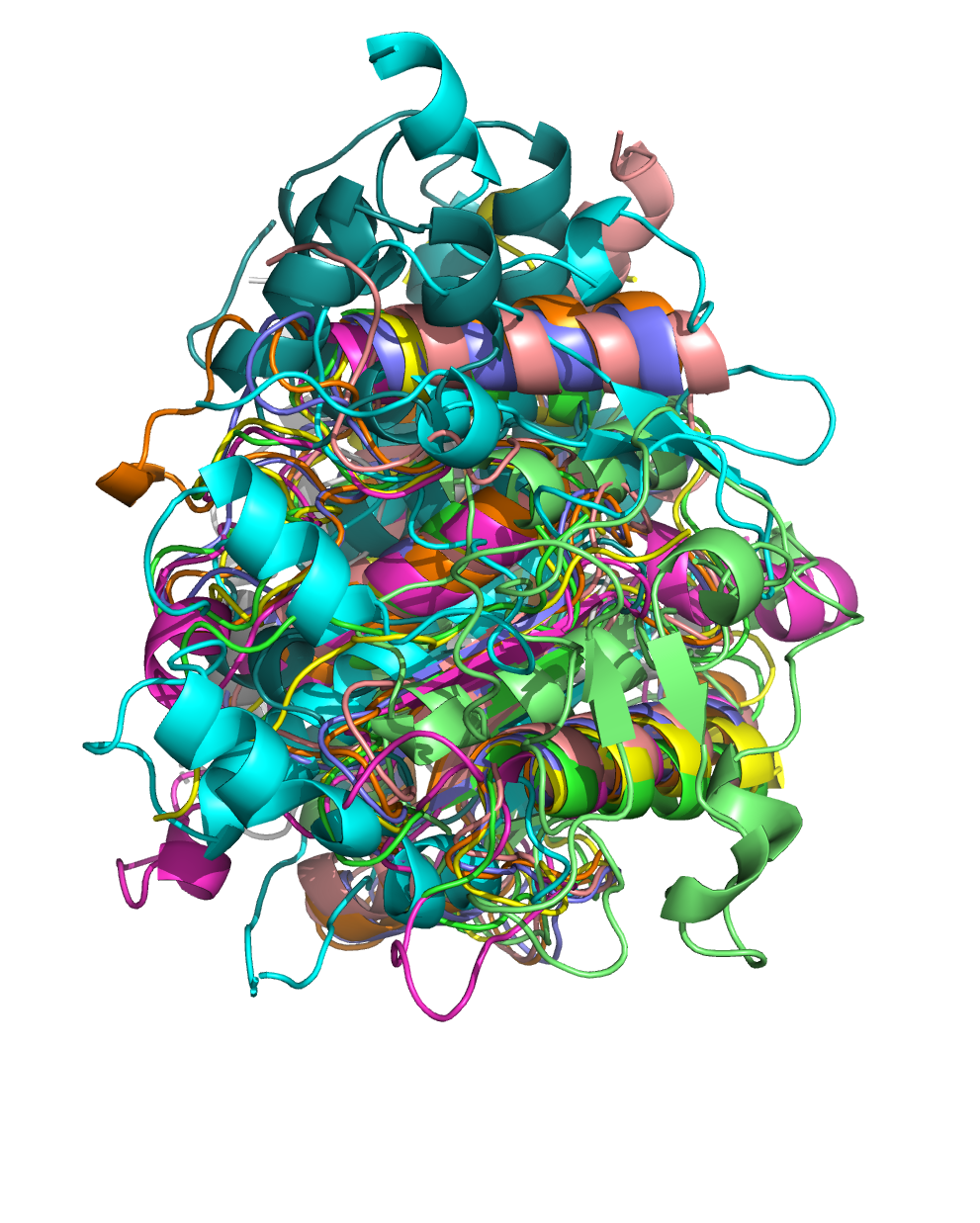
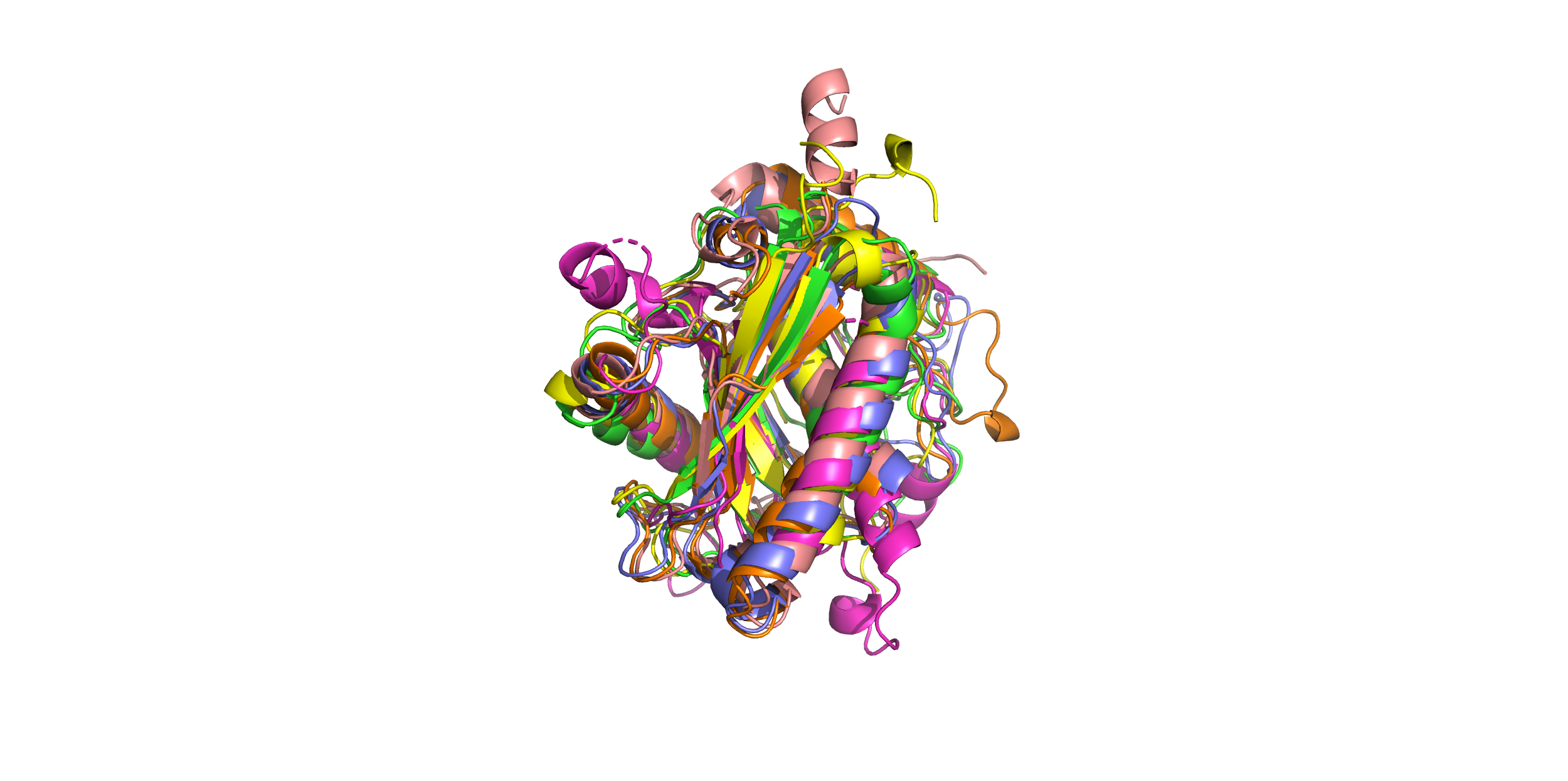
Можно сказать, что эти структуры имеют похожую укладку.
В некоторых структурах
присутствуют довольно большие элементы, которых нет в других структурах, например на
левом рисунке есть несколько серых спиралей, а на среднем - несколько небольших голубых
спиралей. Тем не менее, некоторые элементы присутствуют почти у всех структур: например,
на левом рисунке видно бета-лист, а на среднем - альфа-спирали внизу белка и посередине,
немного вглубине. Но общий вид портят только 4 структуры, которые явно отличаются от
всех остальных. На правом рисунке оставлены другие 6 структур. Они выравниваются гораздо лучше.
Задание 2. Работа с разметкой вторичной структуры в ручном режиме
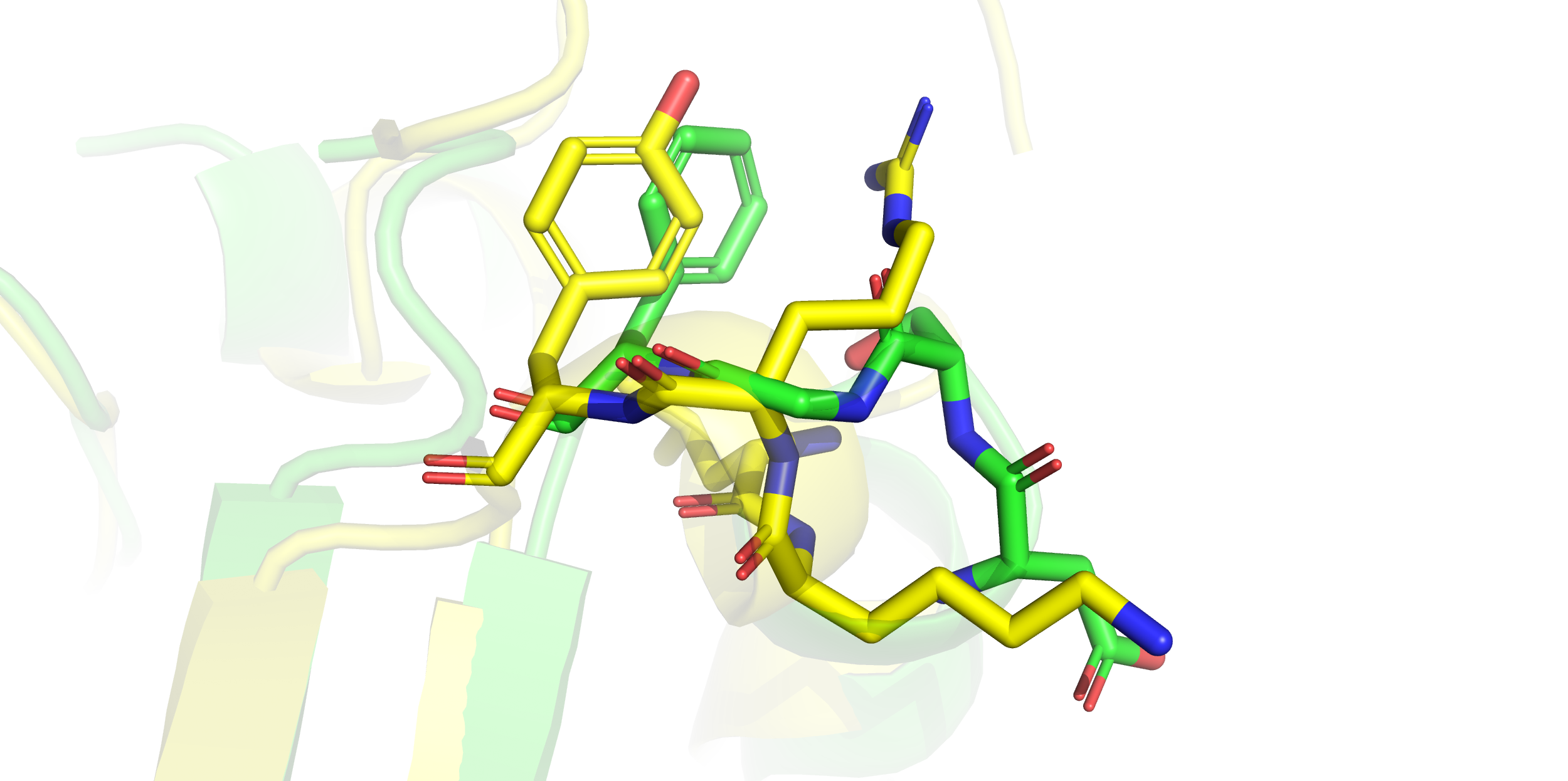
Здесь надо было сравнить вторичную структуру каких-нибудь двух моделей и выявить различия. Я
нашла участок (выделен в круг на левой картинке), где одна последовательность (желтая) находится
в виде альфа-спирали, а другая (зеленая) - не имеет вторичной структуры, хотя проходит примерно там же.
При более детальном рассмотрении (правая картинка) видно, что остов зеленой структуры делает
изгиб и не может образовать спирали, в отличие от желтой, поэтому в этом случае различия обоснованы.
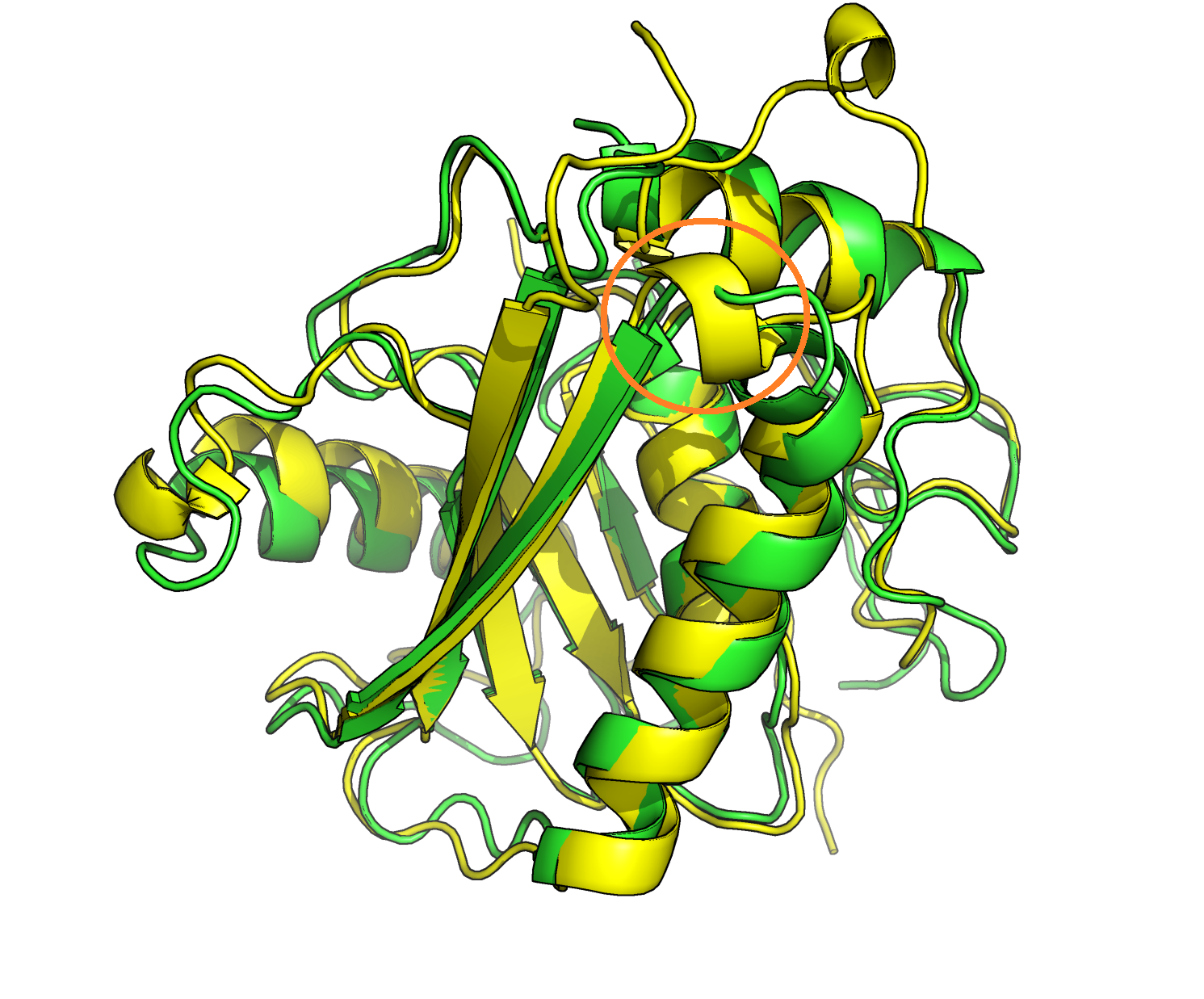
Задание 3. Работа с разметкой вторичной структуры в автоматическом режиме
В этом задании мы рассмотрим склонности каждого типа аминокислоты образовывать
тот или иной тип вторичной структуры (amino acid secondary structure propensity),
которые рассчитаем по формуле:
P_ik = (n_ik/n_i) / (N_k/N)
Где P_ik это propensity аминокислотного остатка i образовывать тип вторичной структуры k;
n_ik это количество остатков i в датасете, образующих тип вторичной структуры k;
n_i это общее количество остатков i в датасете;
N_k это общее количество остатков, образующих тип вторичной структуры j во всем датасете;
N это общее количество остатков в датасете.
В таблице представлены расчеты, проведенные с помощью python
(ipynb notebook).
В расчетах использована dssp разметка
10-ти структур, использовавшихся в предыдущих заданиях.
| Residue | P_iH | P_iE | P_iC |
| G | 0.64 | 0.65 | 1.32 |
| L | 1.45 | 1.09 | 0.74 |
| Y | 0.86 | 1.12 | 1.03 |
| S | 1.09 | 0.57 | 1.12 |
| E | 1.65 | 0.45 | 0.88 |
| Q | 1.64 | 1.03 | 0.66 |
| D | 0.95 | 0.25 | 1.32 |
| N | 0.94 | 0.28 | 1.31 |
| F | 1.07 | 0.89 | 1.01 |
| A | 1.5 | 0.72 | 0.85 |
| K | 1.21 | 0.48 | 1.1 |
| R | 1.5 | 0.4 | 0.98 |
| H | 2.05 | 0.24 | 0.77 |
| C | 0.79 | 0.26 | 1.4 |
| V | 1.17 | 1.48 | 0.73 |
| P | 0.52 | 0.18 | 1.56 |
| W | 1.34 | 0.58 | 0.99 |
| I | 1.39 | 1.59 | 0.57 |
| M | 1.91 | 0.36 | 0.79 |
| T | 1.0 | 1.0 | 1.0 |
Видно, что:
гистидин заметно чаще образует альфа-спирали, чем бета-листы и петли;
изолейцин заметно чаще образует бета-листы, чем альфа-спирали и петли
(это гидрофобная а.к., поэтому для него не выгодно находиться в петлях,
которые в основном находятся на поверхности белка; изолейцин может образовывать
водородные связи только атомами остова, поэтому менее предпочтительны спирали,
для него остаются предпочтительными бета-листы);
пролин заметно чаще образует петли, чем альфа-спирали и бета-листы
(не может образовывать водородные связи боковой группой: нет электроотрицательных атомов;
нет водорода на азоте остова, поэтому в водородных связях остова пролин может быть
только акцептором водорода, но не донором, поэтому взаимодействия образуются реже, что
нейтрально для петель и скорее плохо для спиралей и листов).
© Антоненкова Юлия, 2017




