|
|
Внутримолекулярные взаимодействия боковых цепей
Ⅰ. Солевые мостики
.pdb.jpg)
Рис. 1. Все солевые мостики.
|
Солевой мостик - электростатическая связь между заряженными аминокислотными остатками, длина
которой не превышает 3.5 Å.
Чтобы найти все такие связи, я загрузила скрипт,объединяющий остатки аминокислот в их
функциональные группы, и выполнила команду:
select within(GROUP,within(3.5, hbpositive) and hbnegative) or
within(GROUP,within(3.5, hbnegative) and hbpositive)
Связей нашлось очень много (2981 атом), посчитать их вручную сложно, поэтому для подсчета я
выделила сначала все остатки аспарагиновой кислоты (получилось 864 атома) и покрасила их в белый,
а затем все остатки глутаминовой кислоты (получилось 495 атомов) и покрасила их в розовый.
Заметим, что в каждой паре остатков есть
либо первая, либо вторая, так как других отрицательно заряженных остатков нет. Тогда всего
мостиков получается: 864/8 + 495/9 = 163.
|
.pdb.jpg)
Рис. 2. Солевой мостик.
|
На рисунке слева можно увидеть изображение одного из солевых мостиков моего белка между атомами
глутаминовой кислоты и аргинина.
Я померила расстояние между ближайшими атомами кислорода и азота, несущими заряд. Оно оказалось
равно 0.277нм = 2.77Å < 3.5Å, так что нам вполне подходит.
|
Ⅱ. Водородные связи.
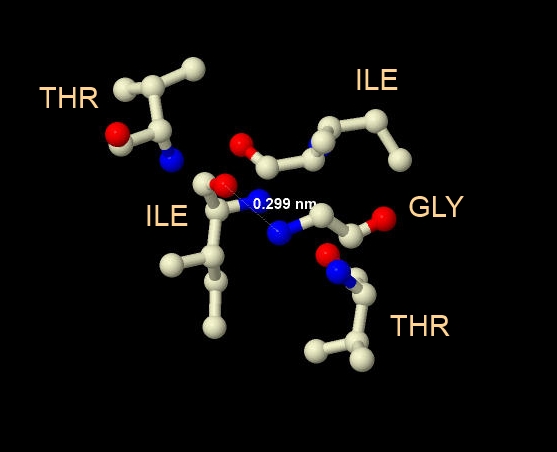
Рис. 3. Возможные водородные связи.
|
Поиск находящихся рядом доноров и акцепторов протонов выявил в моем белке по такой группе,
как на рисунке слева, в каждой цепи. Синим помечены доноры протонов (N), а красным - акцепторы (O).
Я отметила расстояние между возможным донором и акцептором. Оно оказалось
равно 0.299нм = 2.99Å < 3.3Å, так что нам вполне подходит.
|
Ⅲ. Дисульфидные мостики.
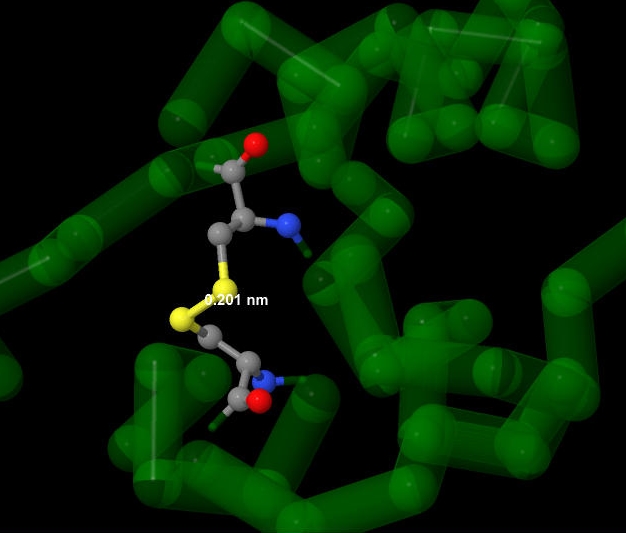
Рис. 4. Дисульфидный мостик.
|
В моем белке дисульфидных мостиков не оказалось, несмотря на большое число цистеинов в нем,
поэтому я рассмотрела дисульфидный мостик на примере инсулина. На рисунке слева один из таких
мостиков между атомом серы цистеина из цепи А и атомом серы цистеина из цепи В. В инсулине
дисульфидные мостики являются структурообразующими.
Я померила длину S-S связи, она оказалась равна 0.201нм = 2.01Å, что близко к норме (2Å).
Угол CSS 103°.
|
|
.pdb.jpg)
.pdb.jpg)

