|
|
Мембранные белки
Задание 1.
Нужно было с помощью базы данных OPM определить положение в мембране выданного белка (4ruf) с трансмембранной частью из
α-спиралей, а так же найти еще один, но с β-бочкой (я выбрала 2lhf). На рис 1 -- первый, на рис 2 -- второй.
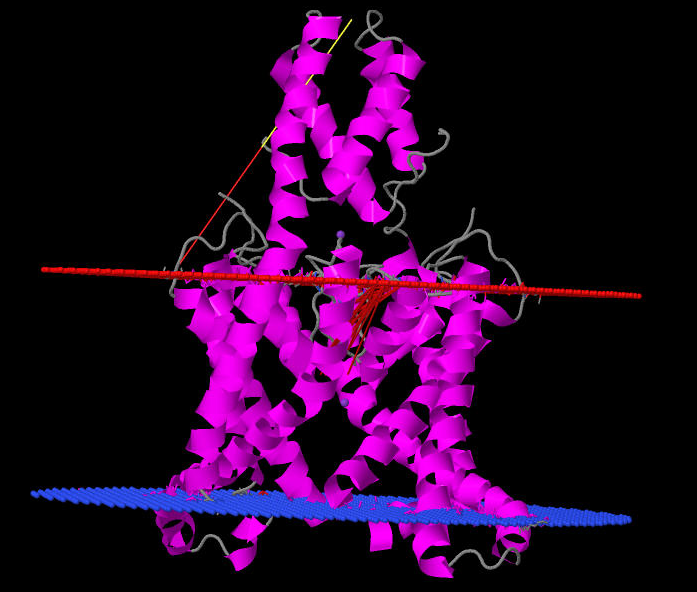
Рис 1. Структура трансмембранного белка с α-спиралями (4ruf).
|
На рис 1 калиевый канал мембраны эукариотической клетки (человеческой). Толщина мембранного слоя в этом месте составляет
31.8 ± 0.8 Å. Аминокислоты, принадлежащие трансмембранным участкам, принадлежат субъединицам A и B. В субъединице
А это сегменты: 1(30-53), 2(142-176), 3(196-218), 4(255-280). В субъединице B: 1(30-50), 2(141-179), 3(195-218), 4(255-280).
|

Рис 2. Структура трансмембранного белка с β-бочкой (2lhf).
|
На рис 2 мембранный белок H (OprH) грам-отрицательных бактерий. Толщина мембранного слоя в этом месте составляет
20.6 ± 0.6 Å. Аминокислоты, принадлежащие трансмембранным участкам, принадлежат субъединице A. Это сегменты:
1(5-12), 2(41-48), 3(55-60), 4(74-83), 5(91-101), 6(119-130), 7(137-144), 8(170-177).
|
Задание 2.
В базе данных TCBD ни один из выбранных мною белков найден не был, поэтому я сразу перешла к пункту 2.
Задание 3.
Для начала нужно было сделать репрезентативную выборку. Гомологов моего белка нет у бактерий и у архей, так что остаются только
эукариоты. Так как мой белок человеческий, я исключила из поиска тип Chordata. Чтобы нашлось достаточно последовательность в
нужно диапазоне, пришлось сделать три итерации поиска в PSI-BLAST. В итоге нашлось 19 последовательностей, большая часть из
которых -- из разных видов рода Drosophila, 6 из Arabidopsis thaliana и 1 из Caenorhabditis elegans. Делать
дальнейшие итерации бессмысленно, сильно большего разнообразия не появляется, поэтому я оставила эту выборку. Dыравнивание при этом
получилось такое, с которым нельзя работать дальше, высокая консервативность у белков видов рода Drosophila, далеких от моего.
Поэтому я вернулась к исходной выборкой и пренебрегла ограничением по e-value. Не взяла малиновые (первые три) и с низкой
консервативностью (e-value > 0,0001). Получилось 14 гомологов с приличным разнообразием.
Затем я построила выравнивание с помощью Muscle. Выравнивание я открыла в Jaiview, прикрепила к исходному белку
его структуру (рис 3), отметила в строке "TM_REAL" буквой "M" аминокислоты, принадлежащие мембранной части исходного белка.
Затем в строке "TM_PREDICTED" я отметила буквами "М" трансмембранные участки, предсказанные программой TMHMM для его гомолога
с идентификатором Q18120.2.
Можно заметить, что трансмембранные участки располагаются у этих белков в наиболее консервативных участках и сильно пересекаются.
Так же заметно, что внутри мембраны находятся только гидрофобные остатки (оттенки красного и фиолетовый цвета), синие
(гидрофильные) участки появляются только на границе мембраны и вне ее, что так же видно на рис 3. Из нетрансмембранных участков
наиболее консервативными оказваются короткие петли между трансмембранными спиралями, хотя там мало консервативности вообще.
Отдельно можно обратить внимание на "лишнюю" трансмембранную спираль, предсказанную в TMHMM. Это действительно практически
гидрофобный участок.
Ссылка на проект тут. Порог для "Above Identity Threshold"
я выбрала в 30%, покрашены аминокислоты системой "Hydrophobicity"
(цвета от красного к голубому переходят от самых гидрофобных к самым гидрофильным, фиолетовый промежуточный можно относить к
гидрофобным, так как ароматика компенсирует заряженную OH-группу).
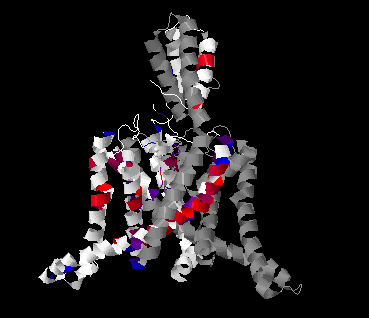
Рис 3. Трансмембранный белок 4RUF. Цветом выделена субъединица А, белым показаны неконсервативные участки, цветом - консервативные,
покрашенные в соответствии с гидродобностью.
|


