|
|
Интерпретация ЯМР структуры
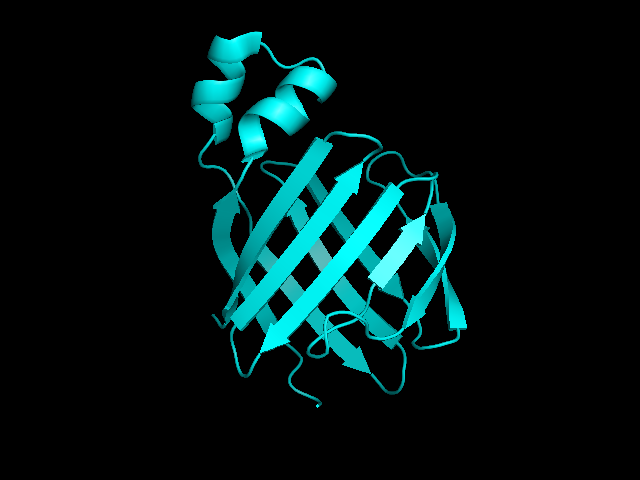
Для сравнения методов ЯМР и РСА был выбран белок (apo-LFABP -- белок, связывающий жирные кислоты печени из
Rattus norvegicus ), структура которого была расшифрована обоими этими методами (PDB-код для ЯМР 2JU3,
PDB-код для РСА 1LFO). Для ЯМР структуры представлено 10 моделей, разрешение РСА -- 2,3 Å. Структура
белка была расшифрована с помощью метода ЯМР на 10 лет позже РСА. Укладки обеих структур визуально сходны (рис. 1).
|

|
| Рис. 1. Структура белка apo-LFABP, полученная методом ЯМР (слева) и РСА (справа). |
Далее были выбраны три водородные связи в структуре, полученной методом РСА, для сравнения со структурой ЯМР. В качестве
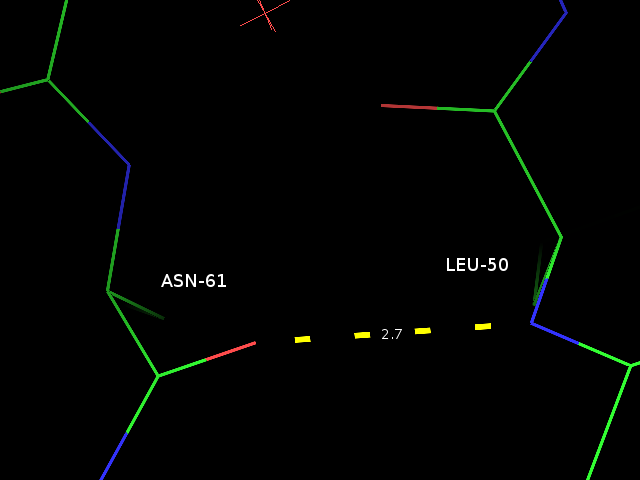
остовной связи в ядре белка была выбрана водородная связь β-листа LEU-50 .... ASN-61. В качестве
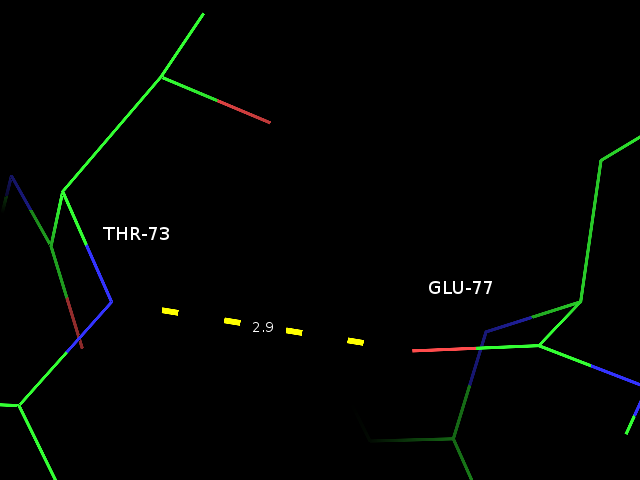
водородной связи в петле на поверхности белка была выбрана THR-73 .... GLU-77. В качестве водородной связи боковых
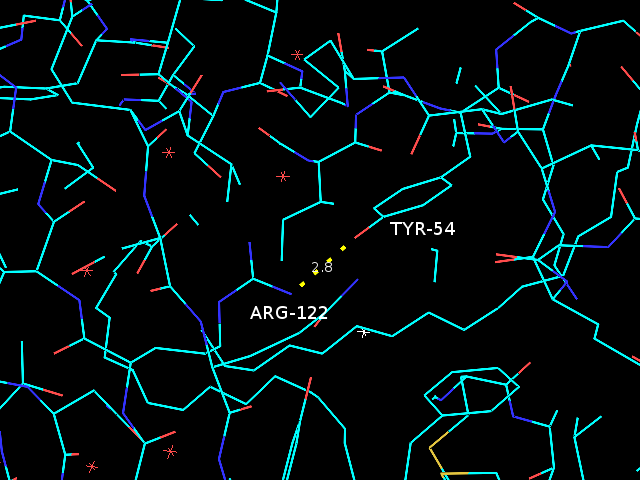
цепей была выбрана TYR-54 .... ARG-122, угол с водородом большой, но меньше 70, так что я решила, что эта связь мне
подойдет (рис. 2). На рис. 2 правый не похоже, что угол меньше 70, но это только ракурс такой. Эта связь напрвлена внутрь
глобулы и располагается близко к связываемому субстрату: жирной кислоте.
|
|
|
| Рис. 2. Выбранные водородные связи в структуре, полученной с помощью РСА. |
В таблице 1 представлены данные по выбранным водородным связям в структуре, расшифрованной с помощью ЯМР и сравнение со
структурой РСА.
Таблица 1. Данные по выбранным водородным связям.
| Водородная связь |
Положение связи |
Длина в РСА |
Процент структур ЯМР |
Минимальная длина в ЯМР |
Максимальная длина в ЯМР |
Медиана длины в ЯМР |
| LEU-50 .... ASN-61 |
остовная в β-листе |
2.7 |
100 |
2.7 |
2.8 |
2.7 |
| THR-73 .... GLU-77 |
остовная в петле на поверхности глобулы |
2.9 |
70 |
2.8 |
3.2 |
3.1 |
| TYR-54 .... ARG-122 |
боковые радикалы |
2.8 |
60 |
2.9 |
3.4 |
3.1 |
Из преведенного анализа можно сделать вывод, что данные РСА и ЯМР хорошо согласуются по остовным водородным связям, формирующим
структурные единицы белка: β-листы и α-спирали. Это можно объяснить тем, что в нативном белке эта связь действительно
имеется, а расстояние между соответствующими атомами жестко фиксируется соседними водородными связями. Хуже дела обстоят с
водородной связью в петле. В данном случае она одиночная, поэтому не работает фиксация соседними связями, и, если существует
в нативном белке, поддерживает правильный изгиб петли, но могла образоваться и от случайного сближения атомов при
кристаллографии. Эта петля не просто соединяет цепи β-листа, а еще и является, возможно, частью активного центра, что
накладывает на нее некоторые ограничения. Это объясняет достаточно высокий процент структур ЯМР, ее одержащих. Водородная
связь между боковыми радикалами в данном случае подчиняется рассуждениям относительно водородной связи в петле, но колебания
радикалов выше колебания остовов, поэтому процент несколько ниже. Перед тем, как выбрать эту связь между радикалами, я выбрала
другую, где соответствующий процент был равен 0. Это было случайное сближение радикалов при кристаллографии, его нет в нативном
белке.
|




