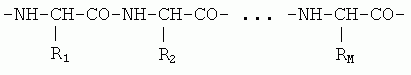Белки — и
молекулярные машины, и строительные блоки, и оружие живой клетки. Важнейшая и
почти монопольная функция белков — ферментативный катализ
химических превращений в клетке и вокруг нее. Кроме того, белки-регуляторы
контролируют экспрессию генов, а рецепторные белки (они сидят в липидной
мембране) обеспечивают восприятие межклеточных сигналов, часто передаваемых
гормонами (тоже белками). Иммунные белки и сходные с ними белки
гистосовместимости опознают и связывают "чужие" молекулы, а также "свои"
клетки — что и позволяет им (клеткам) правильно размещаться в
организме. Структурные белки образуют микрофиламенты, микротрубочки,
— а также фибриллы, волосы, шелк и другие защитные покровы; они армируют
мембраны и поддерживают структуру клеток и тканей. Транспортные белки
переносят (а запасные — запасают) другие молекулы. Белки,
переносящие протоны и электроны через мембрану, обеспечивают всю
биоэнергетику — поглощение света, дыхание, выработку АТФ. Другие
белки, "сжигая" АТФ, обеспечивают механохимическую деятельность, —
они работают в мышцах или перемещают элементы клетки.
При всем разнообразии, работа белков
всегда базируется на высоко специфическом — как у ключа с замком
(точнее: как у гибкого ключа с гибким замком) — взаимодействии
белка с обрабатываемой им молекулой. Для специфического взаимодействия
необходима достаточно "твердая" пространственная структура. Поэтому
биологическая функция белков (как и других важнейших для жизни
макромолекул — ДНК и РНК) тесно связана с определенностью их
трехмерных структур. Не только разрушение — даже небольшие
изменения этих структур часто ведут к утере или резкому изменению активности
белков.
Знание молекулярной
трехмерной структуры белка необходимо для понимания функционирования белковой
молекулы. Поэтому в этих лекциях я буду говорить о физике функционирования
белков лишь в конце, сосредоточившись вначале на их структуре, на природе ее
стабильности и способности к самоорганизации.
В основе белка лежит
полимер — состоящая из аминокислотных остатков полипептидная
цепь; это было установлено Э.Фишером в начале века. В начале 50-х годов Сэнгер
показал, что белковая цепь имеет уникальную последовательность звеньев
— аминокислотных остатков ("остаток" — это то, что осталось
от свободной аминокислоты после ее встраивания в белковую цепь). Эта цепь
имеет химически регулярный остов ("главную цепь"), от которого отходят
разнообразные боковые группы аминокислот — радикалы R
1, R
2, ..., R
M
Есть
двадцать основных аминокислотных остатков. Их положение в белковой цепи
кодируется генами. Однако последующая модификация белка иногда увеличивает
разнообразие аминокислот. Кроме того, в некоторые белки включаются разные
кофакторы — малые молекулы, ионы, сахара, нуклеотиды, фрагменты
нуклеиновых кислот и т.д. В ряде случаев они ковалентно пришиваются к
определенным точкам цепи белка, но часто и просто специфически "прилипают" к
белку.
В "работающем" белке его цепь
свернута строго определенным образом. В конце 50-х Перутц и Кендрью
расшифровали пространственное строение первых белков и показали высокую
сложность и уникальность их строения. Впервые же (как потом выяснилось!)
строгую определенность строения белковых молекул фактически доказал еще в 60-х
годах прошлого века Хоппе-Зейлер, получив кристаллы гемоглобина: ведь в
кристаллах каждый атом каждой молекулы знает свое место.
Вопрос о том, одинакова ли структура
белка в кристалле и в растворе, обсуждался долгие годы, пока ЯМР не показал,
что обычно она практически (с точностью до флуктуаций) одна и та же.
Белки "живут" в разном окружении,
и их структура несет на себе явную печать этого окружения. Чем меньше воды
вокруг белка, — тем невосполнимее разрыв мощных водородных связей,
стягивающих его цепь, тем ценнее для белка эти связи (а именно они крепят
структуру остова белковой молекулы), тем регулярнее вынуждена быть стабильная
структура белка.
Грубо говоря, по
"жизненным условиям" и общему типу строения белки можно разбить на три класса.
1) Фибриллярные белки образуют
огромные агрегаты; их структура высоко регулярна и держится в основном
взаимодействиями между разными цепями.
2) Мембранные белки "живут" в
мембране, где нет воды, но части их выступают из мембраны в воду.
Внутримембранные части таких белков — как и фибриллярные
белки — высоко регулярны и прошиты водородными связями, но размер
этих регулярных частей ограничен толщиной мембраны.
3) Водорастворимые, живущие в
воде глобулярные белки наименее регулярны (особенно небольшие); их структура
держится взаимодействиями белковой цепи с самой собой, причем особенно важны
взаимодействия далеких по цепи, но сблизившихся в пространстве углеводородных
(гидрофобных — "боящихся воды") групп, а также взаимодействиями
белковой цепи с кофакторами.
Наконец,
небольшие или бедные углеводородными группами полипептиды могут сами по себе
не иметь фиксированной структуры, но приобретать ее при взаимодействии с
другими макромолекулами.
Конечно,
намеченное выше деление очень грубо. Порой белок может состоять из
фибриллярного "хвоста" и глобулярной "головки" (так устроен, например,
миозин), и так далее.
Уже
известны сотни тысяч белковых аминокислотных последовательностей (для их
хранения созданы специальные компьютерные банки — например,
SwissProt) и тысячи
пространственных структур белков (они хранятся в компьютерном Банке Белковых
Структур.). Подавляющая часть того, что мы знаем о трехмерных белковых
структурах, относится к водорастворимым глобулярным белкам. Для мембранных же
и фибриллярных белков расшифрованы лишь считанные пространственные структуры
или отдельные фрагменты. Причина проста: водорастворимые белки легче выделять
в виде отдельных молекул и их структуру легче изучать и рентгеном
— в кристаллах, и спектроскопией ЯМР (ядерного магнитного
резонанса) — в растворах. Поэтому, говоря о "структуре белка",
"формировании структуры белка" и т.д. — часто, на самом деле,
имеют в виду закономерности, доказанные лишь для водорастворимых глобулярных
белков. Это надо иметь в виду, читая книги и статьи.
Нековалентные взаимодействия,
поддерживающие пространственное строение белка, значительно слабее химических
связей, фиксирующих последовательность мономеров —
аминокислот — в белковой цепи. Эта последовательность
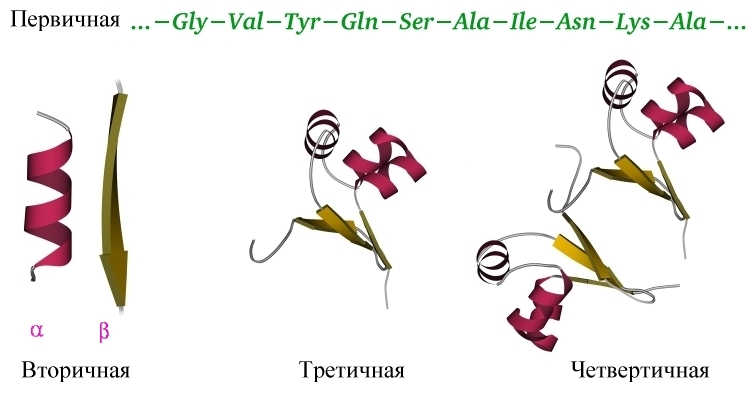
— она называется "первичной структурой белка" (Рис.1-1) —
создается в ходе матричного биохимического синтеза согласно "инструкции",
записанной в гене.
Архитектуры
белков, особенно глобулярных водорастворимых белков, сложны и
разнообразны — в противоположность универсальности двойной спирали
ДНК (одноцепочечные РНК здесь как бы занимают промежуточное положение). Однако
и в белках прослеживается набор "стандартных" структур, о которых мы будем
говорить весьма подробно.
Прежде
всего здесь речь идет о регулярных вторичных структурах белка — об
a-спирали и
b-структуре;
a-спирали часто изображаются цилиндрами, а вытянутые
b-структурные участки (слипаясь, они образуют
листы) — стрелками, см. Рис.1-1 и 1-2. Вторичные структуры
отличаются регулярной, периодической формой (или, как говорят, "конформацией")
главной цепи, — при разнообразии конформаций боковых групп.
Укладка вторичных структур одной
полипептидной цепи в глобулу называется третичной структурой (Рис.1-1).
Объединение же нескольких белковых цепей в "суперглобулу" называется
четвертичной структурой белка (Рис.1-1). Пример (в дополнение к приведенному
на Рис.1-1 димеру белка
cro репрессора): гемоглобин состоит из двух
b и двух
a цепей (к
a- и
b-структурам это
никакого
отношения не имеет!). Если четвертичная структура белка сложена из
одинаковых цепей, то она обычно симметрична (и
cro репрессор, и
гемоглобин здесь не исключение).
Среди третичных структур есть наиболее типичные, с которыми нам предстоит еще
познакомиться. Часто такие типичные структуры охватывают не весь глобулярный
белок целиком, а лишь его компактную субглобулу — "домен"
(Рис.1-2).
Образование трехмерной
структуры белка
in vivo происходит при биосинтезе или сразу после него.
Замечательно, однако, что оно может происходить не только при биосинтезе: 35
лет назад Анфинсен показал, что оно может идти и при "ренатурации"
— сворачивании чем-то развернутой белковой цепи
in vitro; причем
идти совершенно спонтанно — без помощи других макромолекул.
Это значит, что аминокислотная
последовательность сама (при подходящей температуре и рН воды!) определяет
пространственную структуру белка — т.е. белок способен к
самоорганизации.
Опыты
Анфинсена принципиально отделили физический процесс —
самоорганизацию пространственной структуры — от биохимического
синтеза белковой цепи. Стало ясно, что структура белка детерминирована самой
его аминокислотной последовательностью, а не навязывается белку клеточной
машинерией. По-видимому, основная задача этой машинерии —
оберегать сворачивающийся белок от нежелательных контактов (к коим относятся и
контакты между отдаленными, образующими разные домены кусками цепи очень
больших белков) — ведь
in vivo белок сворачивается в
клеточном бульоне, где так много разных молекул, так много возможностей
прилипнуть к чему-нибудь! Но в разбавленном растворе
in vitro
белок — по крайней мере, не очень большой —
складывается спонтанно, сам по себе.
Строго говоря, белок способен к
спонтанной самоорганизации и ренатурации, только если он не подвергся сильной
пост-трансляционной модификации — т.е. если его химическая
структура не была сильно нарушена после биосинтеза. Например, инсулин (где
половина цепи вырезается уже после того, как он свернулся) не способен к
ренатурации.
Пост-трансляционные
модификации бывают самые разные. Как правило, химические модификации
контролируются специальными ферментами, а не "самоорганизуются" в самом белке.
Кроме расщепления белковой цепи (протеолиза: он часто способствует превращению
зимогена в активный энзим), наблюдается модификация концов цепи,
ацетилирование, гликозилирование, пришивание липидов в определенные точки
цепи, фосфорилирование определенных боковых групп, и т.д., и т.п. Недавно был
обнаружен даже "сплайсинг" белковых цепей (спонтанное вырезание куска цепи и
склейка образовавшихся при этом концов). Изредка наблюдается и спонтанная
циклизация кусочков белковой цепи.
Особо надо отметить завязывание S-S связей между серусодержащими остатками
цистеина белковой цепи: "правильные" S-S способны (в подходящих условиях
in
vitro) к спонтанной самоорганизации, хотя
in vivo их образование
катализируется специальным ферментом, дисульфидизомеразой. Как правило, эти
связи завязываются только в секретированных белках (внутри клетки нет
кислорода, и потому — неподходящий окислительный потенциал); при
этом правильно завязанные S-S связи отнюдь не мешают, а скорее способствуют
ренатурации белка.
Итак,
аминокислотная последовательность определяет пространственную структуру белка,
а структура эта уже определяет его функцию, — т.е. с кем этот
белок взаимодействует и что при этом делает. Но, сказав это, надо иметь в виду
масштабы. Если обрабатываемая молекула велика — с ней может
взаимодействовать весь белок, и тогда вся его форма важна для его функции.
Если же обрабатываемая белком молекула мала, то именно мелкомасштабные детали
небольшого участка поверхности белка определяют его функцию, а остальное его
тело лишь фиксирует эти критически важные детали. Так или иначе, специфичность
белка подразумевает его твердость.
Здесь необходимо сделать несколько замечаний.
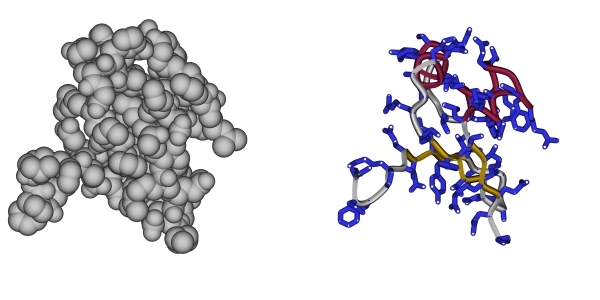
Первое. Глядя на Рис. 1-1, можно
подумать, что внутри белка много пустого пространства и, следовательно, что он
"мягок". На самом деле это вовсе не так! Белок тверд — белковая
цепь упакована плотно, атомы упираются в атомы (см. левую часть Рис.1-3). Но
вот только анатомию белка, его скелет, его внутренне строение неудобно изучать
на полной атомной модели — внутреннее устройство белка можно
увидеть, лишь сделав атомы "прозрачными" и обратив основное внимание на ход
белковой цепи (см. правую часть Рис.1-3 и, в особенности, Рис.1-1, 1-2, где
боковые группы "сбриты", а элементы вторичной структуры —
выделены). На полноатомной же модели белка (Рис.1-3) даже не видно, что белок
образован полимерной цепью, — видна лишь поверхность глобулы,
похожая на картофелину. Однако полноатомная модель нужна для изучения функции
белка — специфику его работы определяют именно физико-химические и
геометрические свойства поверхности глобулы, этой "картофелины", а дело
скелета белка — создать и фиксировать эту поверхность.
Второе. В состав белка —
помимо самой белковой цепи
- часто входят
кофакторы (Рис.1-4), т.е. относительно небольшие молекулы, принимающие
участие в функционировании, а порой и в формировании структуры белковой
молекулы. Эти кофакторы могут присоединяться к белку химическими связями, а
могут просто прилипать к определенным местам белковой глобулы.
Третье. Твердый белок
("апериодический кристалл", говоря словами Шредингера) ведет себя именно как
кристалл при изменении внешних условий (например, при повышении
температуры), — то есть он "терпит" до каких-то пор, а потом разом
плавится, — а не теряет своей формы и твердости постепенно, как
стекло. Это фундаментальное свойство белков тесно связано с надежностью их
работы: как электрическая лампочка, белки ломаются по принципу "все или
ничего", а не постепенно (последнее привело бы к ненадежности их
действия — к расплыванию специфичности и т.д.).
И последнее. Говоря о твердости, надо
различать сравнительно небольшие и действительно твердые однодоменные белки
(они состоят из одной компактной глобулы), — и более крупные
белки, имеющие либо доменную (Рис.1-2), либо четвертичную (Рис.1-1) структуру:
слагающие их субглобулы могут сдвигаться и раздвигаться, а также слегка, как
твердое тело, деформироваться (но не полностью перестраиваться!) при
функционировании белка.
Обычно
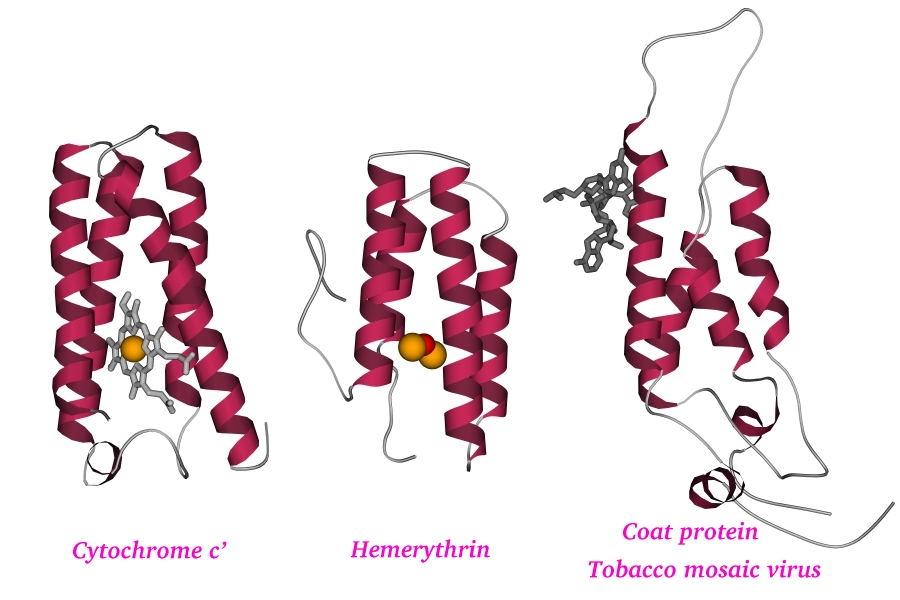
сходные по внутренней структуре (по анатомии) белки делают одно и то же.
Однако порой одна и та же, в общем, пространственная структура может
обеспечивать совсем разные функции. Так, из трех сходных по "грубой"
пространственной структуре белков, — один (цитохром) связывает
электрон, другой (миогемэритрин) связывает кислород (эти функции немного
похожи — обе они включены в цепь окислительных реакций), а третий
(белок облочки вируса) связывает гораздо более крупные молекулы —
РНК, а также другие оболочечные белки (Рис.1-4).
Верно ли обратное, т.е. определяет ли
функция белка его структуру? Здесь тоже прослеживаются некие частные
корреляции, но в общем такое определяющее влияние прослеживается только на
очень грубом уровне, — уровне, определяемом "средой обитания"
белковых функций (так, белки, несущие структурную функцию —
например, те, из которых слагаются волосы или фибриллы — как
правило, фибриллярны; рецепторы — это мембранные белки, и т.д.).
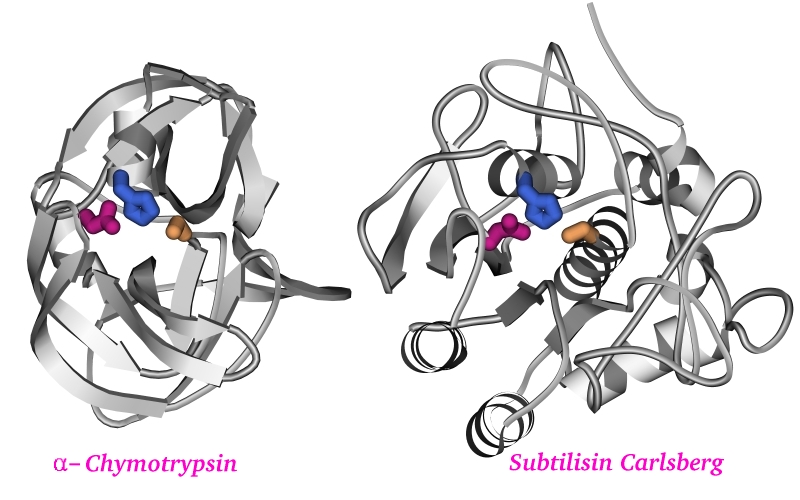
Но часто это совсем неверно на уровне архитектуры белка. Так, две сериновые
протеазы (трипсин и субтилизин) имеют одну и ту же каталитическую функцию и
даже почти одинаковую специфичность — при совершенно разной
(Рис.1-5) внутренней структуре глобул [эти белки сходны не более чем тюлень и
жук-плавунец: лишь их (белков) "плавники", — т.е. их активные
центры, включающие по полудюжине аминокислотных остатков из пары сотен звеньев
цепи, — устроены одинаково, а все остальное —
по-разному].
Однако общим у этого
"всего остального" тела является то, что тело белка — твердое:
иначе нельзя обеспечить специфичность активного центра.
В свое время мы подробно
рассмотрим структуры белков, их способность к самоорганизации и причину их
твердости, обсудим функции и прочие интересные для биолога вопросы,
— но сначала необходимо рассмотреть аминокислотные остатки и их
элементарные взаимодействия между собой и с окружающей средой.
Рис.1-1. Уровни
организации белковой структуры: первичная структкра (аминокислотная
последовательность), вторичная структура (
a-спираль и
один тяж
b-структуры), третичная структура глобулы,
сложенной одной цепью, и четвертичная структура олигомерного (в данном случае
- димерного) белка.
Рис.1-2. Доменная
структура большого белка сходна с четвертичной структурой, сложенной из малых
белков.
Рис.1-3. Атомная модель
белковой глобулы (слева) и ее скелетная модель (справа).
Рис.1-4. Три
сходных по форме, но разных по функции
a-спиральных
белка: цитохром
c', миогемэритрин и белок оболочки вируса табачной
мозаики. Показана как белковая цепь, так и кофакторы: скелетные модели
— гем (в цитохроме) и фрагмент РНК (в белке оболочки вируса), оранжевые
шарики — ионы железа (в геме цитохрома и в миогемэритрине),
красный шарик — связанный железом кислород (в миогемэритрине).
Рис.1-5. Два разных по
форме, но почти идентичных по функции белка (сериновые протеазы): химотрипсин
и субтилизин. Несмотря на кардинальное различие в укладке цепи, их
каталитические центры состоят из одинаковых и одинаково в пространстве
расположенных остатков: Ser195 (оранжевый), His57 (синий) и Asp102 (малиновый)
в химотрипсине, и Ser221 (оранжевый), His64 (синий) и Asp32 (малиновый) в
субтилизине.