Общее описание вторичной структуры:
Мой белок α+&beta, так как в одной полипептидной цепи присутствуют как альфа-спирали, так и бета-тяжи, а периодичность не наблюдается |
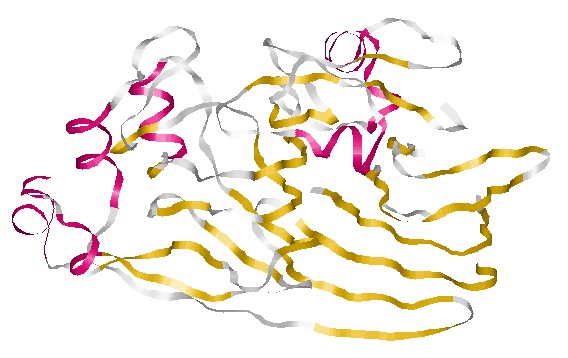 |
Для исследования выбраны следующие элементы вторичной структуры:
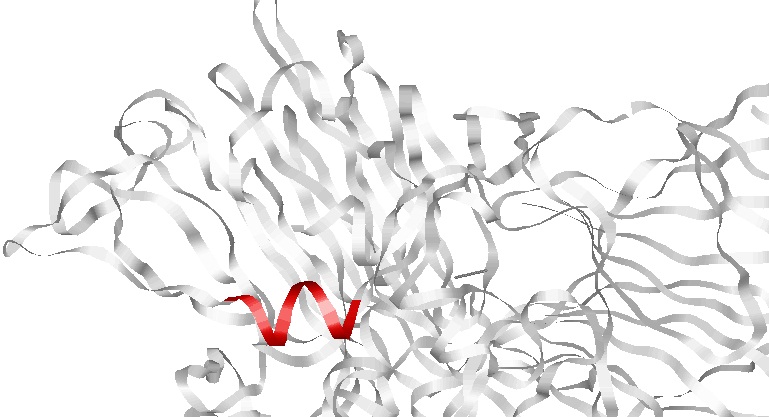
- α-спираль : 60-73 аминокислотные остатки цепи А;
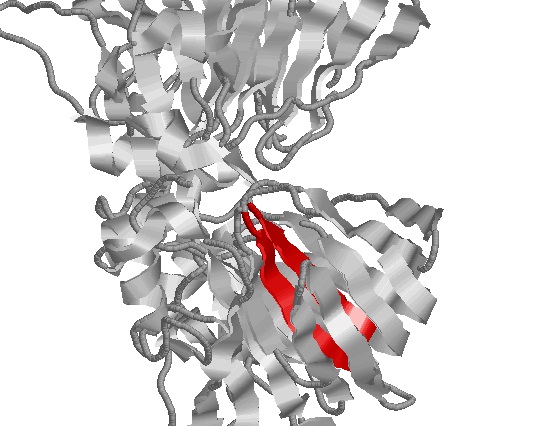
- β -тяжи: антипараллельные – 310-316 и 267-273 аминокислотные остатки цепи А
параллельных бета-тяжей в моем белке нету. - β-поворот: 243-249 аминокислотные остатки цепи А
Альфа-спираль
1)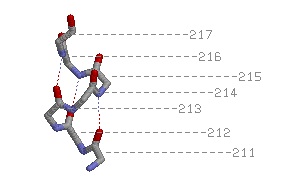 |
2) |
|
Бета-тяжи
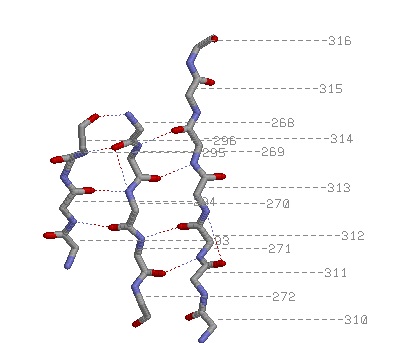
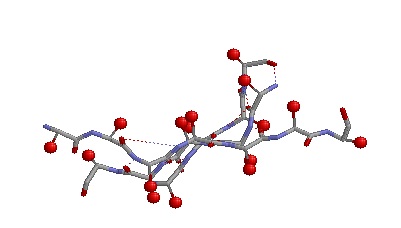
| 1) Антипараллельные бета-тяжи: | |
 |
|
1)
2) 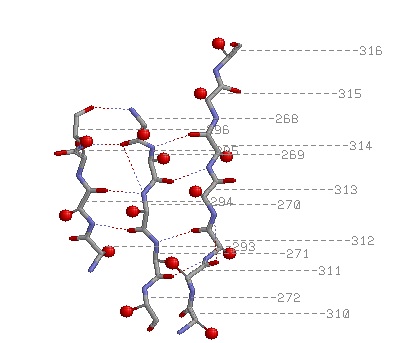 3) 3).jpg)
4) 
|
|
|
|
| 2) Параллельные бета-тяжи:
(Так как в моем белке нет параллельных бета-тяжей, для исследования использовался белок ARGINYL-TRNA SYNTHETASE) |
|
.jpg) |
|
1).jpg) 2)
2).jpg)
3) .jpg)
| |
|
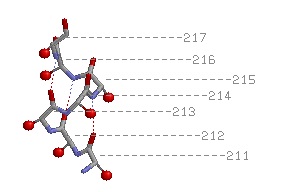
Бета-поворот
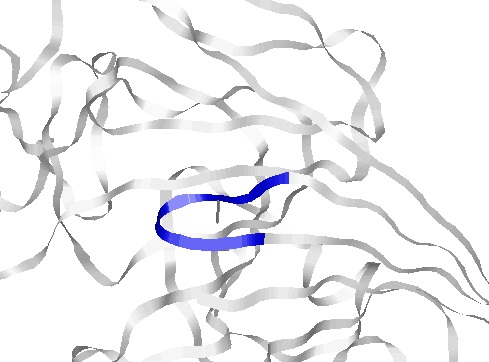
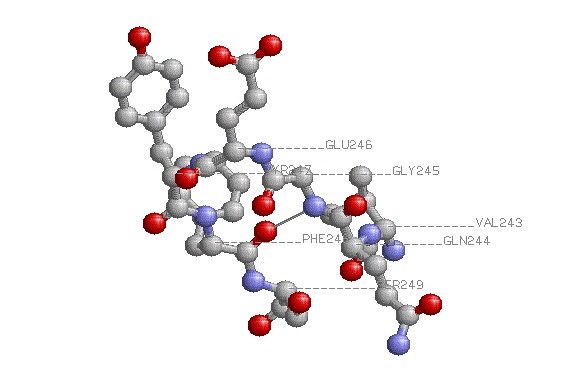 |
Выбранный поворот - Val243Gln244Gly245Gly246Tyr247Phe248Ser249;
На изображении можно увидеть водородную связь, "скрепляющую" поворот |