Задание №4. Сравнение двух белков
| Метка поля | Белок 1 | Белок 2 | |
|---|---|---|---|
| Код(ы) доступа ("Accession number") | AC | P39841 | Q924M7 |
| Идентификатор записи в БД | ID | MANA3_BACSU | MPI_MOUSE |
| Название (краткое описание) белка | DE | RecName:
Full=Putative mannose-6-phosphate isomerase yvyI; EC=5.3.1.8; AltName: Full=Phosphohexomutase; AltName: Full=Phosphomannose isomerase; Short=PMI; |
RecName:
Full=Mannose-6-phosphate isomerase; EC=5.3.1.8; AltName: Full=Phosphohexomutase; AltName: Full=Phosphomannose isomerase; Short=PMI; |
| Дата создания документа | DT | 01-FEB-1995 | 12-APR-2005 |
| Дата последнего исправления аннотации | DT | 30-NOV-2010 (entry version 84) | 08-FEB-2011, (entry version 76) |
| Название организма | OS | Bacillus subtilis | Mus musculus (Mouse) |
| Классификация организма | OC | Bacteria; Firmicutes; Bacillales; Bacillaceae; Bacillus |
Eukaryota;
Metazoa; Chordata; Craniata; Vertebrata; Euteleostomi; Mammalia; Eutheria; Euarchontoglires; Glires; Rodentia; Sciurognathi; Muroidea; Muridae; Murinae; Mus; Mus. |
| Длина последовательности | ID(SQ) | 316AA | 423AA |
| Молекулярная масса белка | SQ | 35428 MW(molecular weight) | 35428 MW |
| Число публикаций, использованных при создании документа | RN | 4 | 2 |
| Журнал и год самой последней публикации | RL | В журнале: Nature (1997)
В базе данных: PDB data bank (JAN-2005) |
Genome Res. 14:2121-2127(2004) |
| Описание вторичной структуры | FT |
STRAND 6 9
STRAND 11 14 HELIX 21 26 STRAND 31 41 TURN 55 58 HELIX 61 67 HELIX 69 72 STRAND 82 91 STRAND 95 97 HELIX 101 107 TURN 108 110 STRAND 116 123 STRAND 128 133 HELIX 138 146 HELIX 150 153 STRAND 154 158 STRAND 164 167 STRAND 173 175 STRAND 177 187 STRAND 192 195 HELIX 211 217 STRAND 230 234 STRAND 237 244 STRAND 249 261 STRAND 268 281 STRAND 284 289 STRAND 293 296 STRAND 303 315 |
Отсутствует* |
| Ключевые слова | KW | 3D-structure; Complete proteome;
Биологический процесс, в котором участвует белок - углеводный метаболический процесс Молекулярная функция - Isomerase; Лиганды - Metal-binding(металл-связывающий); Zinc. |
Биологический процесс, в котором участвет белок - маннозный метаболический процесс
PTM(пострансляционная модификация) - Acetylation(ацетилирование); Находится в цитоплазме; Молекулярная функция - Isomerase; Лиганды - Metal-binding; Zinc |
| Темы, освещенные в комментариях | CC | CATALYTIC ACTIVITY: D-mannose 6-phosphate = D-fructose 6-phosphate.
COFACTOR: Binds 1 zinc ion per subunit (связывает 1 ион цинка на субъеденицу) SIMILARITY: Принадлежит к семейству mannose-6-phosphate isomerase type |
FUNCTION: Участвует в синтезе GDP-mannose и
dolichol-phosphate-mannose, требуется для многих важных реакций
транспорта маннозы (By similarity).
CATALYTIC ACTIVITY: D-mannose 6-phosphate = D-fructose 6- phosphate. COFACTOR: Binds 1 zinc ion per subunit (By similarity). -!- PATHWAY: Биосинтез сахарных нуклеотидов, GDP-alpha-D-mannose; alpha-D-mannose 1-phosphate из D-fructose 6- phosphate: (step 1/2). SUBCELLULAR LOCATION: Cytoplasm. SIMILARITY: Принадлежит к семейству mannose-6-phosphate isomerase |
| Особенности последовательности | FT |
ACT_SITE 193 193 By similarity.
METAL 98 98 Zinc. METAL 116 116 Zinc. METAL 173 173 Zinc. |
ACT_SITE 295 295 By similarity.
METAL 110 110 Zinc (By similarity). METAL 112 112 Zinc (By similarity). METAL 137 137 Zinc (By similarity). METAL 276 276 Zinc (By similarity). |
| Идентификаторы записей PDB | DR | 1QWR | Отсутствует |
*Дополнение: В Uniprot отсутствует описание вторичной структуры белка MPI_MOUSE, однако SWISS-MODEL Repository дает возможность скачать pdb-файл с пространственной структурой (На 2011-02-10 идентифицировано только 36% последовательности). Для сравнения пространственной структуры ниже приведены изображения MANA3_BACSU(справа) и MPI_MOUSE(слева).
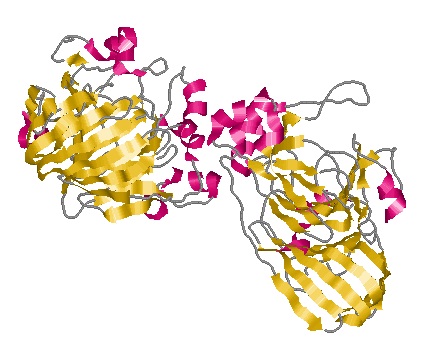
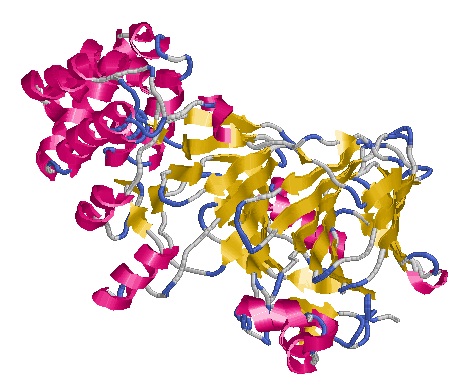
Комментарии к таблице: Два рассмотренных белка выполняют одинаковые молекулярные функции - mannose-6-phosphate isomerase activity и zinc ion binding, однако биологические функции у них разные. Очень велика разница между "хозяинами" белков. Белок№1 находится в организме бактерии, а белок№2 - в организме млекопитающего.