Таблица 1. Описание трансмембранных белков с известной 3D структурой |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDB код | Тип | Число цепей | Число трансмембранных участков в ТМ единице | Число остатков в одном трансмембранном участке | Толщина мембраны в ангстремах | Наклон спиралей/тяжей к нормали | Какая мембрана, организм, "код транспортера", функция белка |
| 1xio | Спираль | 1 | 7 | 17-29(типичное 22) | 31,9 | 13 | Внутренняя мембрана Anabaena sp., 3.E.1, сенсорный белок |
| 3odu | Спираль | 2 | 14 | 19-26(типичное 22) | 31,2 | 0 | Плазмалемма человека 3.E.1, сенсорный белок |
| 1fft | Спираль | 3 | 19 | 7-23(типичное 20) | 29,5 | 12 | Внутренняя мембрана Escherichia coli, 3.D.4, электронный транспорт |
| 3qrc | баррель | 1 | 8 | 8-11(9) | 24,6 | 7 | Внешняя мембрана Yersinia pestis, 1.B.6,клеточный иммунитет |
| 3aeh | баррель | 1 | 12 | 8-12(9) | 25,2 | 4 | Внешняя мембрана Escherichia coli, 1.B.12, Транспортный белок, связывет гемоглобин |
| 3prn | баррель | 3 | 48 | 6-13(9) | 23,2 | 0 | Внутренняя мембрана Rhodopseudomonas blastica, 1.B.7 канальный белок |
Толщина мембраны у эукариот и у грамположительных бактерий примерно одинаковые 27-33 ангстрем. Внутренняя мембрана грамотрицательных бактерий может быть немного толще: до 37 ангстрем; внешняя же наоборот уже: 23-26. Длина трансмембранных участков баррелей примерно в 2 раза меньше, чем у спиралей: 8-11 а.о. против 20-24.
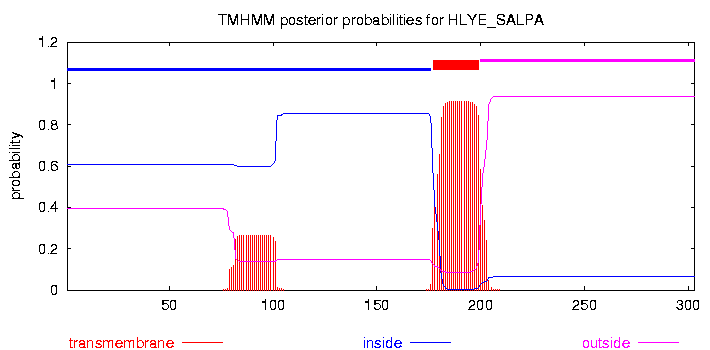
Данный белок Q93RR6, HLYE_SALPA, является токсином, который образует пороподобные структуры в клетках млекопитающих.
По Uniprot содержит 1 трансмембранный участок
# HLYE_SALPA Length: 303
# HLYE_SALPA Number of predicted TMHs: 1
# HLYE_SALPA Exp number of AAs in TMHs: 26.34177
# HLYE_SALPA Exp number, first 60 AAs: 0.00039
# HLYE_SALPA Total prob of N-in: 0.60651
HLYE_SALPA TMHMM2.0 inside 1 176
HLYE_SALPA TMHMM2.0 TMhelix 177 199
HLYE_SALPA TMHMM2.0 outside 200 303

Гомолог с известной структурой - тот же белок, но из Escherichia coli. При выравнивании я взяла лишь одну цепь из PDB-файла, так как они идентичны. Выравнивание jar.
Предсказанные UniProt'ом и TMНMM трасмембранные участки не совпадают полностью ни с друг другом, ни с гомологом. Структура гомолога более сложная, в нем 3 трансмембранных участка. Два из них находятся рядом, поэтому, видимо были предсказаны как один. Участокв начале цепи не был предсказан, возможно, за счет разных последовательностей.