Внутримолекулярные взаимодействия в структуре белка grl4197 (идентификатор PDB 3eam) организма Gloeobacter violaceus штамм PCC 7421
В образовании и поддержании вторичной структуры белка принимают участие различные связи. Рассмотрим некоторые из них на примере белка нипотетического белка grl1497 (идентификатор в базе данных PDB - 3eam).
Остовные водородные связи
Для визуализации вторичной структуры белка использовали программу Jmol. Сначала рассмотрим
альфа-спираль. Водородные связи соединяют СО-группы с лежащими от них в направлении С-конца NH-группами. Типичная водородная связь образуется
между атомом водорода (донор), ковалентно связаным с атомом А группы АН (в данном случае группы NH), и электроотрицательным атомом В ( в
нашем случае это атом кислорода, являющийся акцептором электрона). На Рисунке 1 показан остов альфа-спирали (без боковых цепей) и выделены водородные связи (черным цветом).
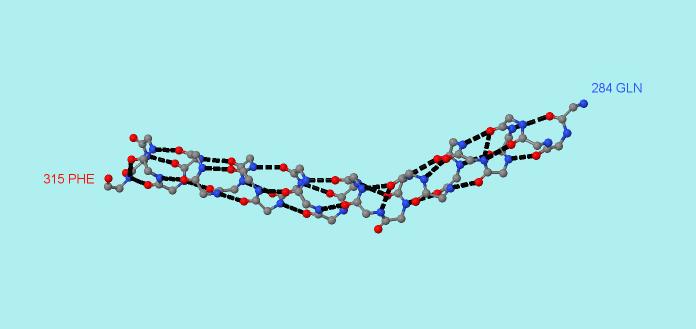
Рис.1. Водородные связи в альфа-спирали белка grl4197.
Аналогично рассмотрим бета-лист. Водородная связь тут образуется между СО-группами одного тяжа и NH-группами другого.
Он имеет складчатую поверхность. На Рисунке 2 показана бета-структура (боковые цепи не отражены)
и выделены водородные связи (чёрным цветом). Для первого и последнего остатков подписаны номера. Также
можно сказать, что тяжи антипараллельны.
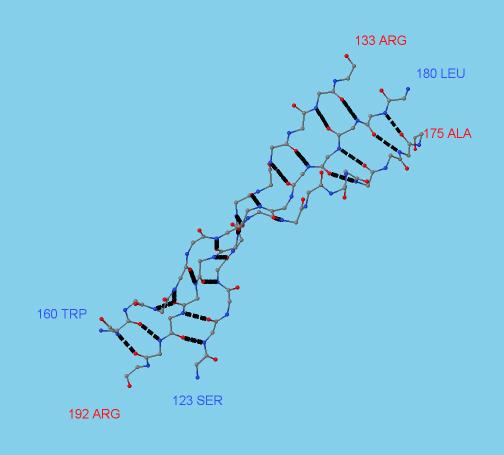
Рис.2. Водородные связи в бета-листе белка grl4197.
Внутримолекулярные взаимодействия боковых цепей
Солевые мостики. Солевые мостики являются разновидностью водородной связи с дополнительным электростатическим взаимодействием
. Может образоваться между отрицательно (Asp, Glu) и положительно (Lys, Arg) заряженными остатками белка. На Рисунке 3 показаны все солевые
мостики в белке. Всего их 94. Однако это лишь предположение, и точно мы сказать не можем.
Рисунок получен с помощью скриптов atom-types и
connect (нажмите, чтобы скачать).

Рис.3. Солевые мостики в белке grl4197.
Более детально солевой мостик показан на Рисунке 4.
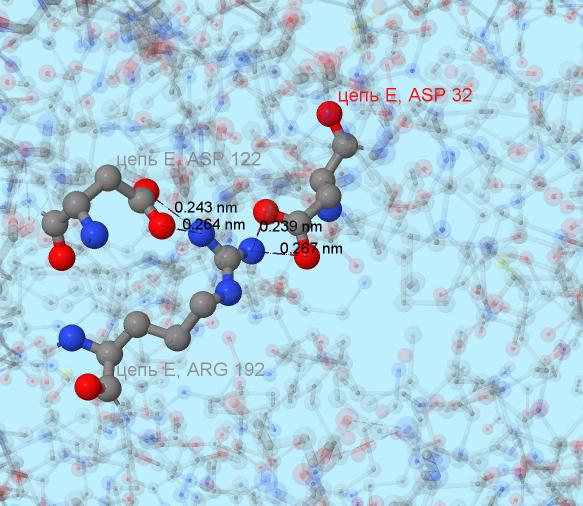
Рис.4. Солевой мостик.
Водородная связь, не являющаяся солевым мостиком. На Рисунке 5 изображена водородная связь между заряженой и незараженой (что
исключает возможность электростатического взаимодействия) аминокислотами -
глутаминовой кислотой и изолейцином. Расстояние между взаимодействующими атомами - 3,19 ангстрем.
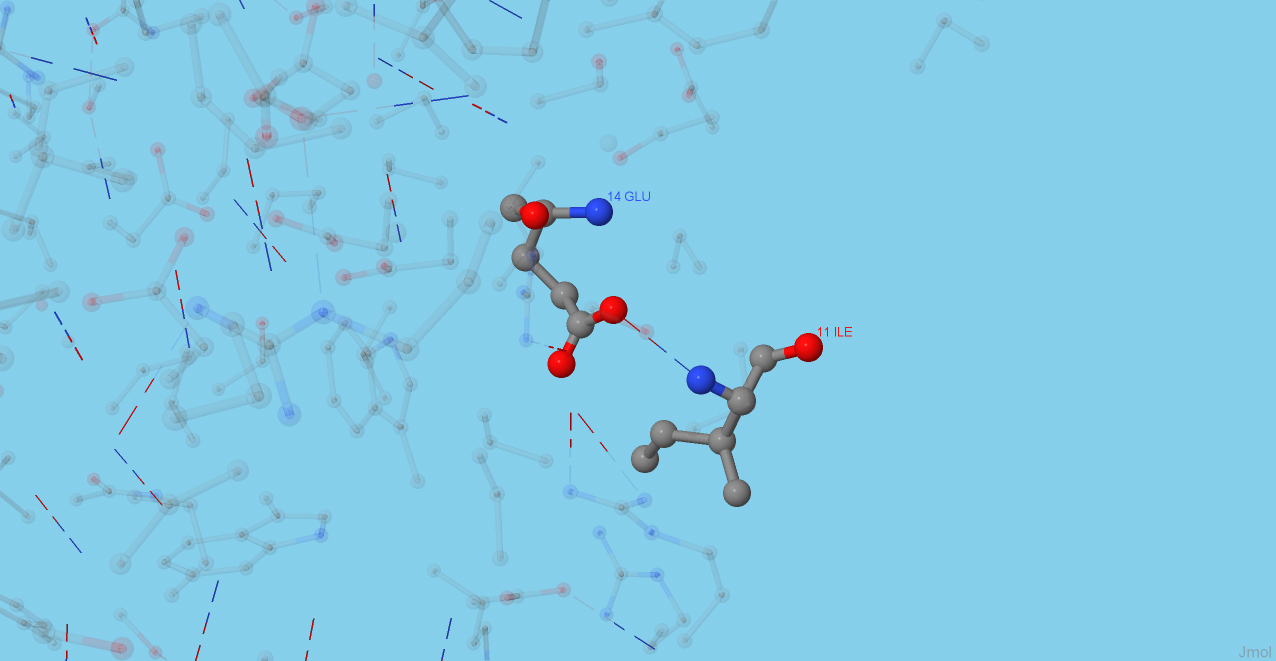
Рис.5. Водородная связь.
Дисульфидный мостик. Или так называемая SS-связь. Образуется при окислении остатков цистеина в остатки цистина. В моем белке взаимо
действий подобного типа нет, поэтому я рассматривала связь в белке инсулин, идентификатор 1H59.
Результаты работы представлены на Рисунке 6, на котором отмечено расстояние между атомами серы и углы, характеризующие геометрию S-S связи.
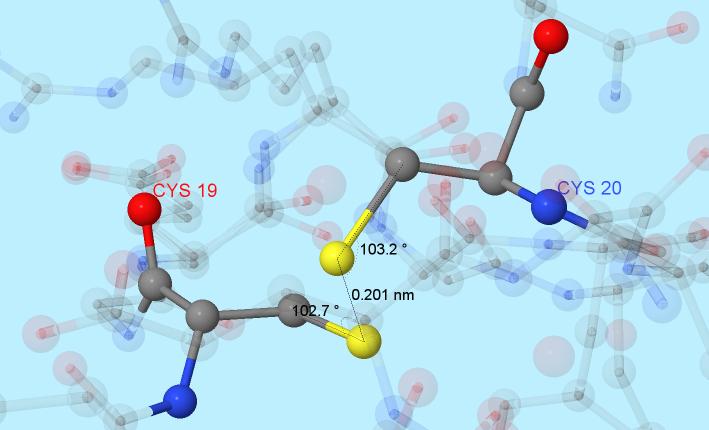
Рис.6. Дисульфидный мостик.
Гидрофобные взаимодействия
Для выполнения задания был использован скрипт atom-types (нажмите для скачивания),
в котором все гидрофобные группы атомов белков определены командой define hfprot <перечисление>. Согласно скрипту,
это все S или C атомы, не имеющих связей с полярными атомами. На Рисунке 7 показаны все гидрофобные атомы (зеленым цветом.

Рис.7. Гидрофобные взаимодействия в белке grl4197.
Шаг и число остатков на виток для одной альфа-спирали
На Рисунке 8 можно увидеть позицию выбранной спирали на цельной структуре цепи белка. На рисунке указаны соответствующие
номера остатков напротив начала и конца спирали.

Рис.8. Альфа-спираль в белке grl4197.
На Hисунке 9 для выбранной спирали отмечены шаг спирали (на рисунке в нм. в ангстремах в 10 раз больше).
Под шагом спирали понимается расстояние вдоль оси спирали, соответствующее одному полному витку, то есть
повороту на 360 градусов. На 8 витков приходится 282-253=29 аминокислотных остатков, т.е. на один виток примерно 3.6.
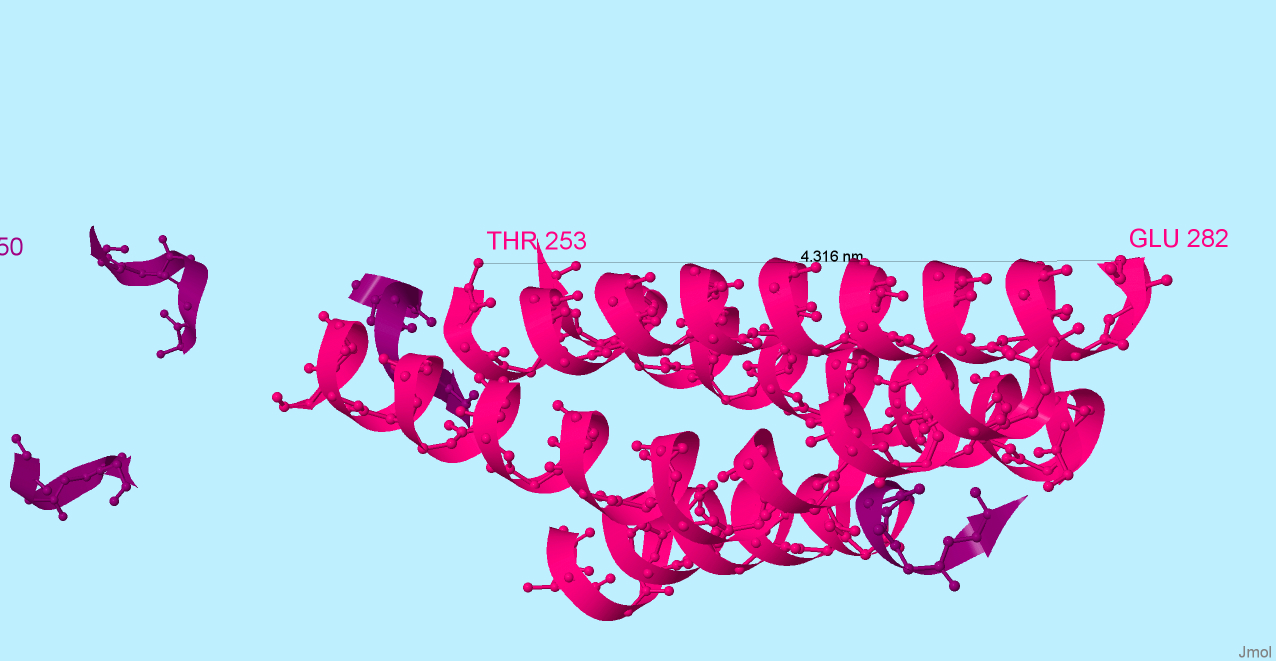
Рис.9. Альфа-спираль в белке grl4197.
| © Амосова Алена. 2014 год | Дата последнего изменения: 13 марта 2014. |