Совмещение структур белков
Во время работы над пятым практикумом требовалось опишисать совмещение полипептидных цепей
моего белка и белка, похожего по структуре. Для поиска похожих белков используется сервис PDBeFold.
От меня требовалось найти белок, схожий с AN OPEN-PORE STRUCTURE OF A BACTERIAL PENTAMERIC LIGAND- GATED ION CHANNEL (3eam), или Порооткрывающая структура
бактериального пентамерного ионного двулигандного канала, цепь А,
организм Gleobacter violaceus.Всего найдено было 149 совпадений, включая тот, по которому вёлся поиск. В конце концов я выбрала почти самый последний из
списка белок (т.е. практически самый непохожий). Находка имеет следующие параметры:
1. Title (Название): C. ELEGANS GLUTAMATE-GATED CHLORIDE CHANNEL (GLUCL) IN COMPLEX WITH FAB AND IVERMECTIN
2. Match (соответствие): 3rhw:A
3. %seq (процент совпадающих аминокислотных остатков): 23
4. N_align (Число сопоставленых Са атомов): 297
5. RMSD (мера сходства структур): 1.95
6. N_g (число "гэпов"): 10
7. Из организма: Caenorhabditis elegans
На Рисунке 1 представлено сравнение цепочек белков. Синим цветом окрашена цепь белка 3eam, а черным - 3rhw.
Также разными цветами выделены С-альфа атомы: красным - С-альфа атомы 3eam, зеленым - С-альфа атомы 3rhw,а жёлтым
и розовым - С-альфа атомы геометрического ядра.
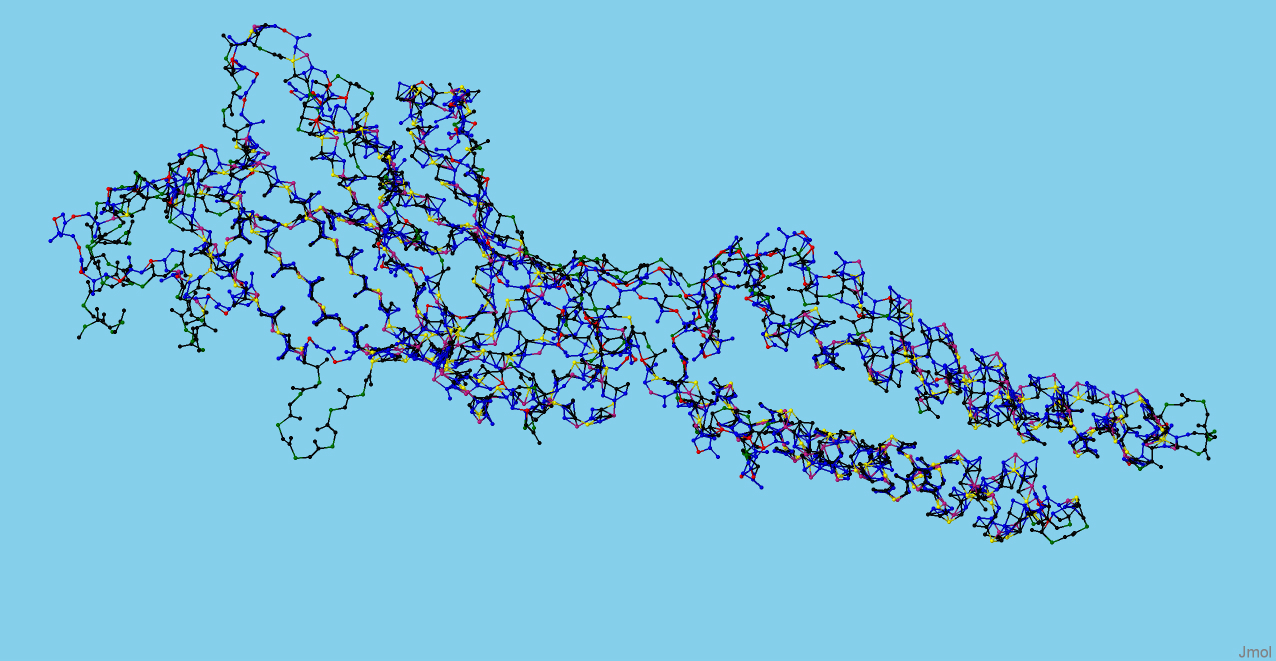
Рис.1. Сравнение цепочек белков.
Геометрическое ядро - это наиболее хорошо совмещаемые С-альфа атомы. На Рисунке 2 показан участок с гомо
логичным и негомологичным участком.
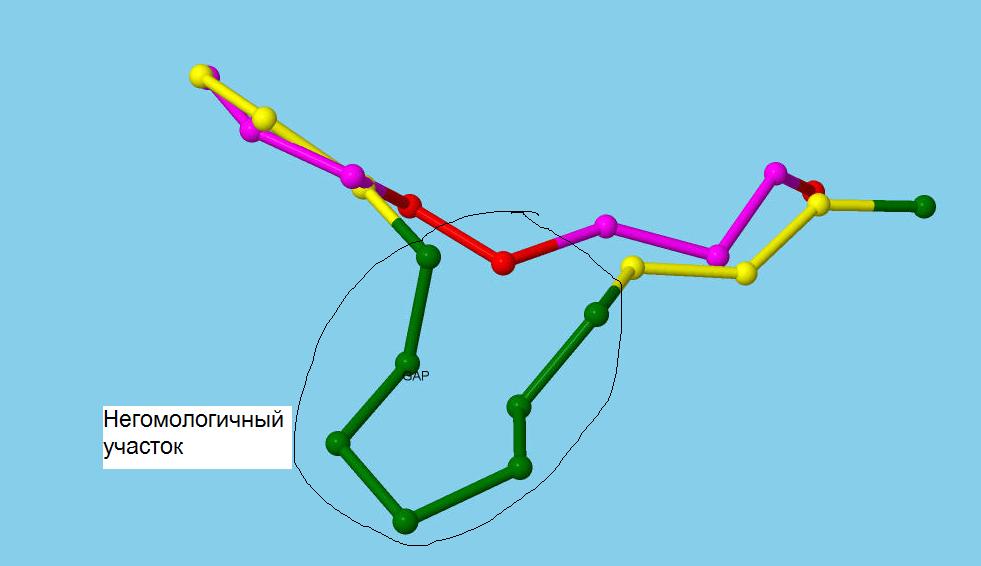
Рис.2. Участок сравнения цепочек белков.
| © Амосова Алена. 2014 год | Дата последнего изменения: 13 марта 2014. |