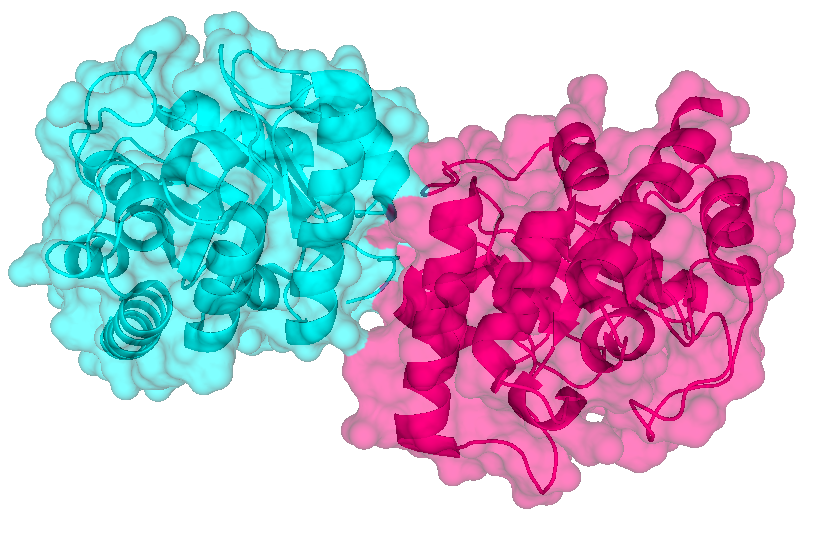
Цепи А и В показаны голубым и розовым цветами, соответственно.
Кристаллографические характеристики
Структура 1G6C представляет собой белок тимин-фосфат-синтазу бактерии Bacillus subtilis. В поле CRYST1 записи PDB указаны кристаллографические характеристики структуры:
| Длины направляющих векторов | Углы между направляющими векторами | Кристаллографическая группа | Число молекул в ячейке |
| 76.650 76.650 140.070 | 90.00 90.00 90.00 | P 43 21 2 | 16 |
Название кристаллографической группы P означает, что элементарная ячейка 1G6C имеет примитивную центровку (без дополнительных узлов) и является орторомбической (α = γ = β = 90). Для этой пространственной группы заданы следующие операторы симметрии:
symmetry= X,Y,Z
symmetry= -X,-Y,Z+1/2
symmetry= -Y+1/2,X+1/2,Z+3/4
symmetry= Y+1/2,-X+1/2,Z+1/4
symmetry= -X+1/2,Y+1/2,-Z+3/4
symmetry= X+1/2,-Y+1/2,-Z+1/4
symmetry= Y,X,-Z
symmetry= -Y,-X,-Z+1/2
Изображение части кристалла и контактов между белками из соседних ячеек
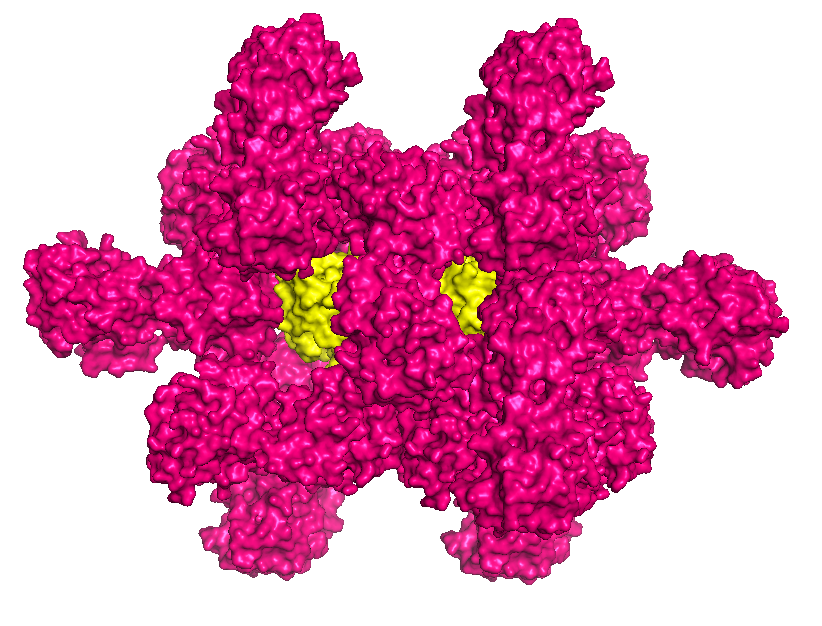
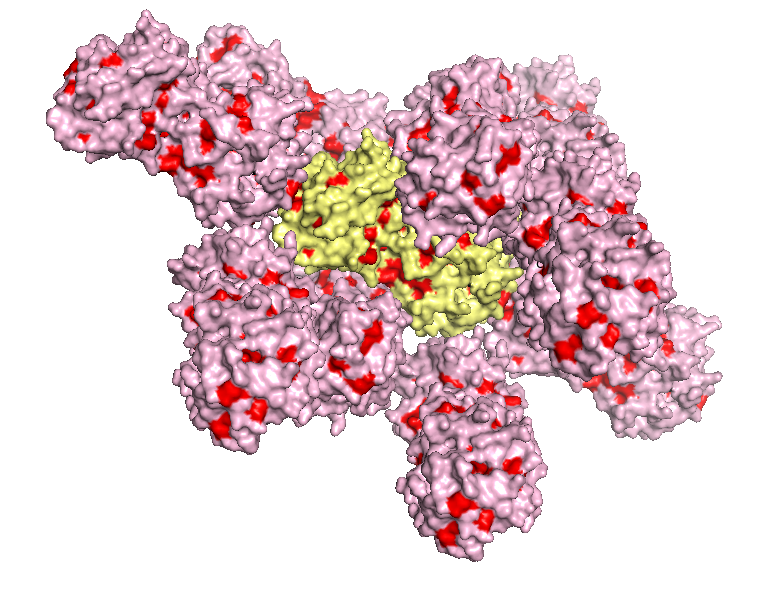
Белок 1G6C является ассиметрической единицей, состоящей из цепей А и В. Данная структура также имеет 4 лиганда. Чтобы найти контакты белка с молекулами из соседних ячеек, с помощью команды symexp были восстановлены кристаллографические ячейки на расстоянии менее чем 3.5 Å от исходной структуры. Таких ячеек оказалось десять. Изображения структуры белка и соседних ячеек кристалла представлены ниже.
 |
 |
| Структура 1G6C Цепи А и В показаны голубым и розовым цветами, соответственно. |
Структура 1G6C с восстановленными соседними ячейками |
На изображениях ниже представлены контакты молекулы белка в кристалле с соседствующими молекулами. Так как молекулы белка компактно расположены в кристалле, рассмотрение взаимодействий на изображениях приведено для отдельных фрагментов структуры.
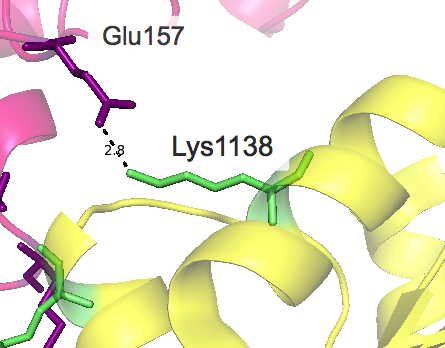
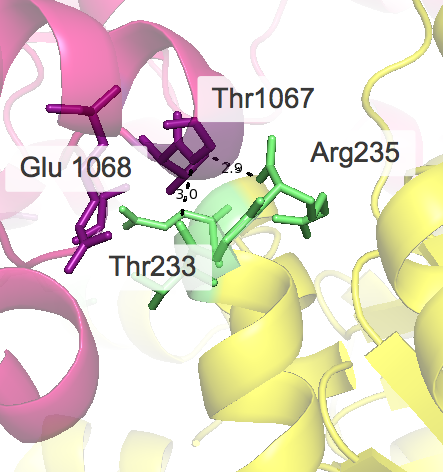
Примеры водородных связей в структуре
 |
 |
 |
 |
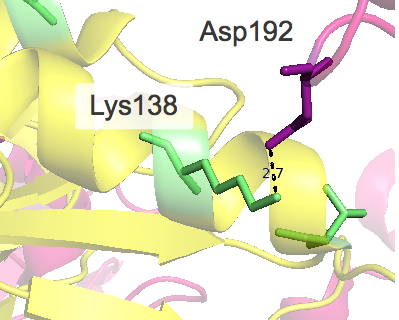
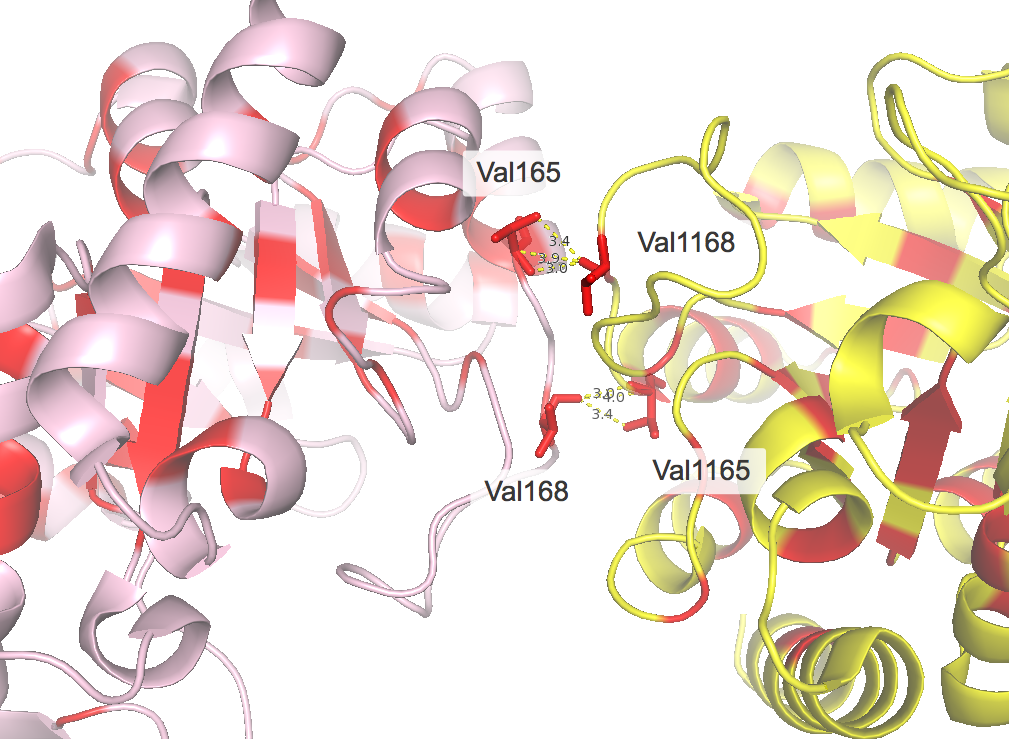
| Ser169 ••• Ser1169 Ser169 ••• Gln1166 Val168 ••• Val1165 Val165 ••• Val1168 |
Следует отметить, что при рассмотрении взаимодействий ярко проявляется симметрия структуры, присутствуют контакты, которые представлены дважды. Например, первый раз взаимодействуют лизин исходной "центральной" молекулы и аспартат другой, а во второй раз - наоборот, но уже с другой стороны от центральной структуры и тд.
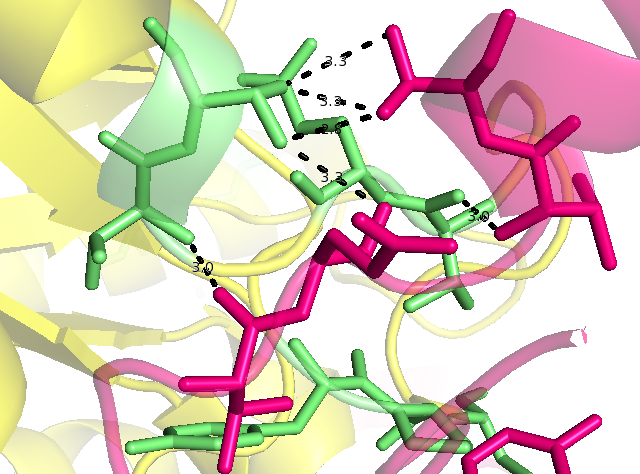
Далее рассмотрим гидрофобные взаимодействия. Гидрофобные остатки показаны красным цветом. Такие взаимодействия, причем они "симметричны", присутствуют только с молекулами белков, находящихся "слева" и "справа" от исходной.
 |
 |
| Гидрофобные остатки | Пример "симметричного" водородного контакта в структуре |
Выводы
Анализ взаимодействий белка с соседними молекулами в кристалле позволяет получить более полное представление о структуре. Таким образом в структуре 1G6C присутствует большое количество межмолекулярных взаимодействий между белками из разных кристаллографических ячеек (водородные связи, гидрофобные контакты). Эти взаимодействия носят периодический характер, повторяясь для каждой ячейки, и обуславливают симметричность кристалла.
Структура 3HDD (PDB ID: 3HDD, разрешение структуры: 2.20 Å) была выбрана для дальнейшей работы. Она представляет собой комплекс гомеодомена и ДНК организма Drosophila melanogaster. Для построения соседних молекул ДНК в PyMol применялась команда symexp symd, dna, chain B, 4, 1. Она позволяет получить изображение молекулы ДНК из соседней ячейки, которая контактирует с цепью B белка.
В образовании водородных связей участвуют аминокислотные остатки Arg5, Thr6, Arg29, Gln33 и Lys55. В основном, белок взаимодействует положительно заряженными радикалами с отрицательно заряженным сахарофосфатным остовом ДНК. На изображениях ниже показаны цепь B белка, молекулы ДНК соседних ячеек, а также водородные связи между ними (фрагменты белка и ДНК, расположенные на расстоянии не более 3,5 Å).
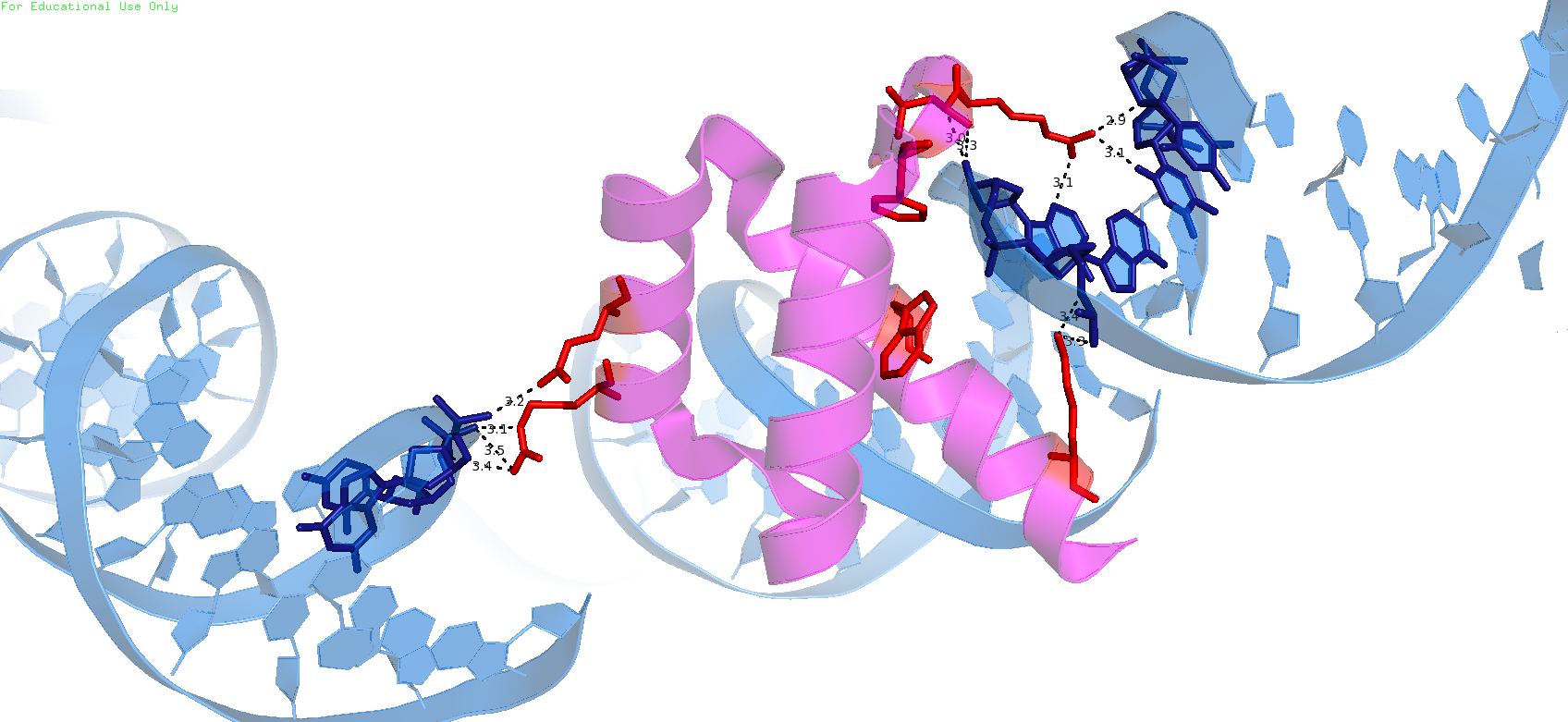 |
| Водородные связи цепи В белка с цепями ДНК соседних ячеек Аминокислотные остатки, участвующие в образовании водородных связей, показаны красным цветом, нуклеотидные остатки - синим. |
Выводы
Визуализация молекулы ДНК соседней ячейки кристалла и выявление контактов белка с ДНК объясняют "странность" положения цепи B белка, находящейся «на краю» двойной спирали ДНК асимметрической единицы.