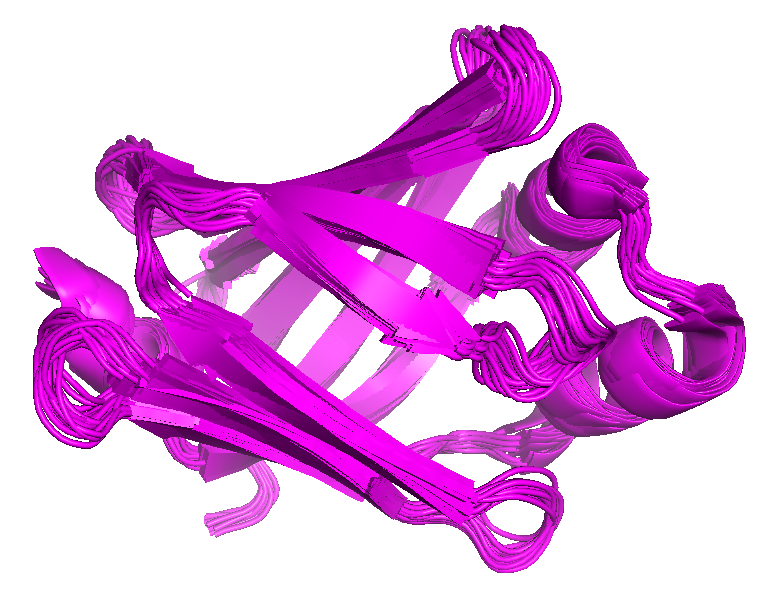
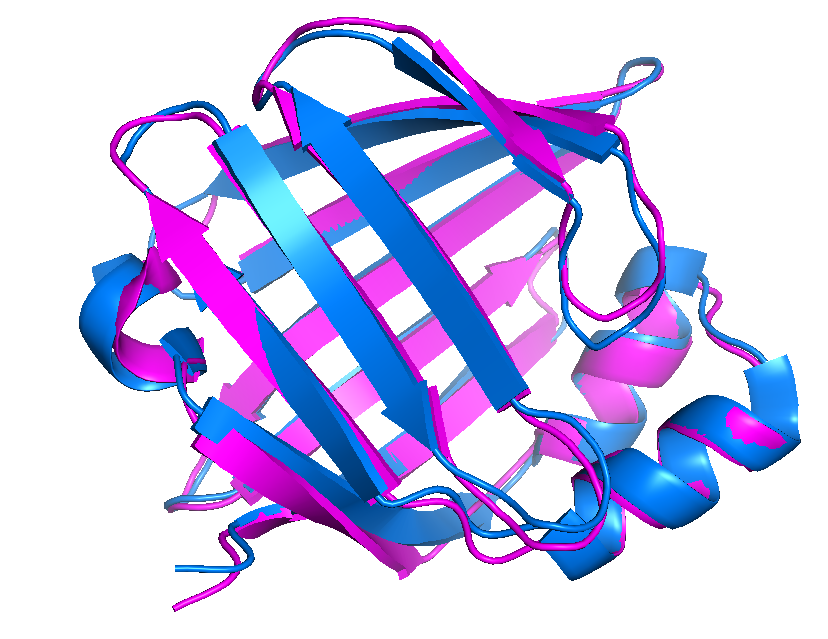
Из таблицы был выбран белок 1JJJ (ЯМР структура). Она содержит 20 моделей. Ей соответствует РСА структура - 1B56. Разрешение структуры - 2.05 Å. Структура представляет собой мономер, длина белковой цепи составляет 135 аминокислотных остатков. Белок принадлежит к классу липид-связывающих белков.
 |
 |
| Рисунок 1. Все модели записи 1JJJ (показаны одним цветом) | Рисунок 2. Структура 1JJJ (показана голубым цветом) при наложении на структуру 1B56 (показана розовым цветом) |
Модели структуры 1JJJ очень хорошо коррелируют между собой. Небольшие расхождения наблюдаются в районе петель. Положения α-спиралей и β-листов в целом совпадают. При наложении структур 1JJJ и 1B56 можно наблюдать большое количество несовпадений в районе петель, выходящих на поверхность глобулы, и на концах структуры. Достаточно сильные различия имеются и в β-листах.
При выборе водородных связей для анализа будем считать, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3.5 Å, а воображаемый водород лежит на линии донор-акцептор или отклоняется от этой линии не более чем на 70 градусов. Были проанализированы водородные связи в структуре РСА в трех местах молекулы:
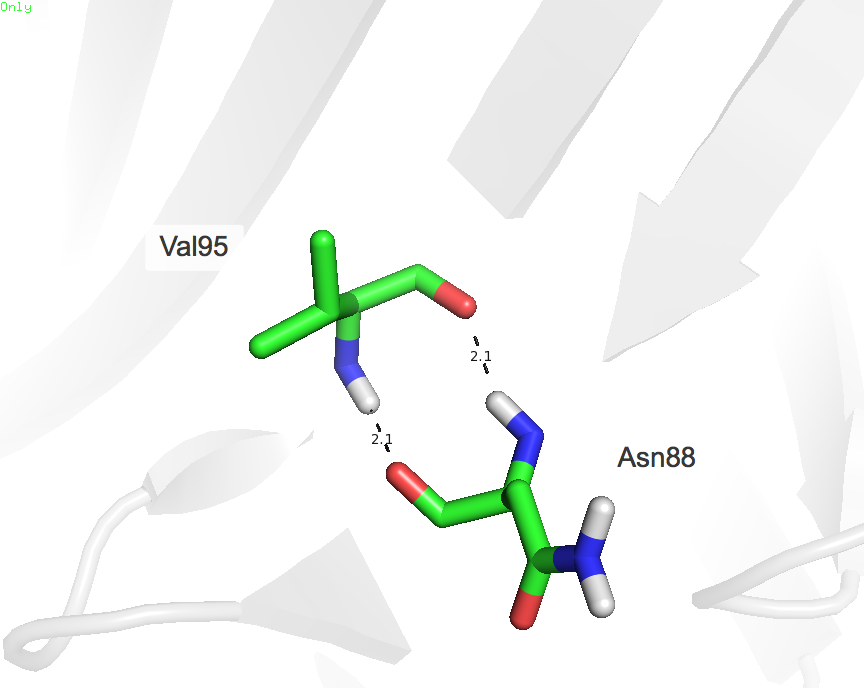 |
| Рисунок 3. Водородные связи в β-листе между Val95 и Asn88 (H···O и O···H) |
При данных водородных связях оба остатка поочередно выступают в качестве донора и акцептора. Они обнаруживаются во всех моделях, полученных методом ЯМР. Длины данных водородных связей не очень отличаются по длине, если сравнивать структуры, полученную методом РСА и ЯМР.
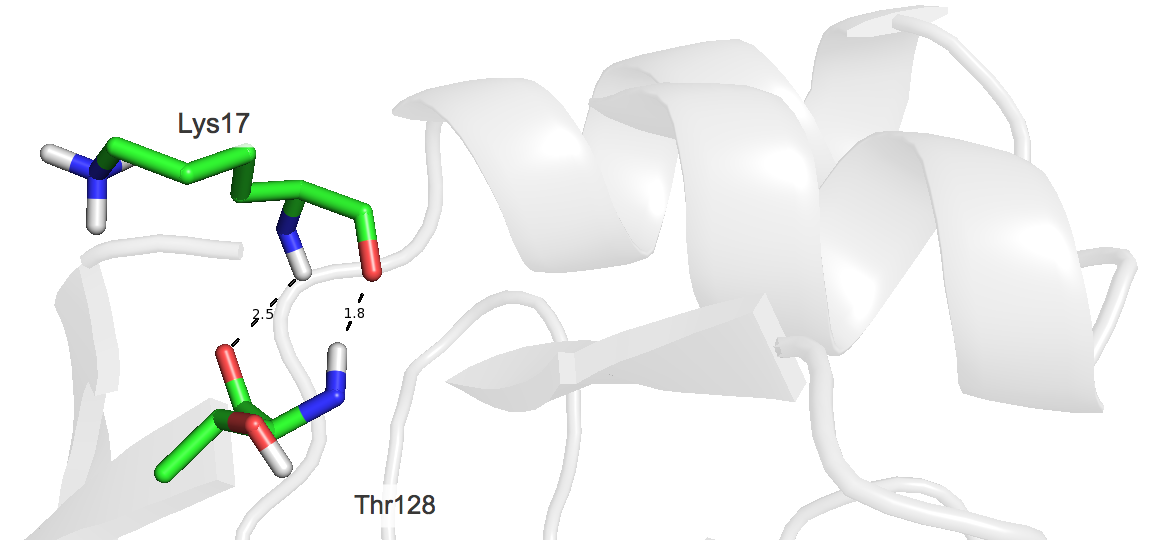 |
| Рисунок 4. Водородные связи в боковых цепях ядра белка между Lys17 и Thr128 (H···O и O···H) |
При данных водородных связях оба остатка поочередно выступают в качестве донора и акцептора. Эти связи присутствуют практически во всех моделях ЯМР. Их длины достаточно сильно варьируются между моделями ЯМР.
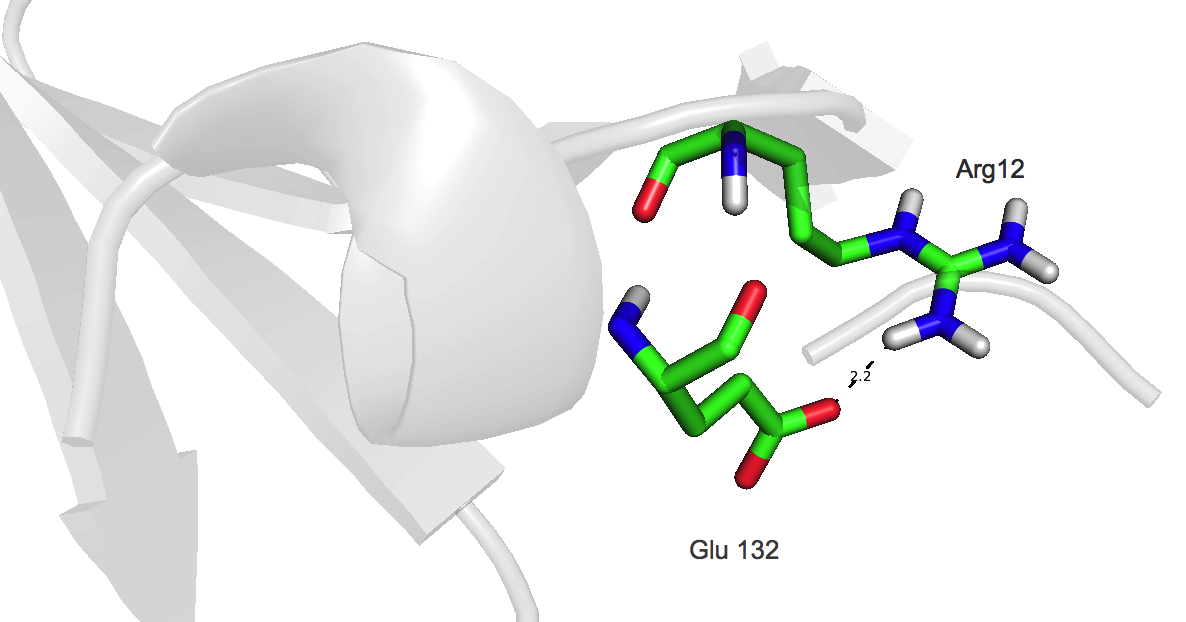 |
| Рисунок 5. Водородная связь в петлях, выходящих на поверхность глобулы, между Arg12 и Glu132 (HH11···OE2) |
Arg выступает в качестве донора протонов, Glu в качестве акцептора. Следует отметить, что данная водородная связь присутствует далеко не во всех моделях ЯМР. В структуре, полученной методом ЯМР, длина данной водородной связи сильно варьирует.
Таблица 1. Подробная информация о выявленных водородных связях
| Водородная связь | Расстояние в РСА, Å | % моделей ЯМР, где присутствует данная водородная связь | Минимальное расстояние в ЯМР, Å | Максимальное расстояние в ЯМР, Å | Медианное расстояние в ЯМР, Å |
| в β-листе между Val95 и Asn88 | 2.1 и 2.1 | 100 и 100 | 1.8 и 1.9 | 1.9 и 2.1 | 1.9 и 2.0 |
| в боковых цепях ядра белка между Lys17 и Thr128 | 2.5 и 1.8 | 80 и 100 | 1.9 и 1.8 | 2.8 и 2.4 | 2.35 и 2.0 |
| в петлях, выходящих на поверхность глобулы, между Arg12 и Glu132 | 2.2 | 65 | 1.6 | 2.3 | 1.8 |
Больше всего варьирует длина водородной связи в петлях, выходящих на поверхность глобулы, что подтверждает выводы о наблюдаемом расхождении структур в районе петель, полученные на основании визуализации всех моделей ЯМР структуры 1JJJ. Такое явление связано с тем, что в растворе аминокислоты, находящиеся на сравнительно подвижных участках цепи, например на петлях, легко могут изменять свое положение, при этом сильно варьируется длина связи между ними, вплоть до ее потери. Наиболее стабильна по длине водородная связь в β-листе и в боковых цепях ядра белка, так как данные вторичные структуры сравнительно стабильны в растворе. Также можно отметить, что в среднем длина водородной связи, полученной методом РСА немного больше длины этой же связи, полученной методом ЯМР.