Исследование вторичной структуры заданного белка
Назад
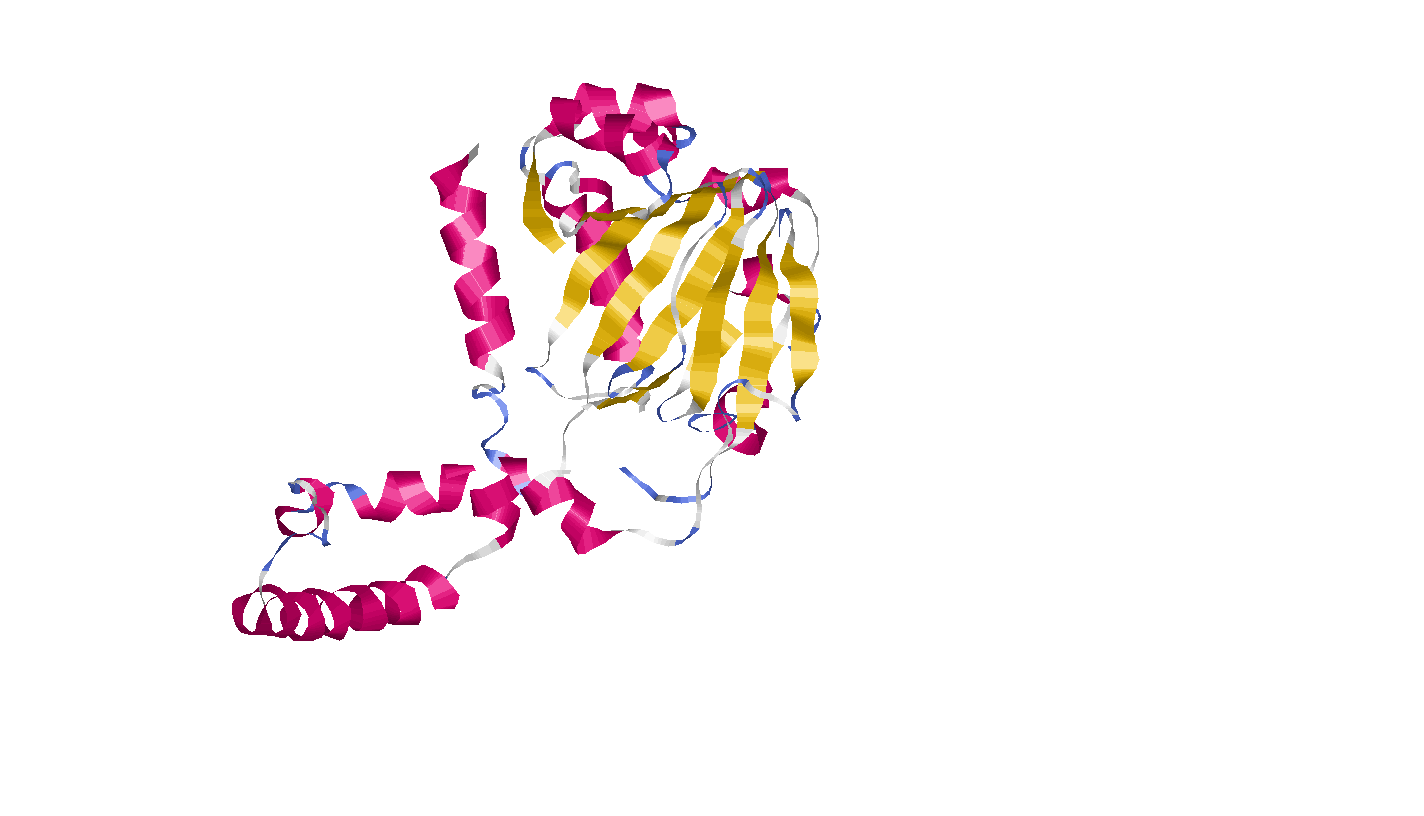
Структура А цепи:
- Альфа-спиралей- 14
- Бета-складок- 12
- Реверсивных поворотов- 29
Мой белок- α+β белок, т.к.
в его структуре не прослеживается чередование
бета-тяжей и альфа-спиралей
Альфа-спираль:
His273:A (30.066 43.999 108.924) - Gln297:A (69.313 34.118 123.116)
Антипараллельные тяжи:
Ala136:A (63.974 66.698 149.259) - Ser129:A (69.597 50.380 134.275)
Thr232:A (67.983 64.753 152.104) - Phe239:A (67.518 48.053 137.467)
Gln157:A (73.111 63.783 153.011) - Thr150:A (64.381 47.173 141.993)
Параллельные тяжи
Phe100:A (67.126 63.829 138.603) - Leu98:A (63.279 66.368 142.979)
Val83:A (60.747 71.841 135.147) - Phe81:A (55.578 67.925 136.487)
Реверсивный поворот
Ser228:A (62.190 64.046 154.493) - Ala231:A (67.054 68.168 153.527)
Комментарии:- Представленны координаты С-альфа атомов данных остатков
- Расстояние между параллельными тяжами было больше, чем между антипараллельными, м.б., это связано с более слабым взаимодействием между ними(тяжами).
В параллельных тяжах- меньше 5-ти остатков, т.к. эти тяжи были единственными параллельными в моём белке
Моя спираль(His273:A - Gln297:A)
Паттерн Н-связей в альфа-спирали:
H1(273,277);H2(274,277) и.т.д., где общаяя формула-Hi<272+i,276+i> отсюда следует на 1 виток- 4 аминокислотных остатка.
Остатки имеющие более 1 водородной связи:
H5(277,280 и 281)
H12(284,287 и 288)
Не образуют водородные связи: 273-276N и 294-297O(концевые остатки)
Все С-бета атомы распологаются снаружи от остова спирали
Скрипт
Мой бета-тяж(антипараллельный)
Ala136:A - Ser129:A
Thr232:A - Phe239:A
Gln157:A - Thr150:A
Все С-бета атомы также располагаются снаружи(над и под) бета-листом
Скрипт
Реверсивный поворот(Ser228:A - Ala231:A)
Водородная связь, способная скрепить поворот отсутствует
(м.б. из-за довольно большого расстояния между концами реверсивного поворота)
Скрипт
©Abdullaev Eldar