FoxE - это белок, закодированный опероном foxEYZ генома бактерии Rhodobacter ferrooxidans SW2, которая вовлечена в аноксигенный фотосинтез, основанный на окислении Fe(II) до Fe(III). Предполагается, что белок расположен в периплазме, где стимулирует зависящее от интенсивности освещения окисление Fe(II). Он включает в себя 259 остатка, в том числе 8 лигандов. (Ссылки внизу страницы)
PDB ID: 5MVO
Uniprot ID: -

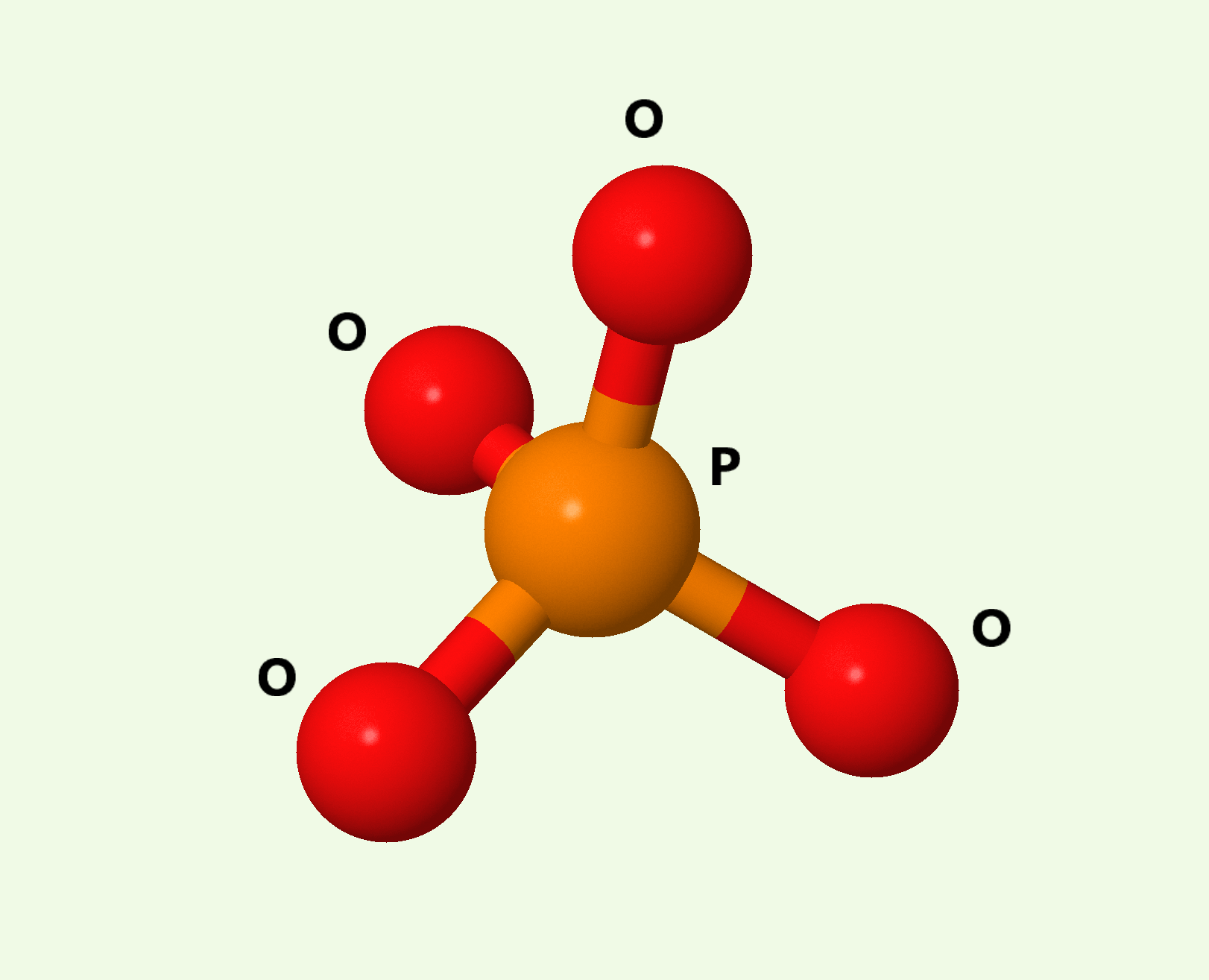
Фосфат-ион связан с атомами белка четырьмя водородными связями. Их длины варьируются от 3 до 3.5 Å, что нормально для водородной связи, а средний угол равен 111.3°. Этот угол сильно разнится от идеального 180° и даже среднего для водородной связи 140-150°, и, как следствие, эти водородные связи слабее обычных; скорее всего их неустойчивость компенсируется количеством.
| IUPAC | phosphate |
| Химическая формула | O4P-3 |
| Молярная масса | 94.97 г/моль |
| Ссылка на идентификатор в базе данных PubChem | |

Ион меди координируют 4 атома кислорода аспартата.
| IUPAC | copper(2+) |
| Химическая формула | Cu+2 |
| Молярная масса | 63.546 г/моль |
| Ссылка на идентификатор в базе данных PubChem | |
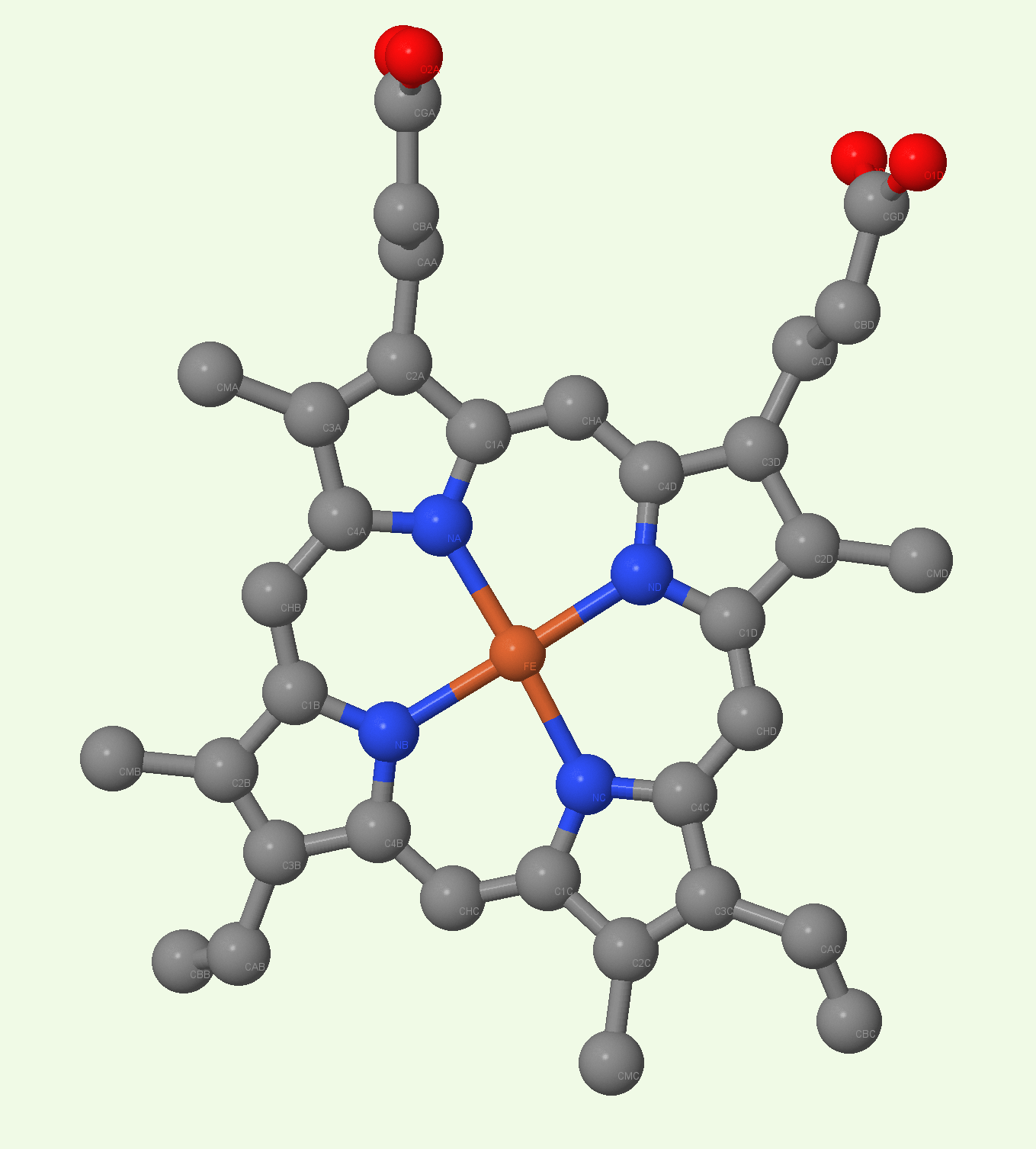
Гем C - это комплексное соединение двухвалентного железа с порфирином, выступающее в качестве простетической группы белков. Главная особенность этого типа гема (отличающая его от гемов А, В и О) заключается в том, что заместителем при 3 и 8 атомах углерода является -CH-CH3-группа, где первый атом углерода связан тиоэфирной ковалентной связью с белком (т.е. c -SH группой цистеина), а при 18 атоме углерода - метильная группа. Тиоэфирные связи обеспечивают прочность соединения лиганда и белка.
В основном гем С удерживается в белке благодаря гидрофобным контактам: их больше, чем каких-либо других (14), и их длина в среднем немного больше длины водородных связей (~3.6 Å). Также имеются 5 водородных связей; атом железа в центре гема координируется азотом из радикала гистидина и атомом серы метионина. В данном случае имеется только одна тиоэфирная связь.
| IUPAC | 3-[18-(2-carboxyethyl)-8,13-bis(ethenyl)-3,7,12,17-tetramethylporphyrin-21,24-diid-2-yl]propanoic acid;iron(2+) |
| Химическая формула | C34H32FeN4O4 |
| Молярная масса | 616.499 г/моль |
| Ссылка на идентификатор в базе данных PubChem | |
В качестве разновидности ковалентного взаимоействия рассматривались дисульфидные мостики. Как правило, между белковыми цепями они встречаются нечасто, и между цепями нашего белка их тоже не оказалось. Во всей молекуле белка были найдены только 3 дисульфдных мостика, и все они находились в предела одной цепи - соответственно по одному мостику на цепь. Поиск происходил с помощью следующего набора команд: disulf.spt
Солевые мостики - это ионные взаимодействия длиной не более 3.5 Å между карбоксильной и NH4+-группами в радикалах таких аминокислот, как Glu, Asp и Lys, Arg, His соответственно. Однако между цепями таковых так и не было обнаружено. Использованные команды: sol.spt
Среди белок-белковых контактов можно выделить также водородную связь между атомами цепей. В частности, в белке каждую цепь связвает с другой одна водородная связь. Причем, так как данный белок – гомоолигомер, связи образуют одни и те же по месту в цепи атомы, а именно атом кислорода остова 68-го пролина одной цепи и атом азота остова 5-го лейцина другой цепи. Использованные команды: hbond.spt
| # | Имена атомов | Длина связи (Å) | Угол N-O-C (°) |
| 1 | N(5LEU.C)-O(68PRO.B) | 2.94 | 145.4 |
| 2 | N(5LEU.A)-O(68PRO.C) | 2.82 | 144.8 |
| 3 | N(5LEU.B)-O(68PRO.A) | 2.9 | 147.5 |
Можно заметить, что параметры водородных связей (длина и угол) примерно одинаковы, чего и следовало бы ожидать, так как белок - гомоолигомер. Однако 3 водородных связей недостаточно, чтобы удерживать вместе 3 белковых цепи, а солевых и дисульфидных мостиков между ними не наблюдалось. Из этого следует вывод, что основную роль в удержании формы белка играют гидрофобные контакты, о которых речь пойдет ниже.
Смотреть апплет
>Википедия: белок-белковые взаимодействия