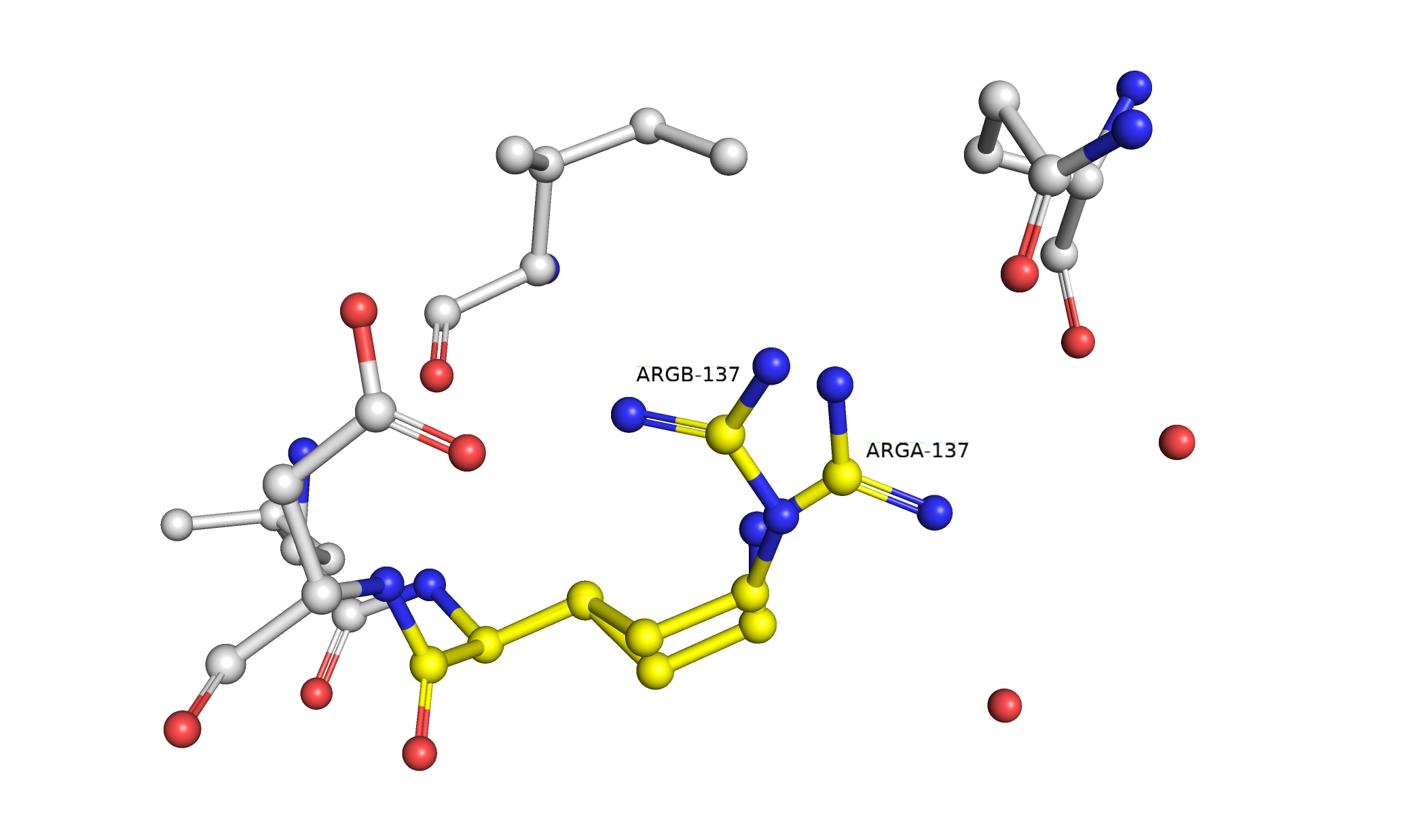

Рис. 1. Визуализация альтлоков A и B и их окружения, взаимодействующего с ними.
Здесь и далее работа ведется со структурой 3CV2. При определении водородных связей в расчет бралось предполагаемое мной положение атомов водорода и неподеленных электронных пар. Так, альтлок А (рис. 2) стабилизируется водородной связью с GLN-23 и водяным мостиком с остовным кислородом этого же остатка. Также присутствует водородная связь с другой молекулой воды, которая, скорее всего, тоже связана с окружающими ее молекулами воды водородными связями. Альтлок В (рис. 3) стабилизируется водородными связями с GLN-23 и ILE-134. Мне кажется маловероятным наличие хорошей водородной связи между NH1 ARG-137 и OD1 ASP-138 из-за неудобного угла O-H-N, однако вполне возможно присутствие солевого мостика с OD2 ASP-138. Исходя из вышесказанного, мне довольно сложно судить о том, какой альтлок стабильнее, они оба имеют достаточно хорошие взаимодействия с их окружением, обе конформации имеют место быть в структуре 3CV2. Это согласуется с данными о населенности в теле файла PDB: 0.5 для обоих альлоков.
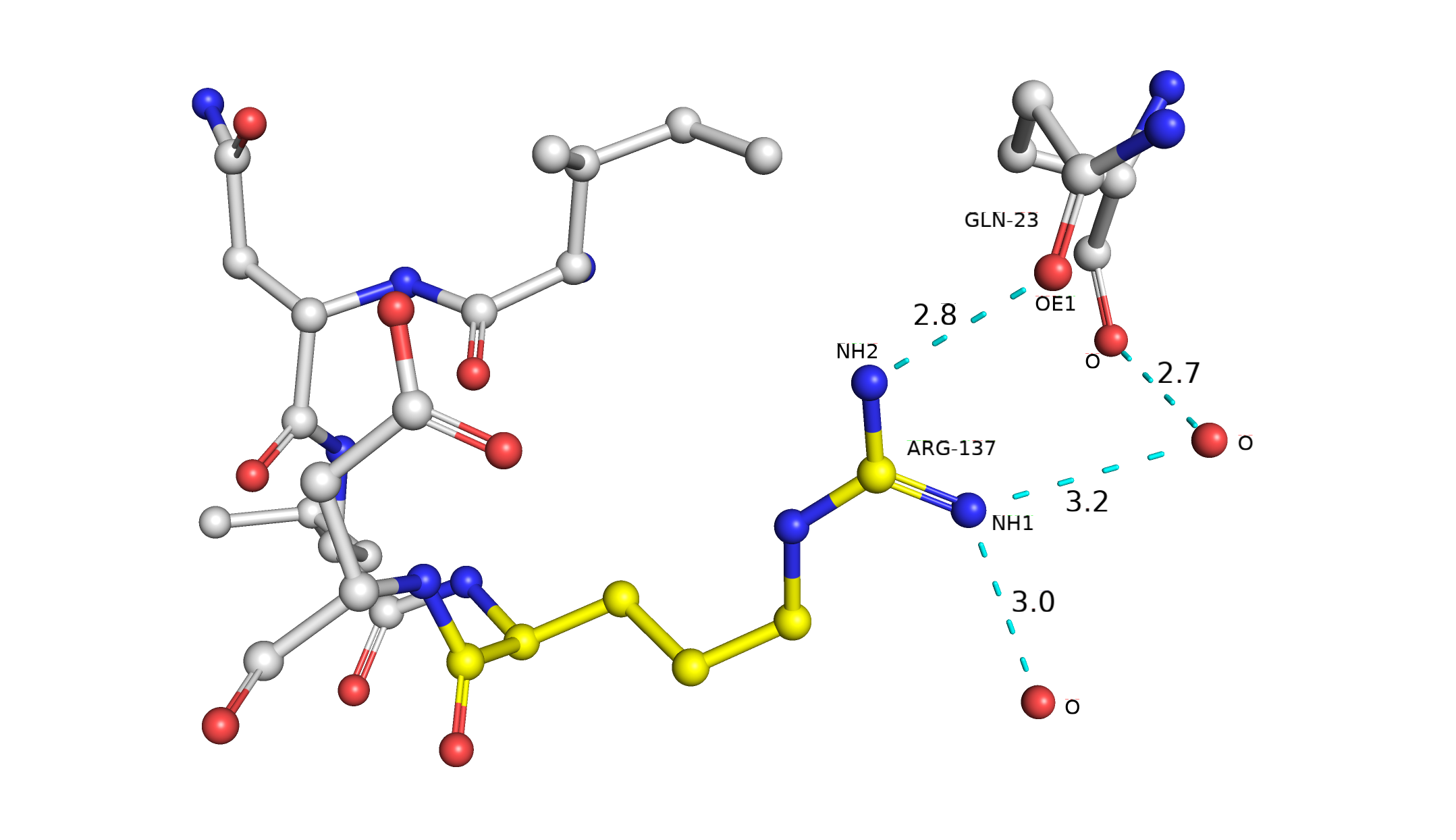
Рис. 2. Визуализация альтлока A и водородных связей (показано бирюзовым), которые он образует со своим окружением.
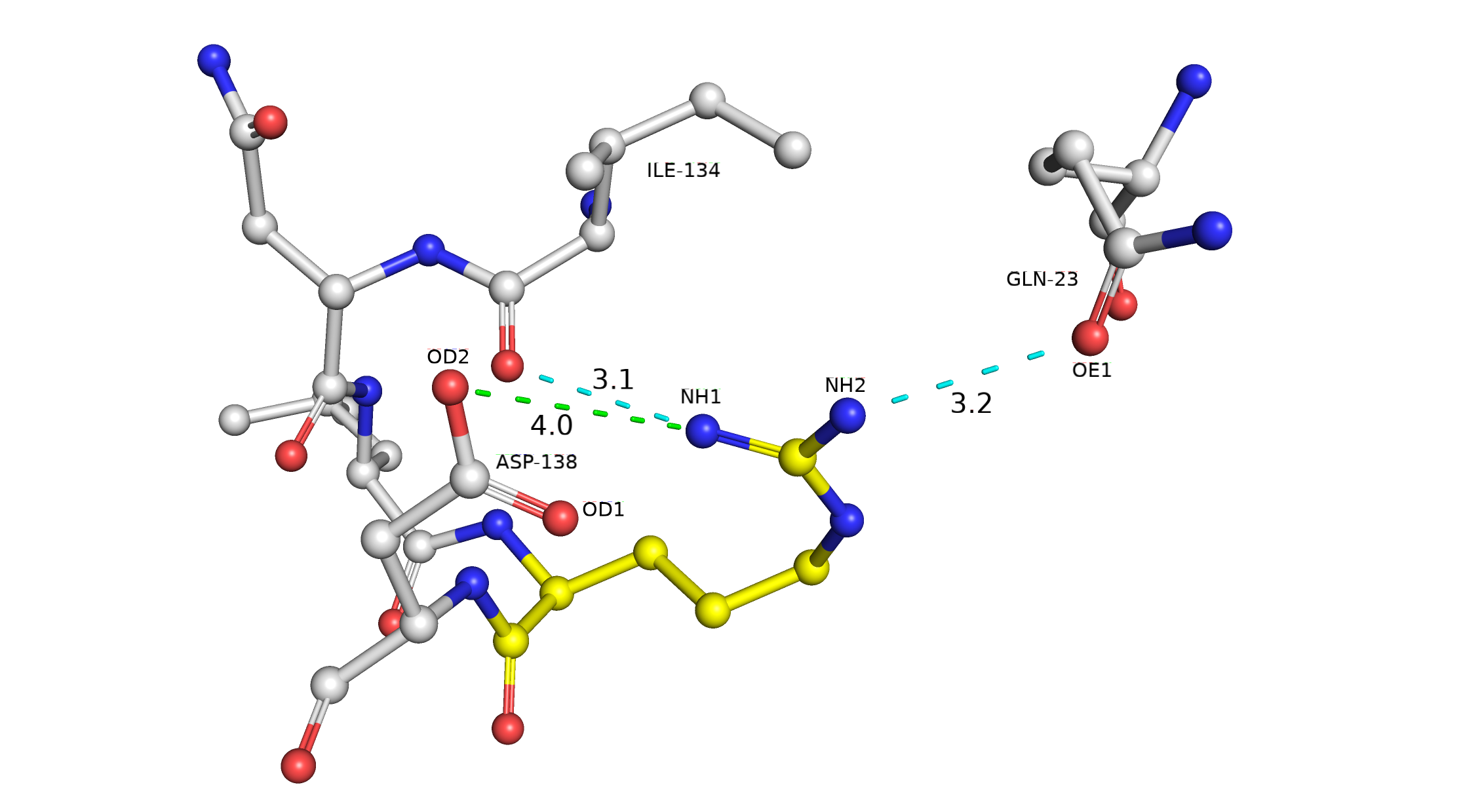
Рис. 3. Визуализация альтлока B и водородных связей (показано бирюзовым) и солевого мостика (показано зеленым), которые он образует со своим окружением.
Величина В-фактора (atomic displacement parameter) представляет собой прибавку к дисперсии в формуле распределения электронной плотности. Более гибкие участки белковых цепей сильнее отклоняются от своего среднего положения, и электронная плотность около них ниже, а их b-фактор, соответственно, больше. Как правило, поверхностные участки белка обладают большей подвижностью, чем те, что находятся в глубине глобулы, поэтому значения их B-факторов больше. Это проиллюстрировано на рис. 4.
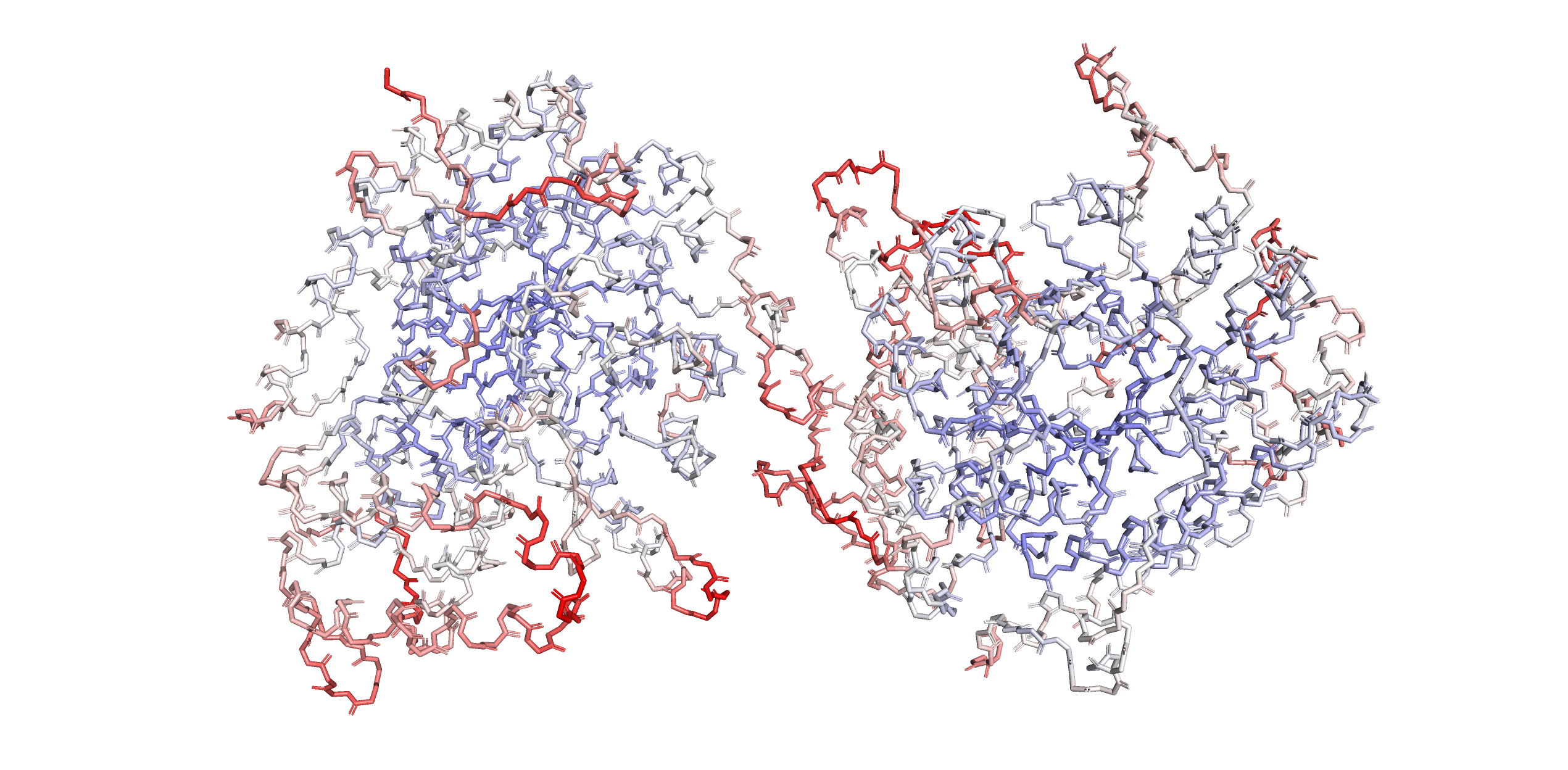
Рис. 4. Визуализация остова структуры 3CV2, покрашенного по b-фактору.
Остаток ARG-15 (рис. 5), судя по раскраске по b-фактору, довольно подвижен. Визуализация электронной плотности на уровне подрезки 3 охватывает только участки остовной части ARG-15, которая белее, чем радикальная, если судить по раскраске, а значит, менее подвижная. При подрезке 2.5 небольшой участок радикала оказался покрыт электронной плотностью, и только при уровне подрезки 1 весь ARG-15 оказался покрыт сеткой mesh. Для сравнения рассмотрим остаток ARG-313 (рис. 6), находящийся в глубине глобулы. Видим, что mesh по всем уровням подрезки (3, 2.5, 1) покрыл электронной плотностью весь остаток целиком.
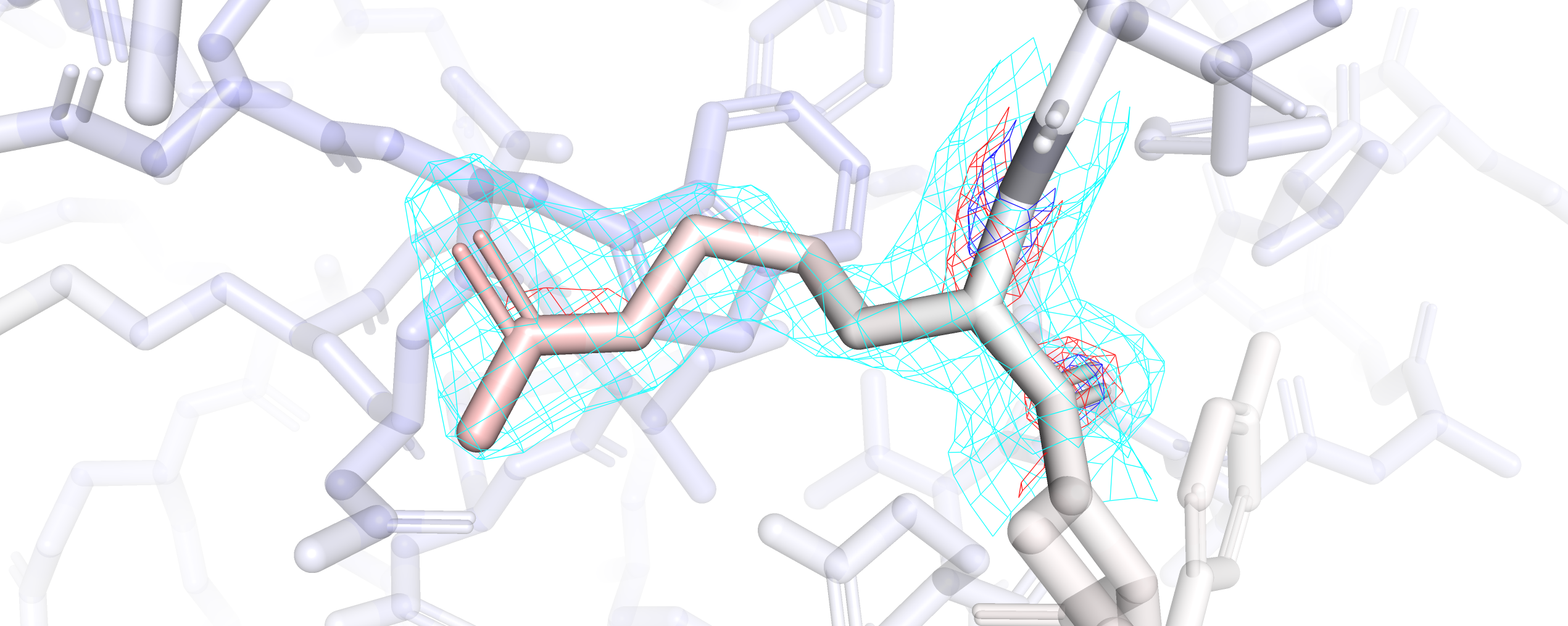
Рис. 5. Визуализация остатка ARG-15 и его электронной плотности на уровнях подрезки 3 (синий), 2.5 (красный) и 1 (бирюзовый).
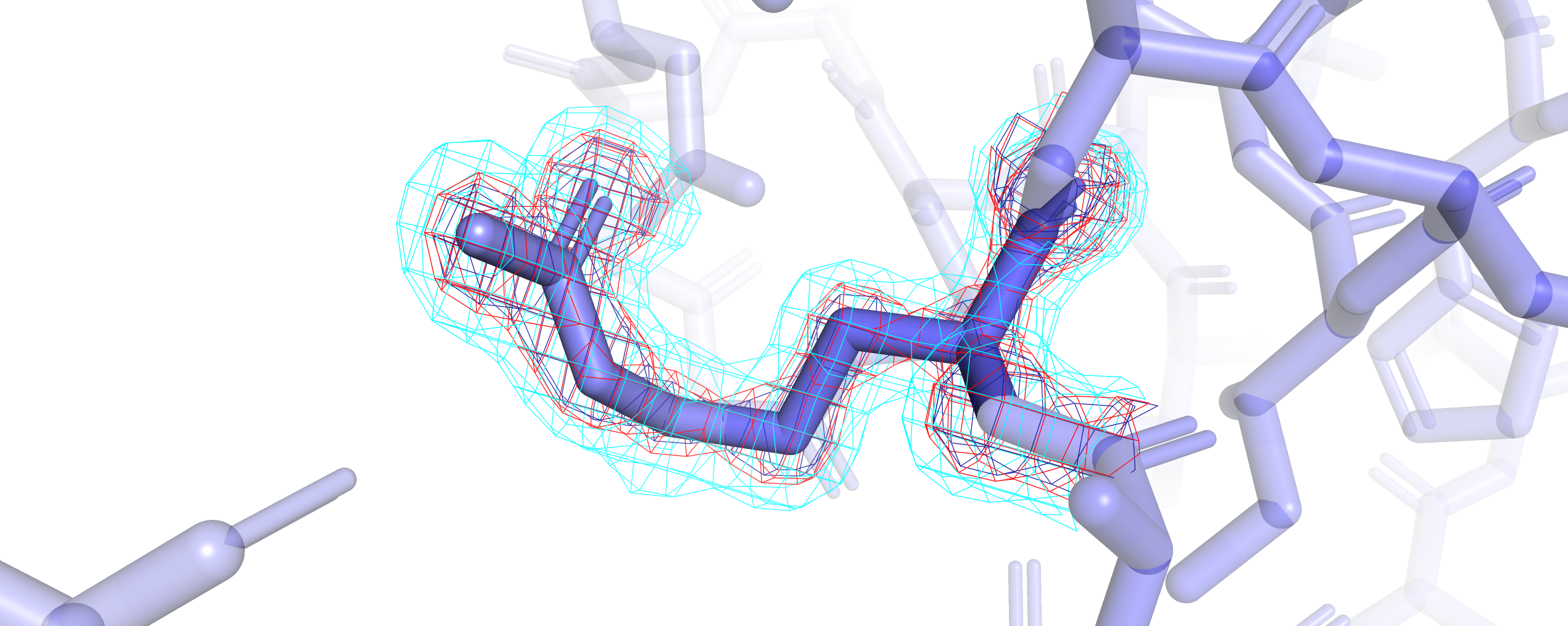
Рис. 6. Визуализация остатка ARG-313 и его электронной плотности на уровнях подрезки 3 (синий), 2.5 (красный) и 1 (бирюзовый).
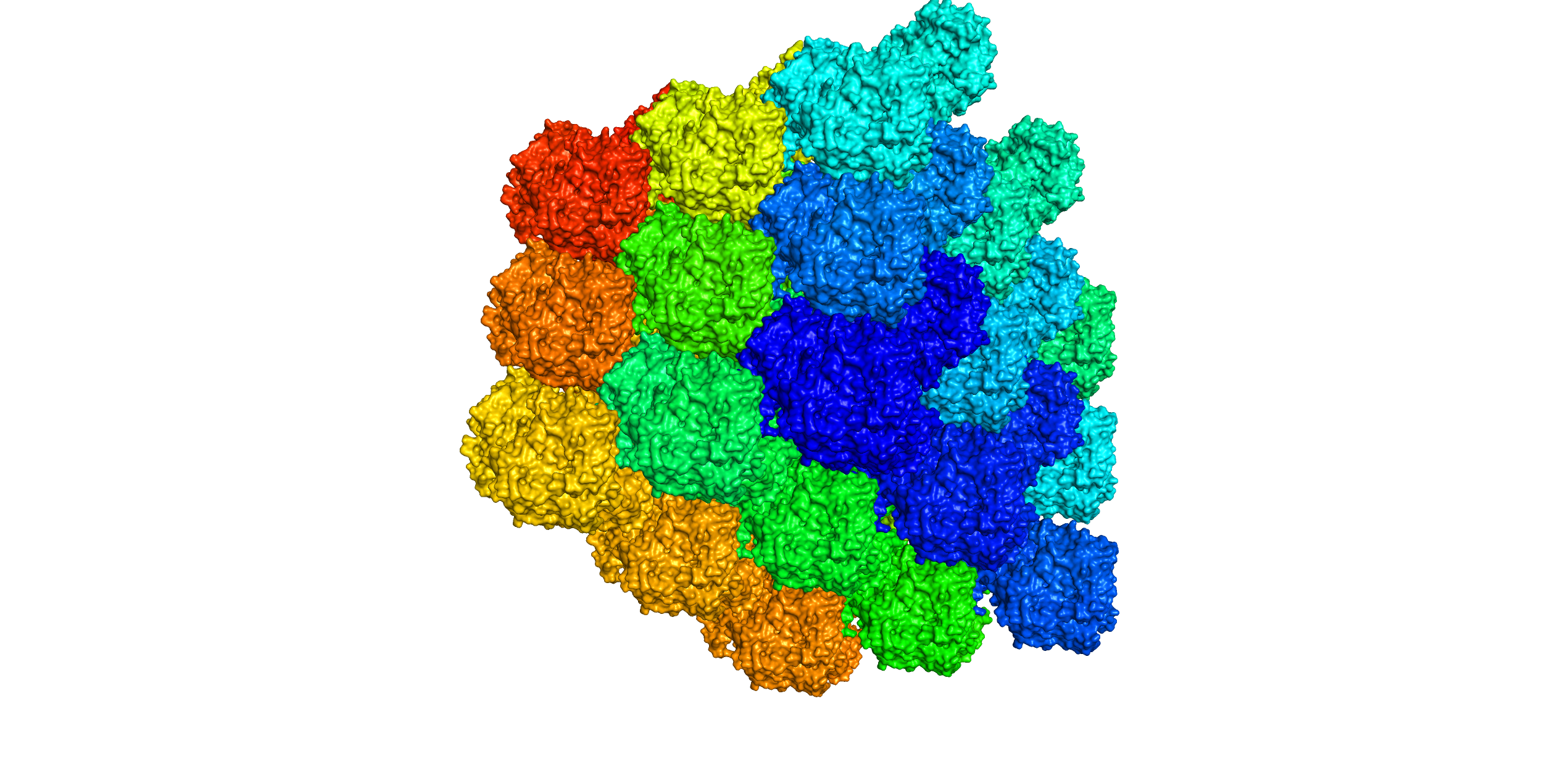
Рис. 7. Визуализация соседей структуры 3CV2 при уровне отсечки 100 Å, окрашенных "радугой".
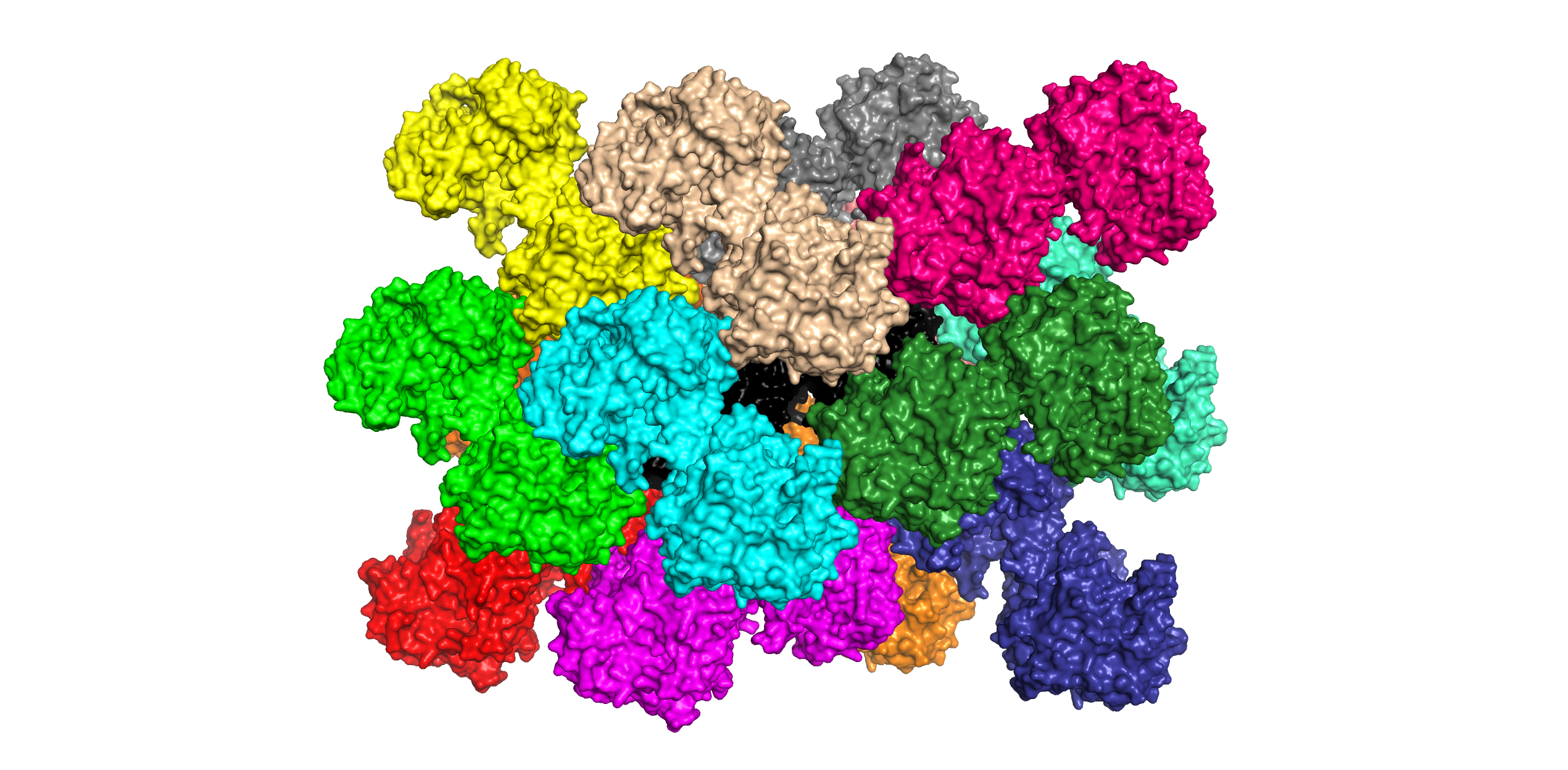
Рис. 8. Визуализация соседей структуры 3CV2, контактирующих с ней (всего 14 белков); исходный белок окрашен черным.
© Агаева Зара, 2020