В данном практикуме сравниваются две структуры апофермента DsbA (disulfide bond forming protein A), полученные с помощью методов РСА (PDB ID - 5QO9, resolution = 1.59 Å; для сравнения использовалась цепь B) и 1H ЯМР (PDB ID - 1A24, количество конформаций - 20).

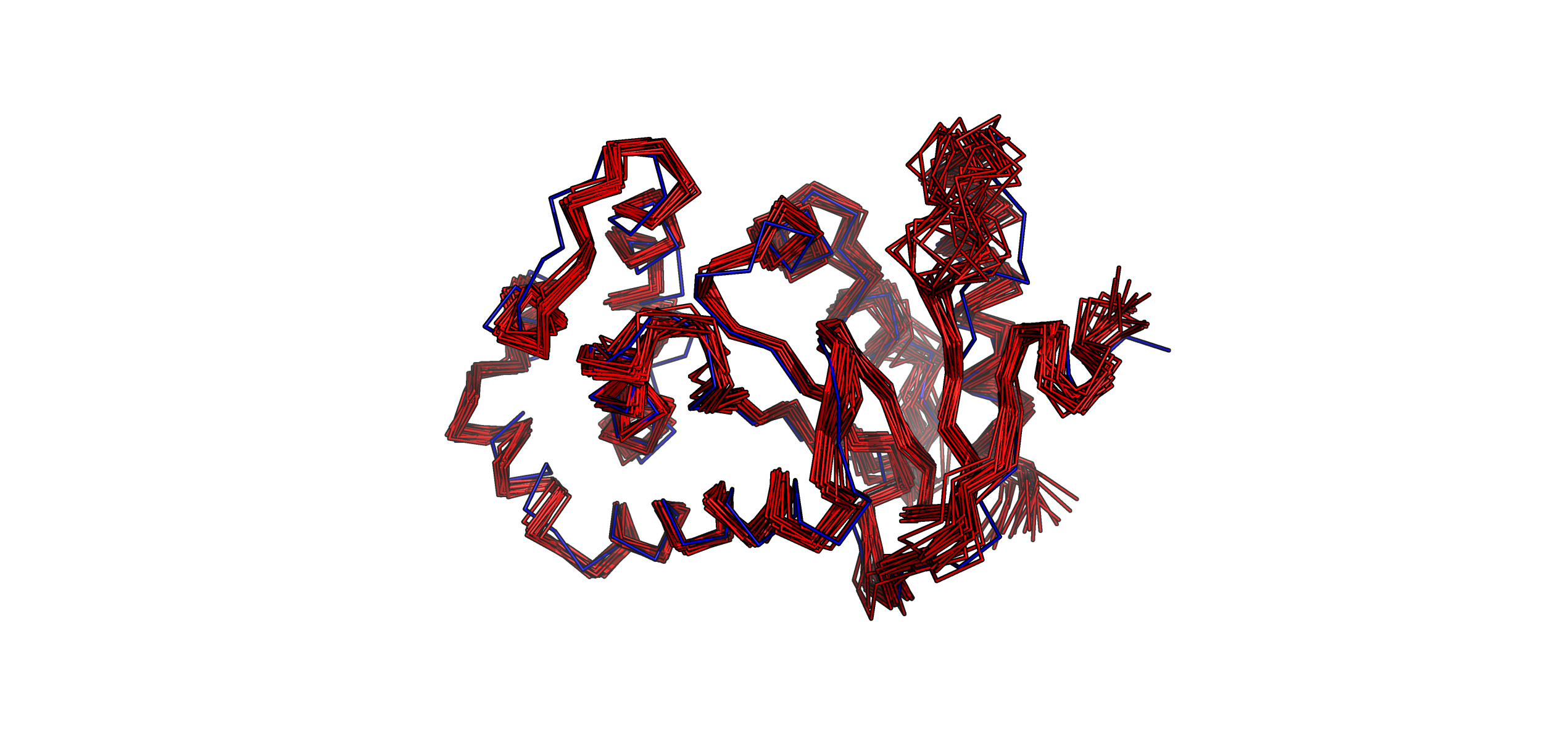
Рис. 1. Визуализация наложенных друг на друга структуры РСА (синее) и моделей ЯМР (красное).
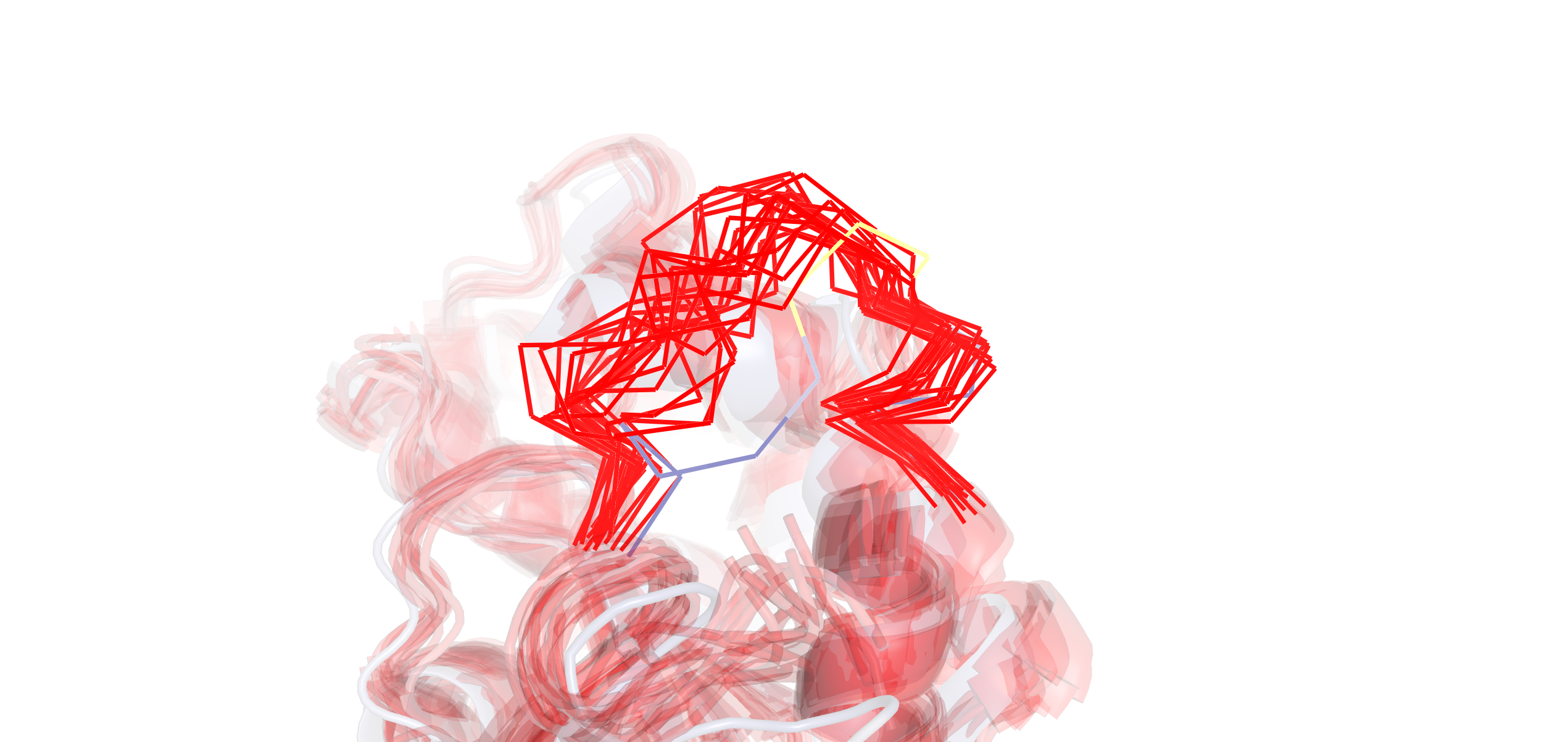
Рис. 2. Визуализация наложенных друг на друга структуры РСА (покрашено по b-фактору) и моделей ЯМР (красное) в области петли.
В первую очередь бросилось в глаза отсутвие молекул воды в структуре ЯМР (в отличие от РСА); это объясняется тем, что для ЯМР используется дейтерированный растворитель (не содержащий протонов и воды). В целом структура РСА и модели ЯМР не сильно расходятся (рис. 1), но есть отдельные участки, где расхождение достаточно заметно. Это наиболее заметно в петле, проиллюстрированной на рис. 2. Здесь и модели ЯМР сильно расходятся друг с другом. Вообще, это не обязательно значит, что данный участок очень подвижный, причина может заключаться в неточности измерений. Однако в нашем случае мы наблюдаем сильное отклонение петли в РСА структуре от моделей ЯМР, что говорит в пользу идеи о повышенной подвижности данного участка (тем более учитывая тот факт, что петля ориентированаво внешнюю среду и находится на периферии белка). С другой стороны, фрагмент петли, который сильнее всего отклонился от моделей ЯМР, судя по b-фактору, не похож на очень подвижный, скорее, на умеренно подвижный. Возможно, дело еще в искажении конформации петли из-за кристаллизациии белка при РСА.
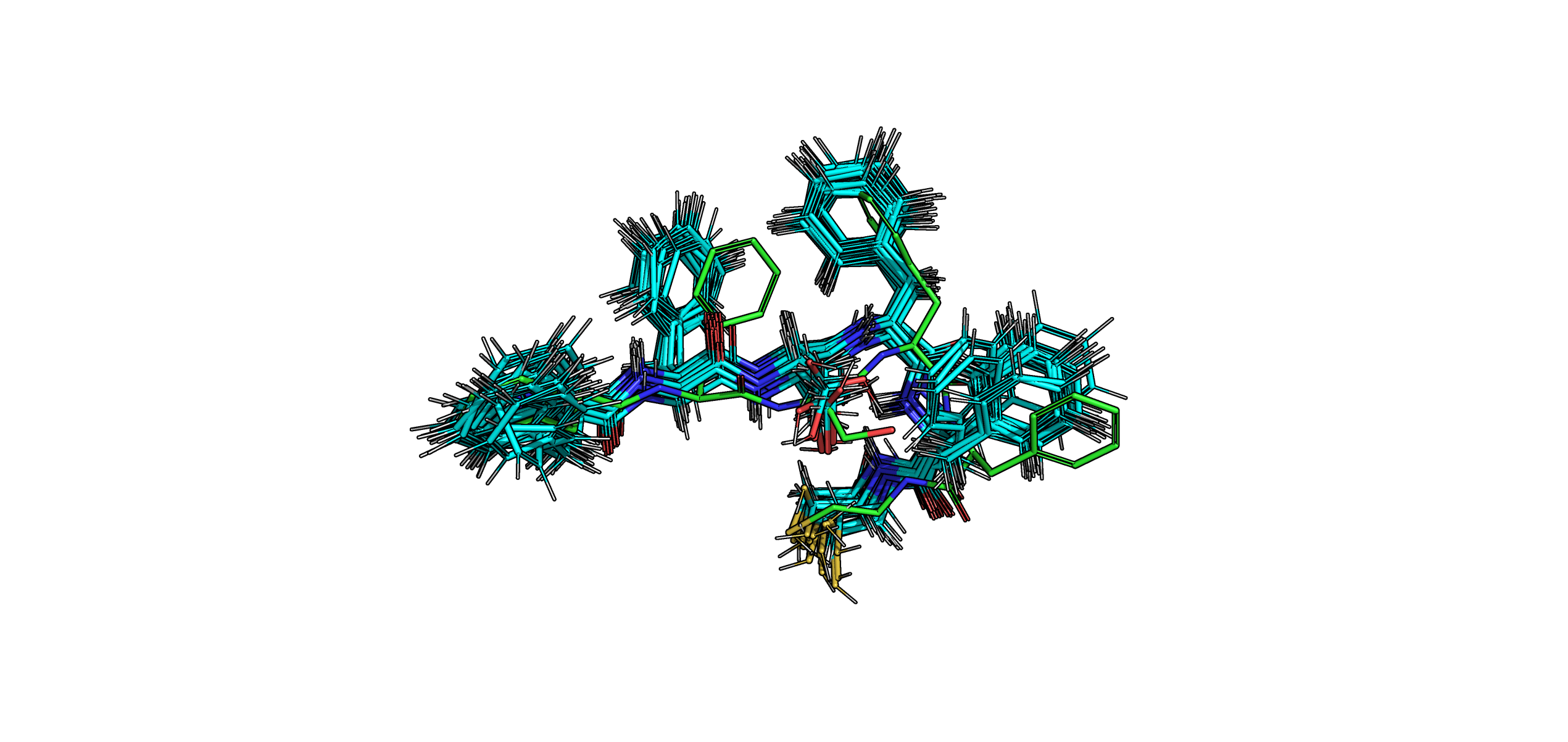
Рис. 3. Визуализация наложенных друг на друга структуры РСА (зеленое) и моделей ЯМР (бирюзовое) в области фрагмента белка с 25 по 30 а.о..
На рис. 3 изображен случайно выбранный фрагмент, находящийся в глубине белка. Видно, что ни остов, ни, в особенности, боковые цепи, полученные методом РСА и ЯМР не сходятся друг с другом на 100%. Примечательно наличие атомов водорода в моделях ЯМР, что логично, так как поиск их пространственного положения находится в основе 1H ЯМР.
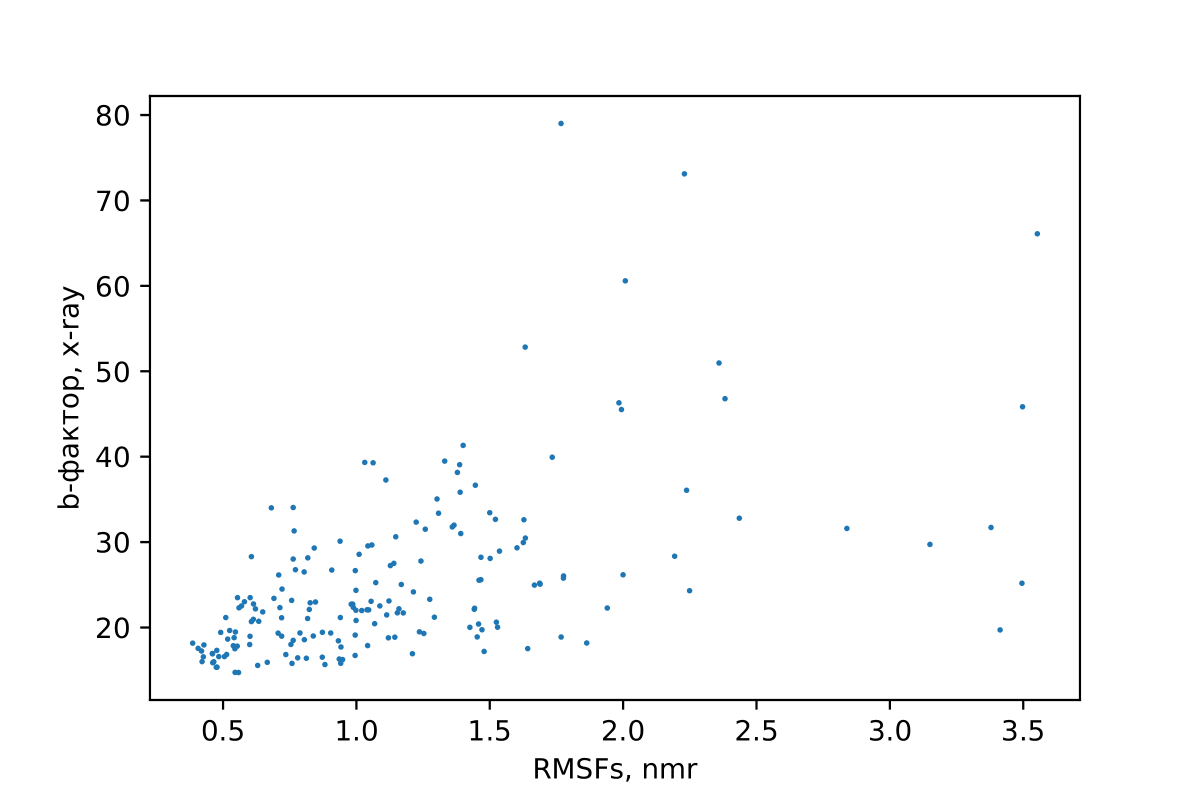
Рис. 4. Scatter-plot зависимости средних RMSF по остаткам в модели ЯМР от средних b-факторов остатков структуры РСА.
Судя по scatter-plot-у, изображенном на рис. 4, малым значениям RMSF для от остатка преимущественно соответстуют малые значения b-факторов, то есть участки, которые мы считаем малоподвижными, судя по методу ЯМР, в целом таковыми являются и в структуре РСА. Однако с увеличением средних RMSF такая зависимость теряется, и для фрагментов белка с высоким средним значением RMSF мы не можем наверняка утверждать, дело ли в высокой подвижности этих фрагментов или просто в погрешностях эксперимента ЯМР.
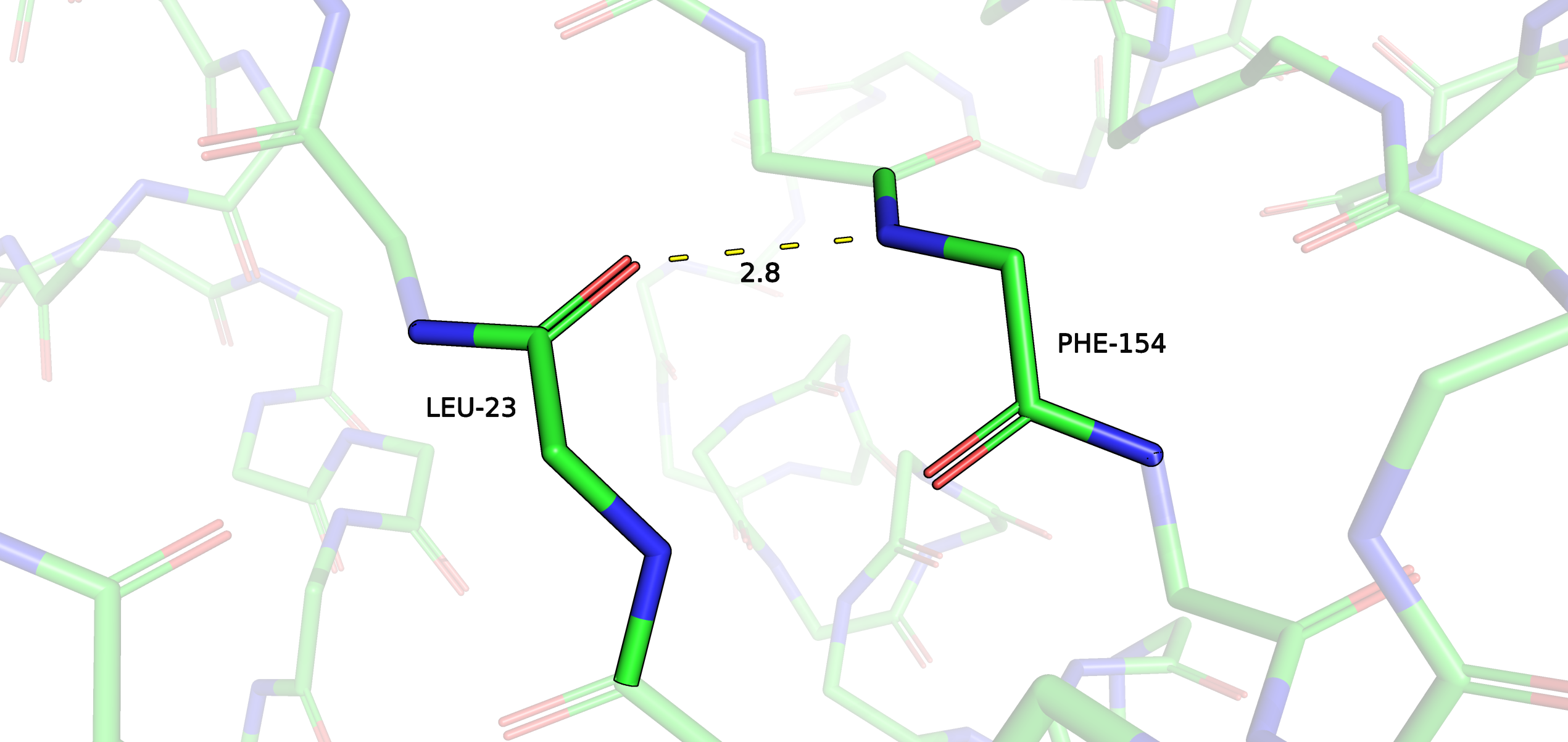
Рис. 5. Водородная связь в структуре РСА.
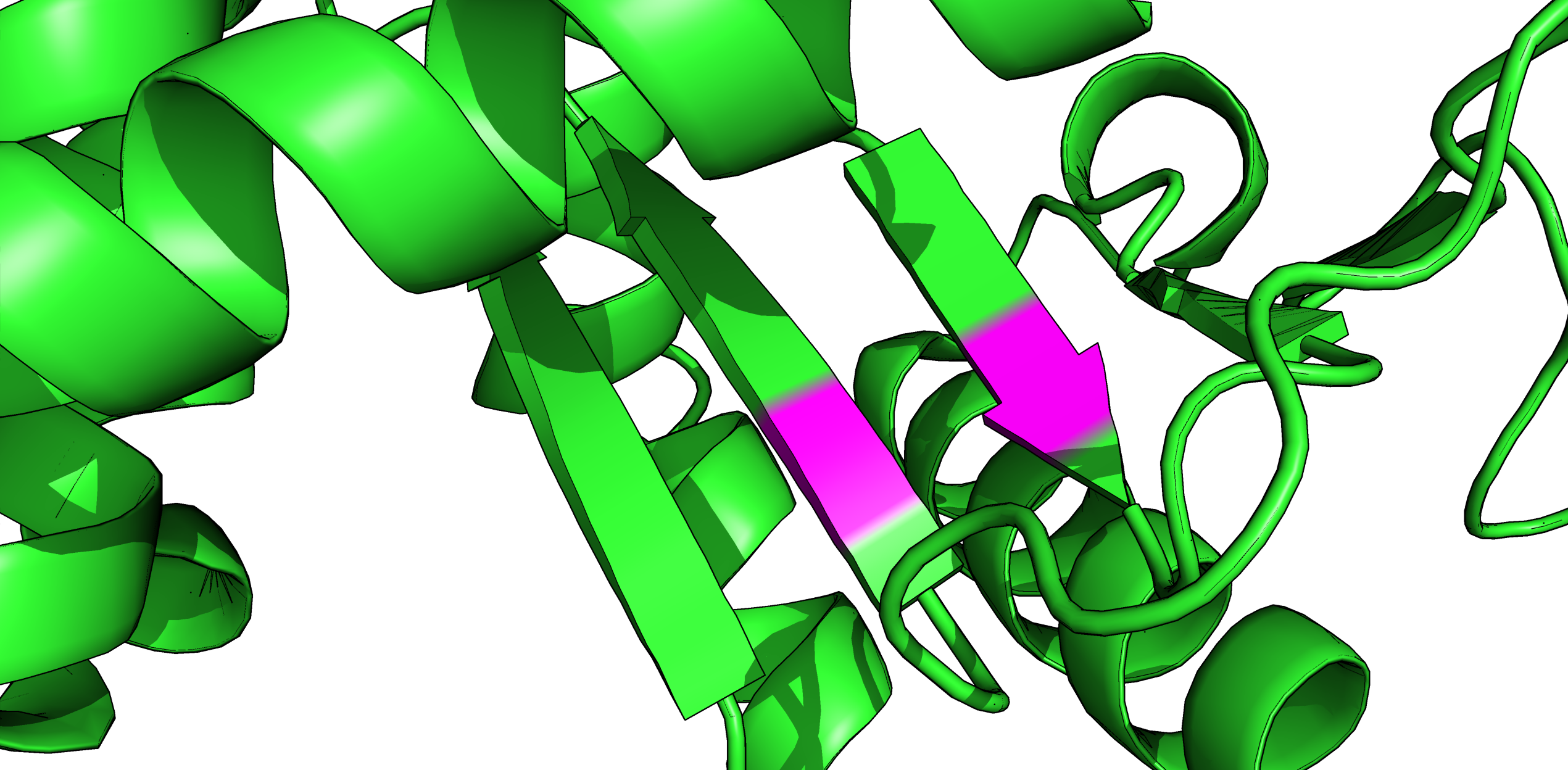
Рис. 6. Отображение вторичной структуры (РСА), содержащей образующие вод. связь остатки (покрашены фиолетовым).
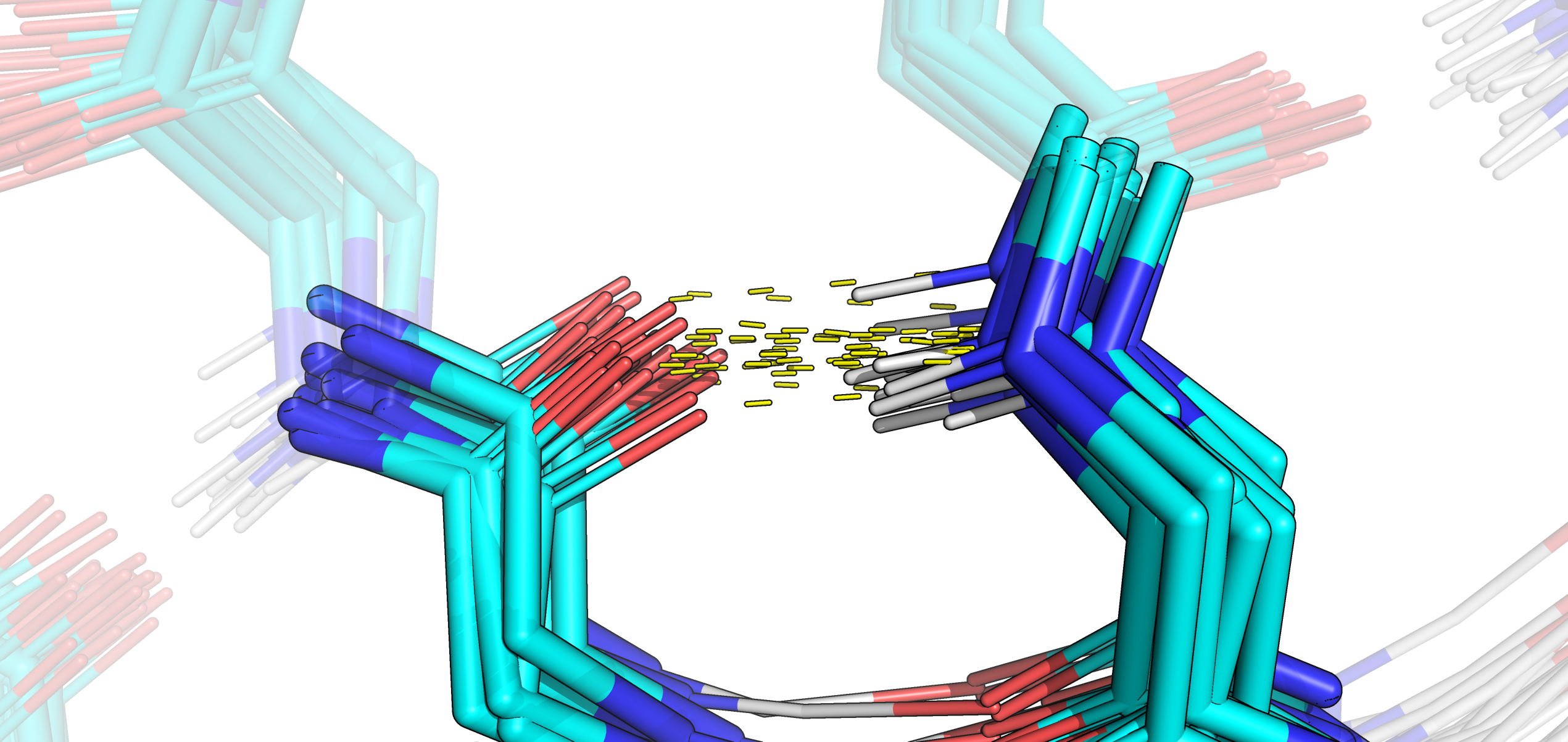
Рис. 7. Водородная связь в моделях ЯМР.
| Расстояние в структуре РСА, Å | Число и процент моделей ЯМР, содержащих вод. связь | Максимальное значение расстояния в ЯМР, Å | Минимальное значение расстояния в ЯМР, Å | Медианное значение расстояния в ЯМР, Å |
|---|---|---|---|---|
| 2.8 | 20, 100% | 3.0 | 2.5 | 2.9 |
ЯМР модели остова не так заметно отклоняются друг от друга, как модели боковых цепей (это мы наблюдали еще в задании 1 при сравнении структур РСА и ЯМР на микроуровне). Поэтому вполне закономерно, что водородная связь, обнаруженная в РСА структуре, сохранилась и в ЯМР моделях.
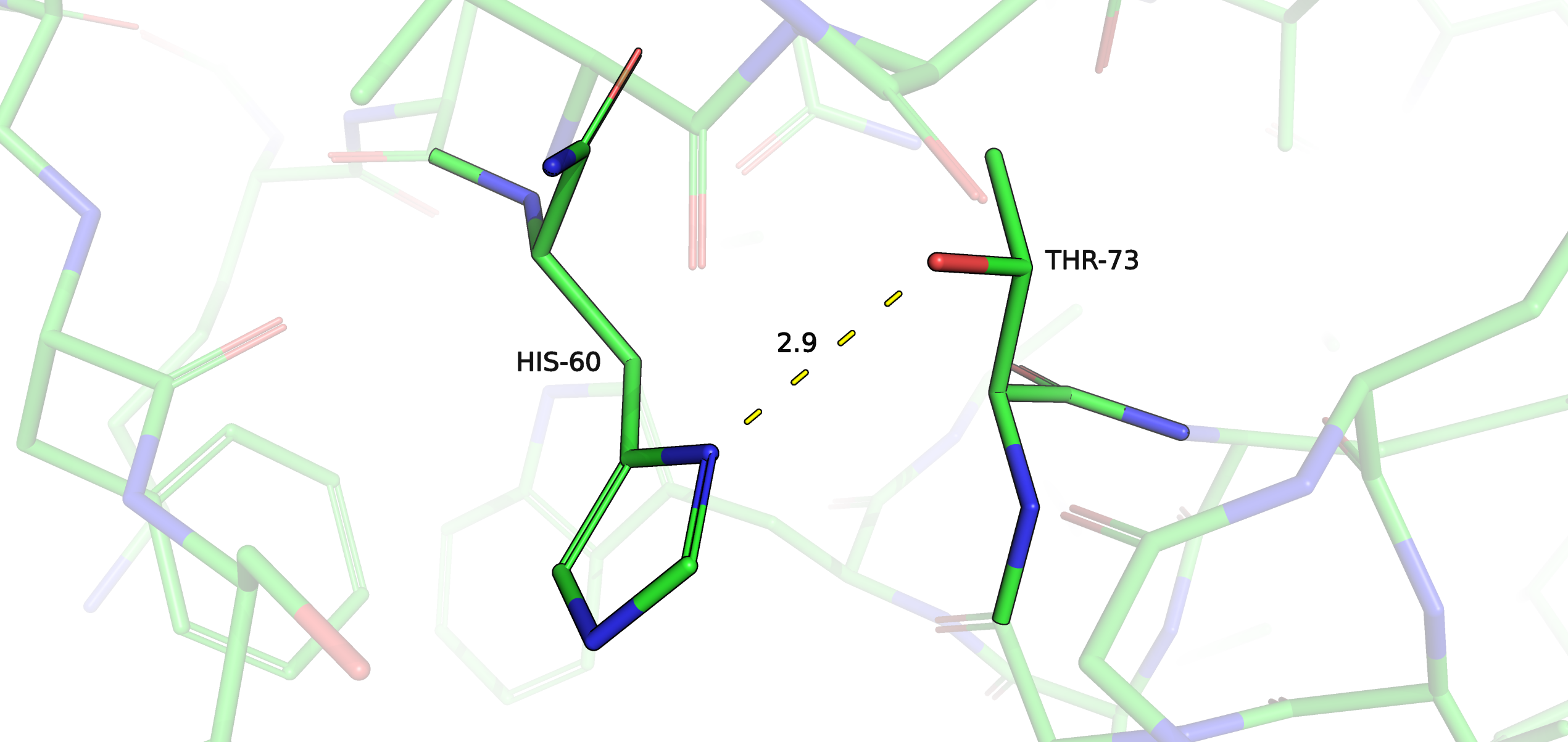
Рис. 8. Водородная связь в структуре РСА.
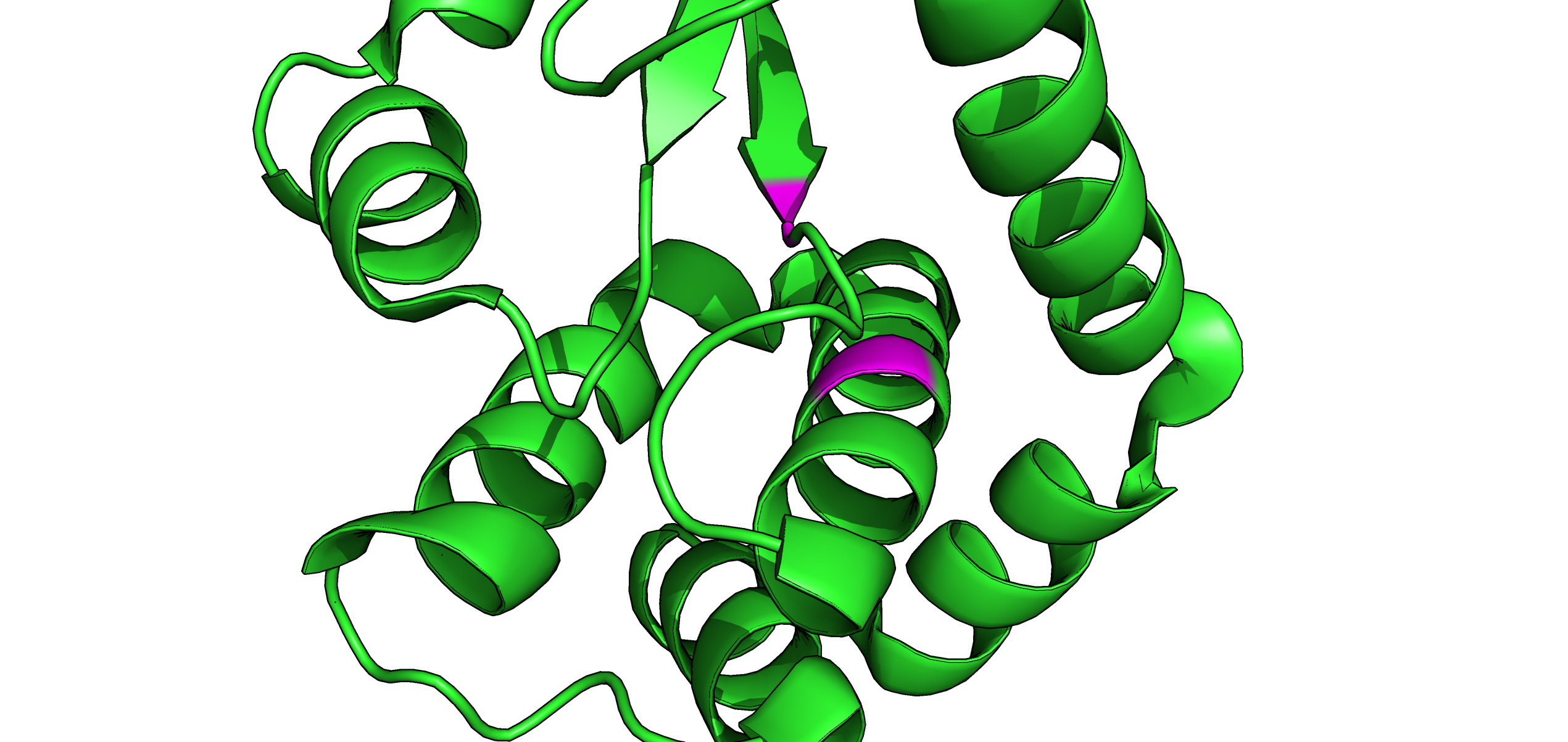
Рис. 9. Отображение вторичной структуры (РСА), содержащей образующие вод. связь остатки (покрашены фиолетовым).
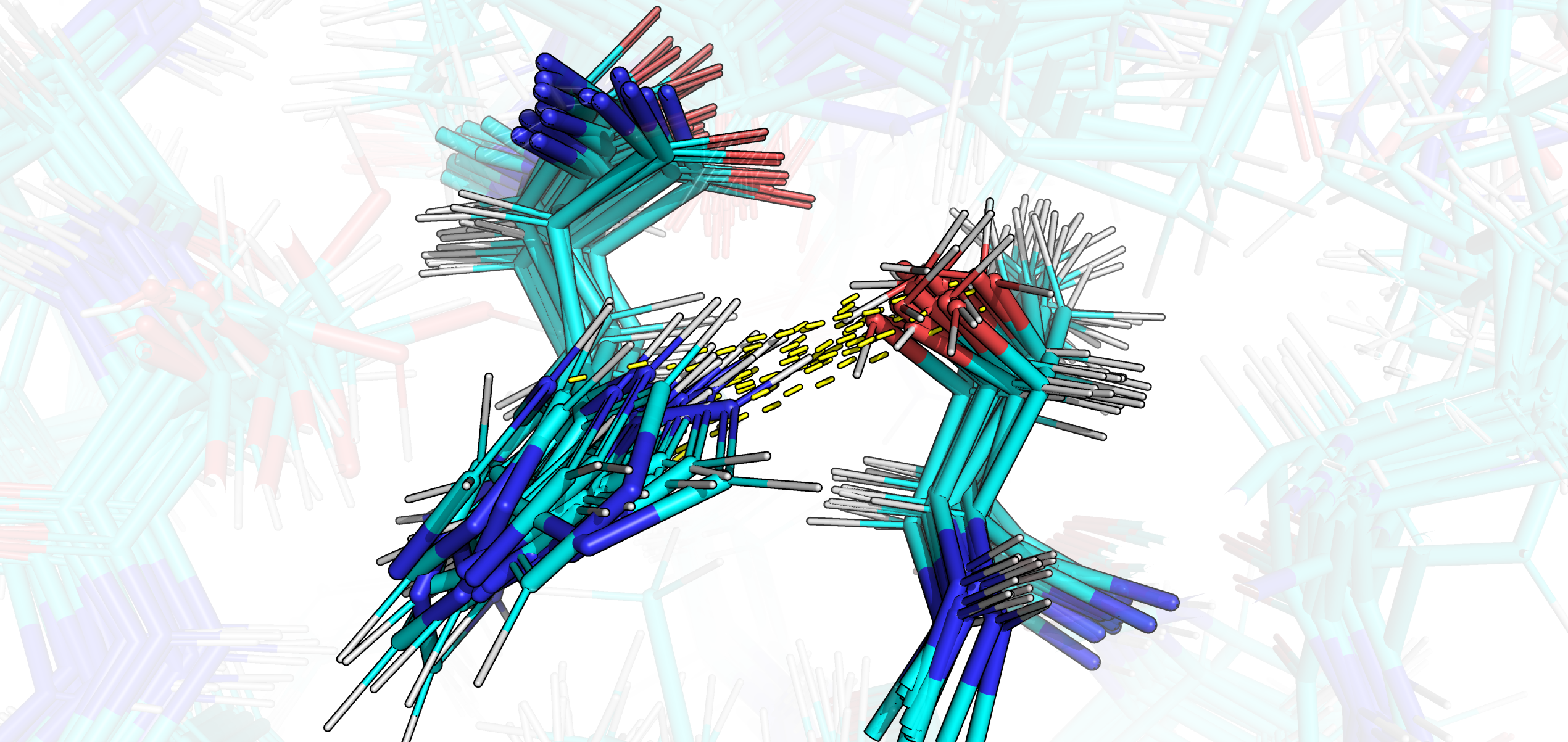
Рис. 10. Водородная связь в моделях ЯМР.
| Расстояние в структуре РСА, Å | Число и процент моделей ЯМР, содержащих вод. связь | Максимальное значение расстояния в ЯМР, Å | Минимальное значение расстояния в ЯМР, Å | Медианное значение расстояния в ЯМР, Å |
|---|---|---|---|---|
| 2.9 | 0, 0% | 6.1 | 2.5 | 4.5 |
Боковые цепи HIS 60 во всех ЯМР моделях значительно отклоняются от положения боковой цепи этого остатка в РСА структуре и ориентрированы в другую сторону; в основном длины предполагаемых водородных связей оказались знаичтельно больше, чем вообще оптимальная длина образования водородной связи. Исходя из этого и из соображений оптимальности углов предполагаемых водородных связей, я сделала вывод об отсутствии водородной связи между THR 73 и HIS 60 в моделях ЯМР. Стоит заметить также, что наличие двойной связи при π азоте в имидазольном кольце HIS 60 в моделях ЯМР (рис. 11А) выглядит странным: если допустить, что протонирование азотов на 3D модели верное, то двойные связи должны были бы быть расположены так, как изображено на рис. 11Б снизу справа.
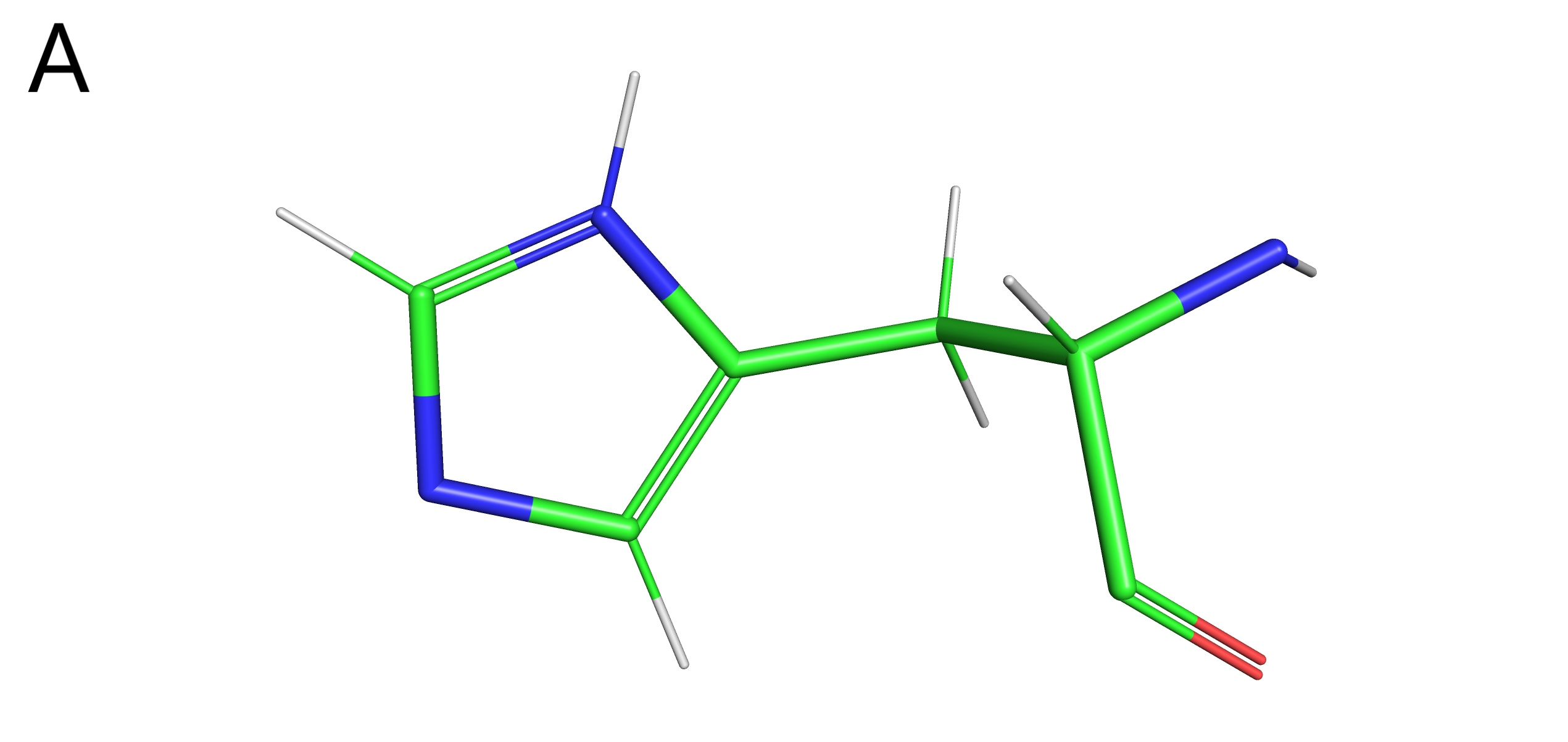
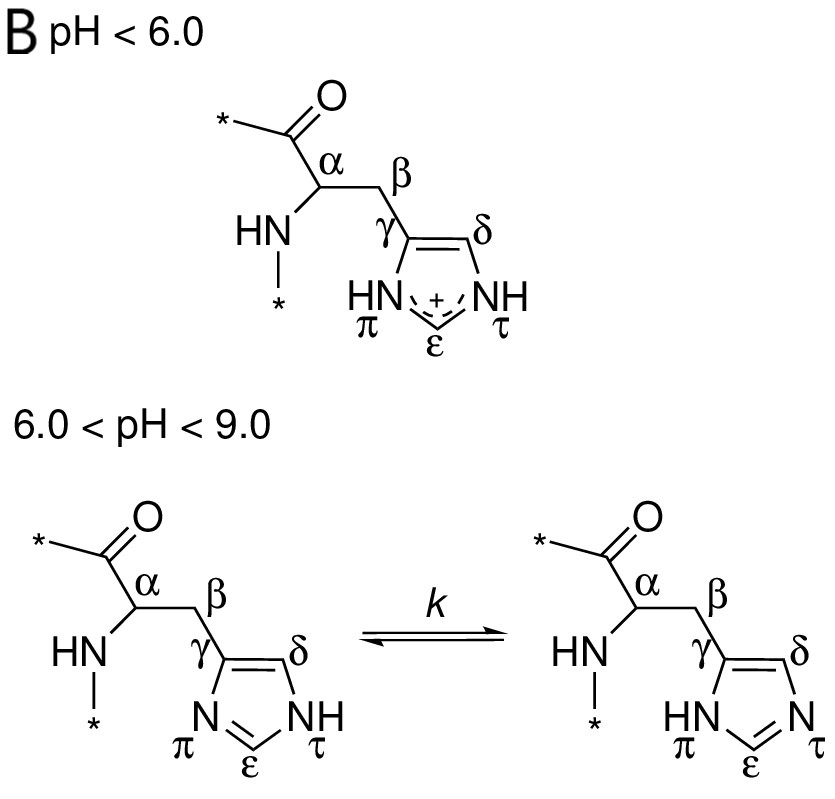
Рис. 11. Структурная формула гистидина. А: HIS-60 в модели ЯМР. B: таутомеры гистидина при различных значениях pH.
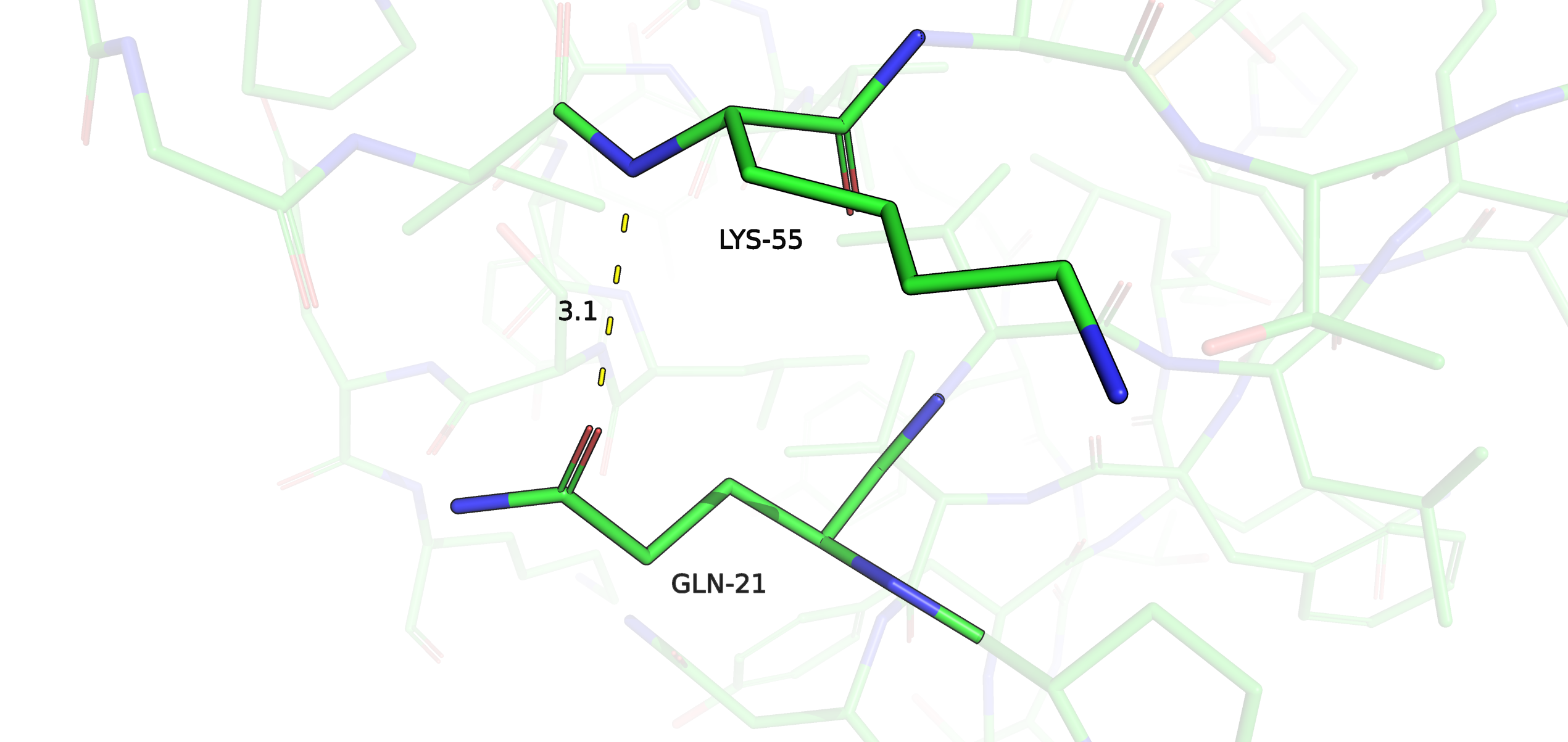
Рис. 12. Водородная связь в структуре РСА.
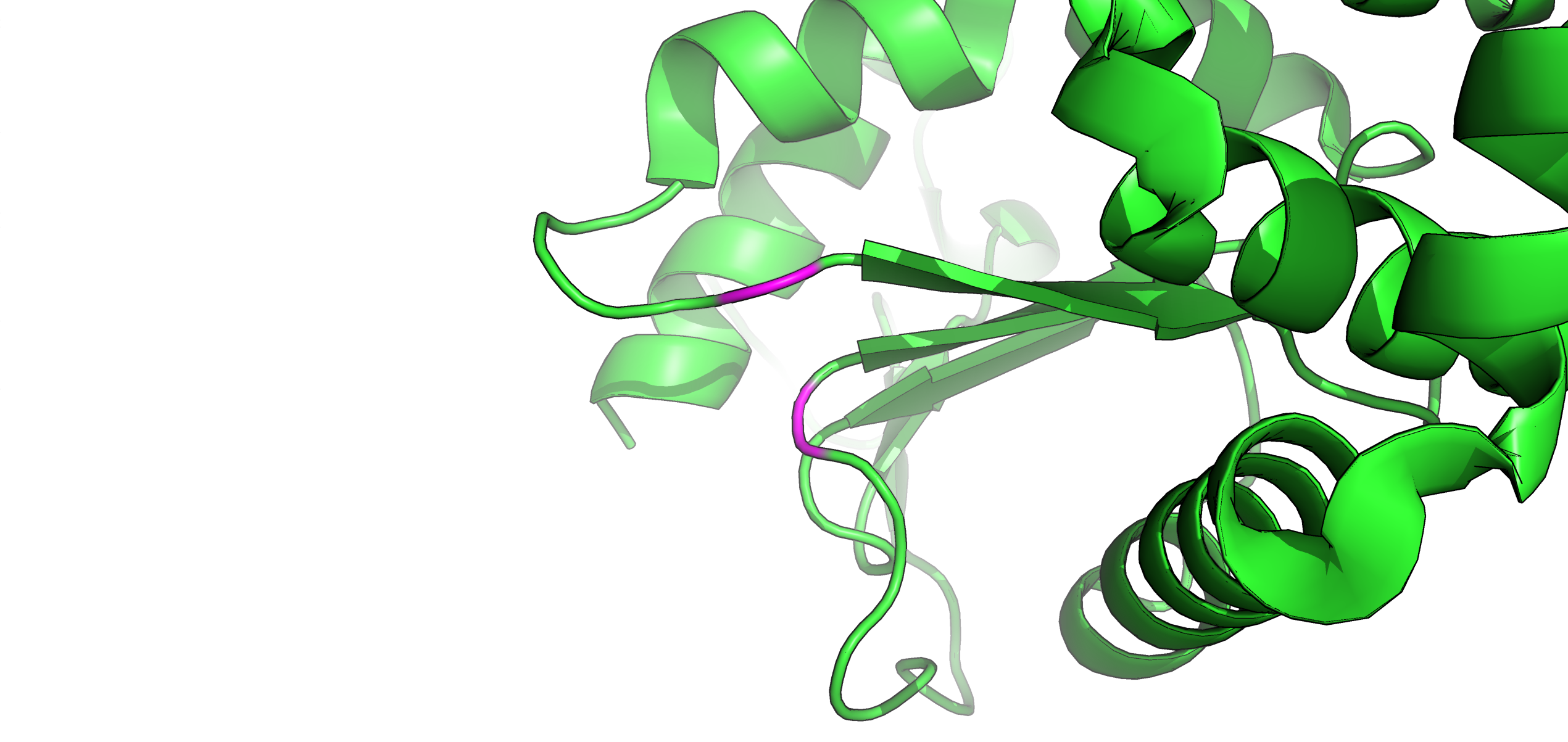
Рис. 13. Отображение вторичной структуры (РСА), содержащей образующие вод. связь остатки (покрашены фиолетовым).
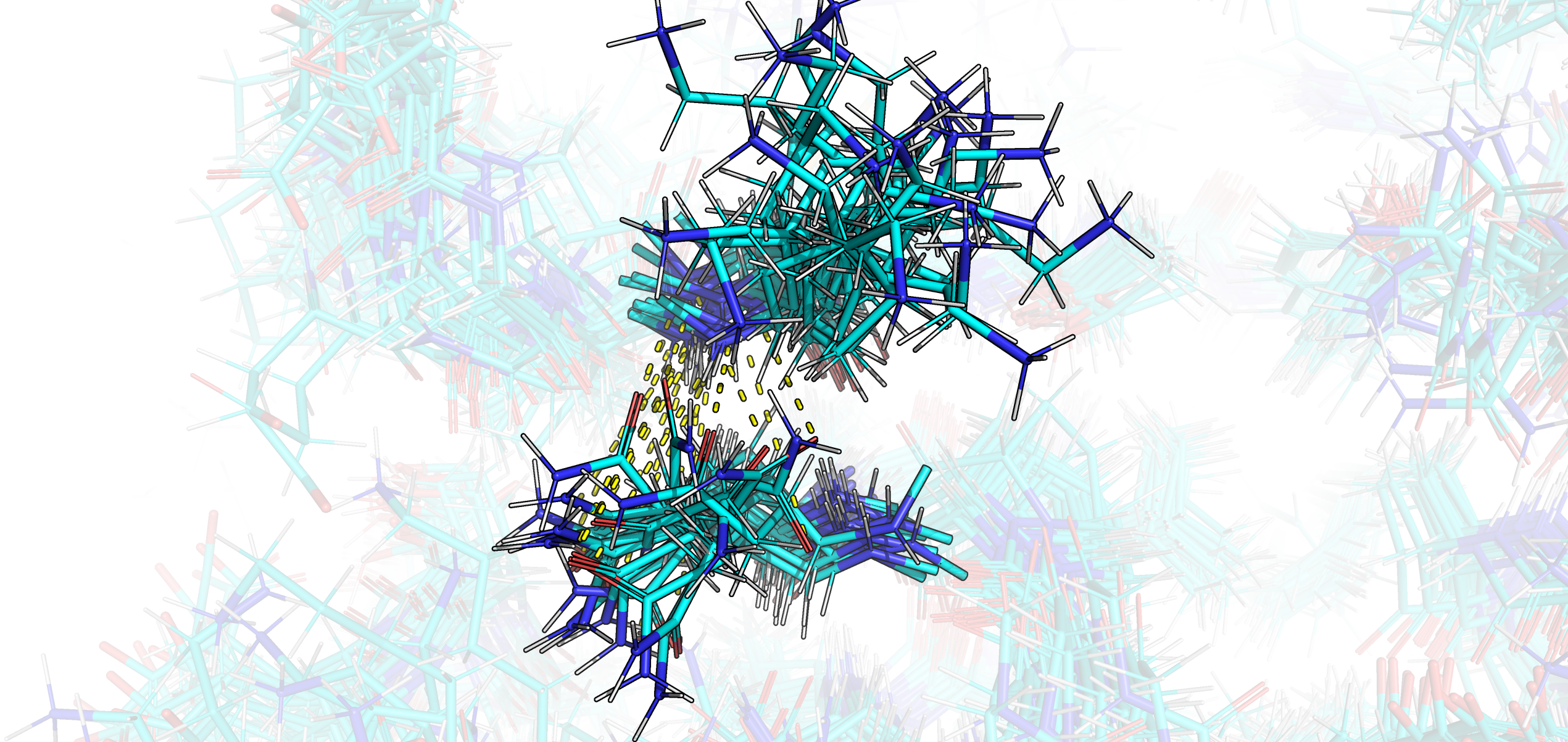
Рис. 14. Водородная связь в моделях ЯМР.
| Расстояние в структуре РСА, Å | Число и процент моделей ЯМР, содержащих вод. связь | Максимальное значение расстояния в ЯМР, Å | Минимальное значение расстояния в ЯМР, Å | Медианное значение расстояния в ЯМР, Å |
|---|---|---|---|---|
| 3.1 | 2, 10% | 6.4 | 2.4 | 5.2 |
Только две модели ЯМР оказались ориентированы так, что боковая цепь GLN 21 стала доступной для образования водородной связи с LYS 55. Причем, в случае боковой цепи HIS 60, находящейся в глубине белка, во всех моделях ЯМР она хоть и отклонялась сильно от таковой в структуре РСА, но среди разных моделей ЯМР принимала преимущественно одинаковое положение. А в данной ситуации, когда остаток находится на подвижной петле на периферии белка, его боковая цепь в разных моделях ЯМР ориентирована совершенно по-разному. Позиция азота LYS 55 как остовного атома не сильно варьирует в моделях ЯМР.
© Агаева Зара, 2020