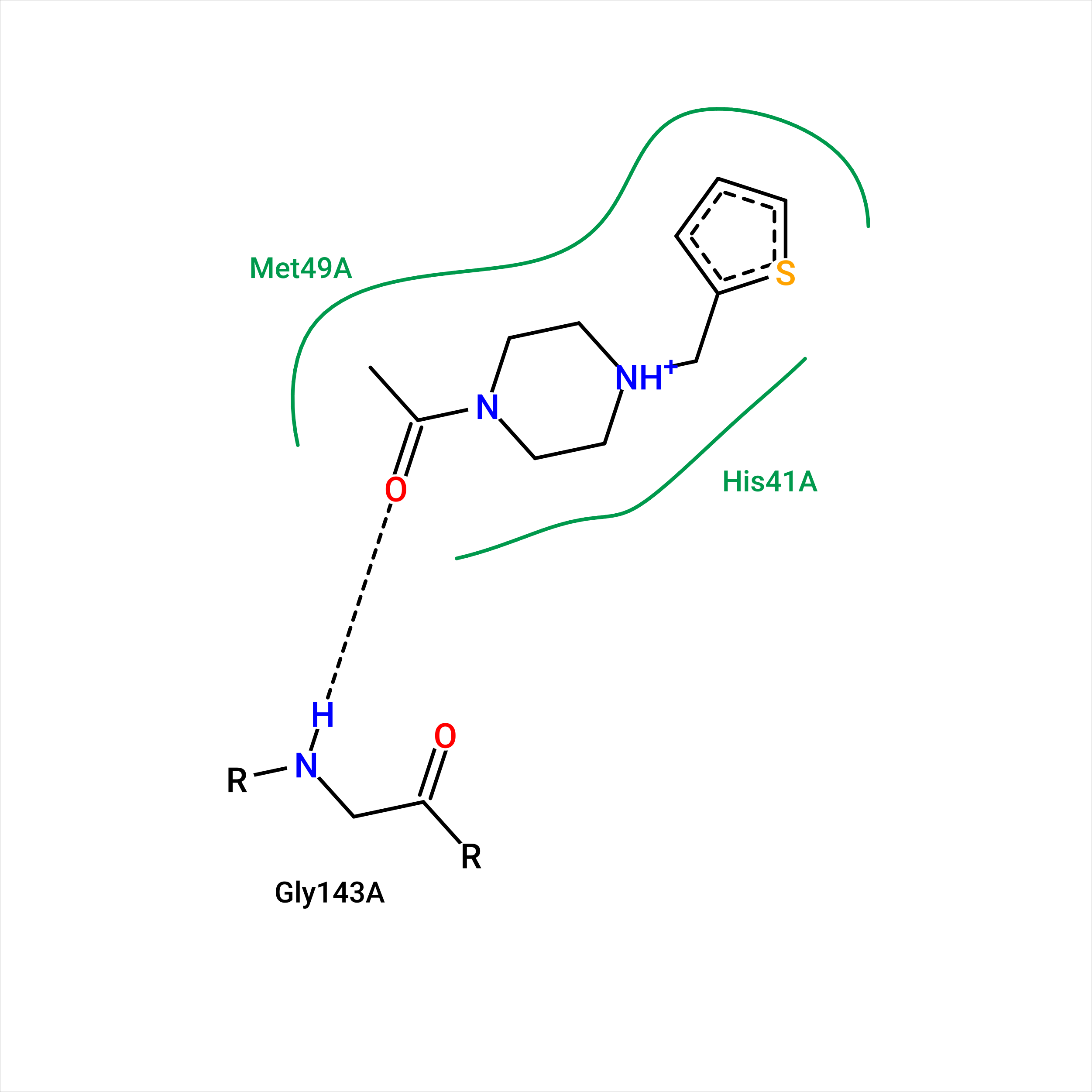
В структуре, по которой я делала задания первого практикума, не оказалось лигандов кроме молекул DMSO, поэтому по совету преподавателя я использовала для данного задания структуру 5RHA. Соответственно, сравнивать вывод PoseView мне не с чем. Как видно на рис. 1, программа посчитала, что HIS-41 и MET-49 образуют гидрофобное окружение лиганду T8M, а кислород в составе лиганда образует водородную связь с остовным азотом GLY-143. От себя бы я добавила водородную связь кислорода лиганда с остовным азотом CYS-145 (рис. 2), ее геометрия даже лучше, чем у связи с GLY-143. Также я не уверена в гидрофобных взаимодействиях с HIS-41: все-таки он полярный, неполярная его часть достаточно мала, чтобы она вносила серьезный вклад в гидрофобное взаимодействие. Кажется, имидазольное кольцо гистидина может образовывать T-стэкинг с пятичленным кольцом лиганда, но навряд ли это взаимодействие здесь сильно: кольца не очень близко находятся друг к другу (5.1 Å между центрами колец), и они немного смещены относительно друг друга.

Рис. 1. Вывод веб-сервиса PoseView о взаимодействиях лиганда T8M со своим окружением в структуре 5RHA; сплошные зеленые линии - гидрофобные взаимодействия, пунктирная линия - водородная связь.
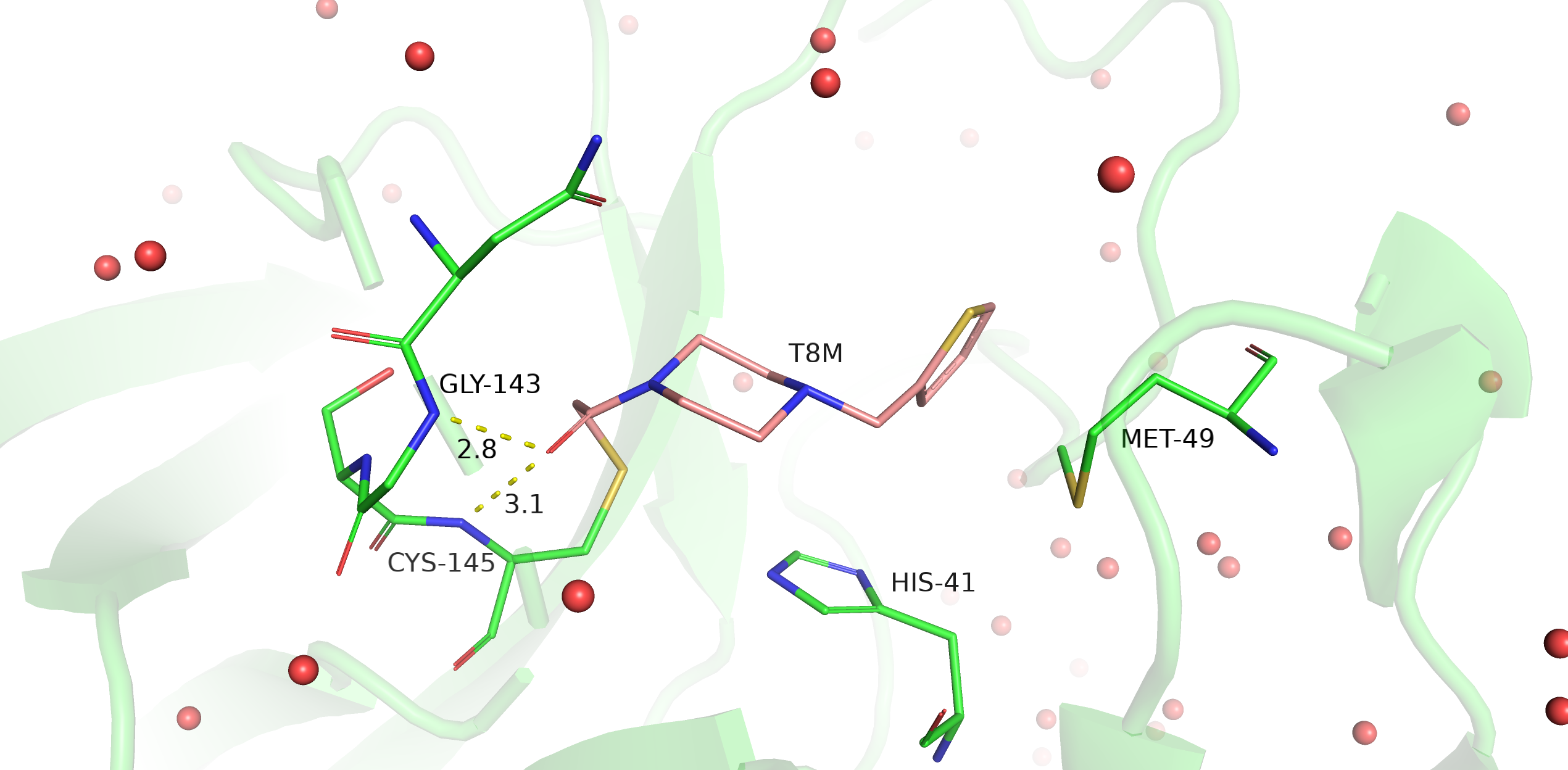
Рис. 2. Визуализация лиганда T8M и его окружения в структуре 5RHA; желтые пунктирные линии - водородные связи.
Исходный остаток 101 антигена модели 0013 назовем, который необходимо определить, назовем остатком Х. Судя по всему, его боковая цепь направлена вовне комплекса и потенциально может взаимодействовать с окружающими остаток X TYR-97, ASP-98, TYR-99. ASP-98 - отрицательно заряженная аминокислота, поэтому можно ожидать, что остаток X заряжен положительно. Если говорить о TYR-97 и TYR-99, то остаток X может образовывать различные виды стэкинга с их фенольными кольцами; теоретически, кольца могут вступать и в гидрофобные взаимодействия (то есть остаток X - гидрофобный), но мне кажется это маловероятным, учитывая отсутствие гидрофобного кармана вокруг остатка Х: он смотрит на поверхность, а не в глобулу, что говорит скорее о гидрофильности. Также, боковые цепи TYR-97, TYR-99 и ASP-98 потенциально могут образовывать водородные связи с остатком Х. Таким образом, зная свойства окружения остатка Х, можно предположить его возможные варианты: полярный незаряженный, ароматический и заряженный (причем желательно положительно).
Далее рассмотрены те варианты остатка Х из вышеуказанных предпочитаемых классов аминокислот, которые показались мне наиболее убедительными. Здесь не приведены остатки, ротамеры которых либо вообще не взаимодействовали с остатком Х, либо для которых клэш (пересечение ван-дер-ваальсовых сфер) с остатком Х был слишком велик. К таким остаткам относятся, к примеру, все 3 таутомерные формы гистидина, для ротамеров которых была характерна или слишком большая стерическая напряженность, или отсутствие взаимодействий с остатком Х вовсе.
| Тип остатка | Набор ротамера | Стерическая напряженность (strain) | Представленность | Визуализация | Типы взаимодействий остатка X с окружением |
|---|---|---|---|---|---|
| Arg | 15/29 | 25.85 | 2.2% | 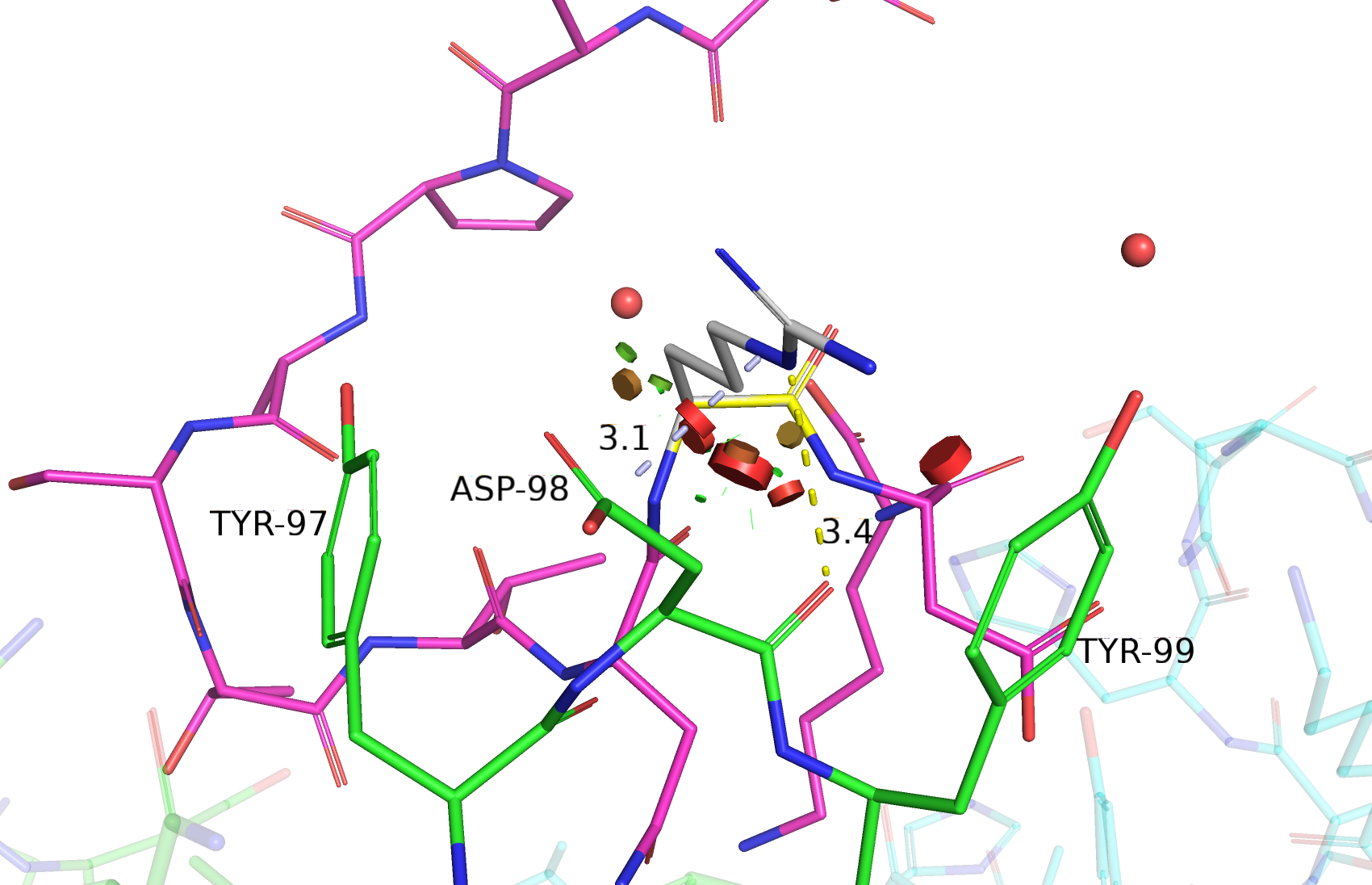 |
Солевой мостик с ASP-98 и водородная связь с его остовным кислородом. |
| Lys | 7/19 | 33.31 | 4.0% | 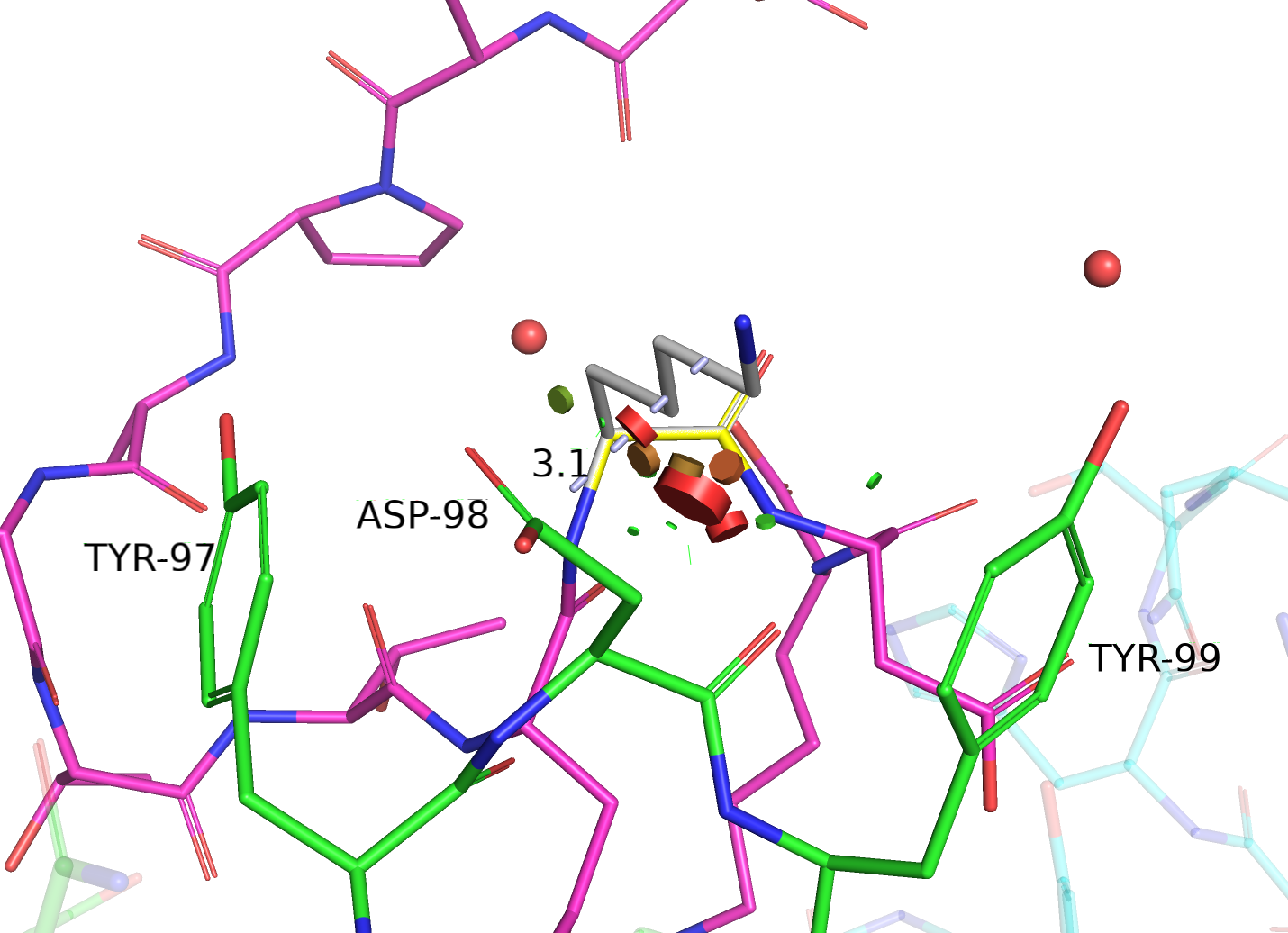 |
Солевой мостик с ASP-98. |
| Asn | 1/11 | 23.39 | 55.3% | 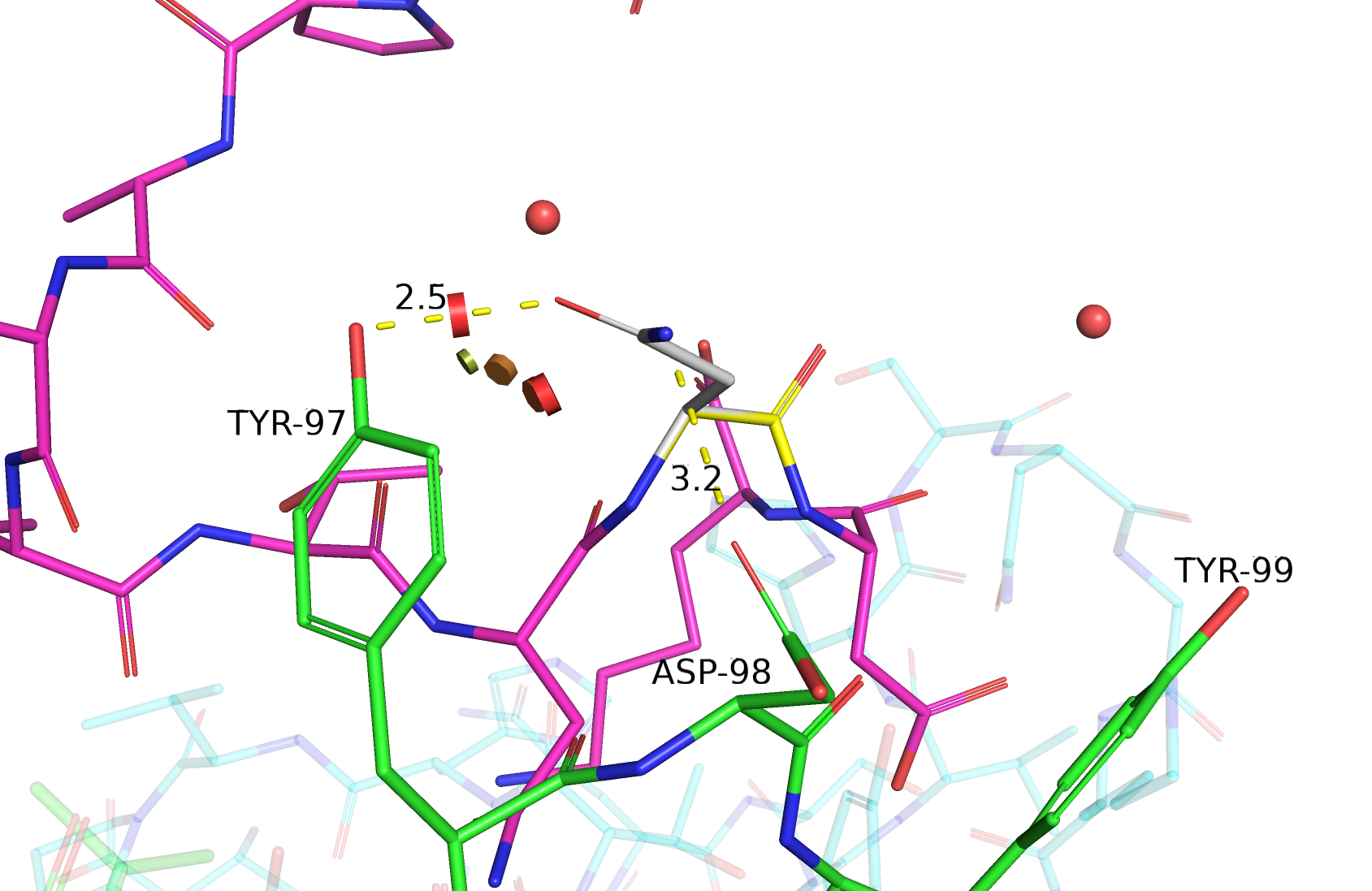 |
Две водородные связи: одна - с кислородом боковой цепи TYR-97, другая - с кислородом боковой цепи ASP-98 (геометрия не очень хорошая). |
| Ser | 1/3 | 30.03 | 59.6% | 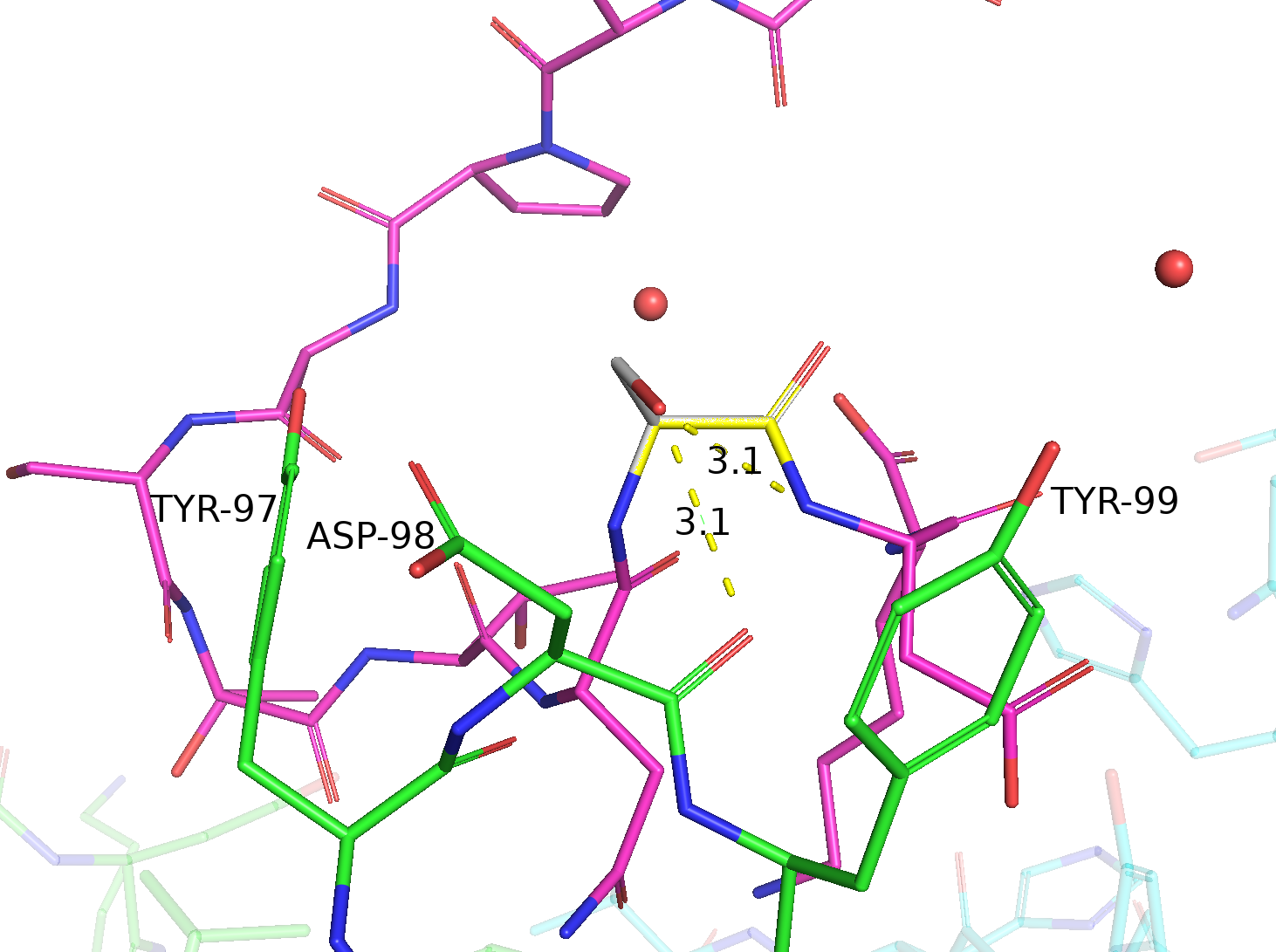 |
Две водородные связи: одна - с остовным кислородом ASP-98, другая - с остовным азотом ASP-102 на цепи антигена (довольно слабая из-за плохой геометрии). |
| Thr | 2/2 | 38.8 | 42.7% | 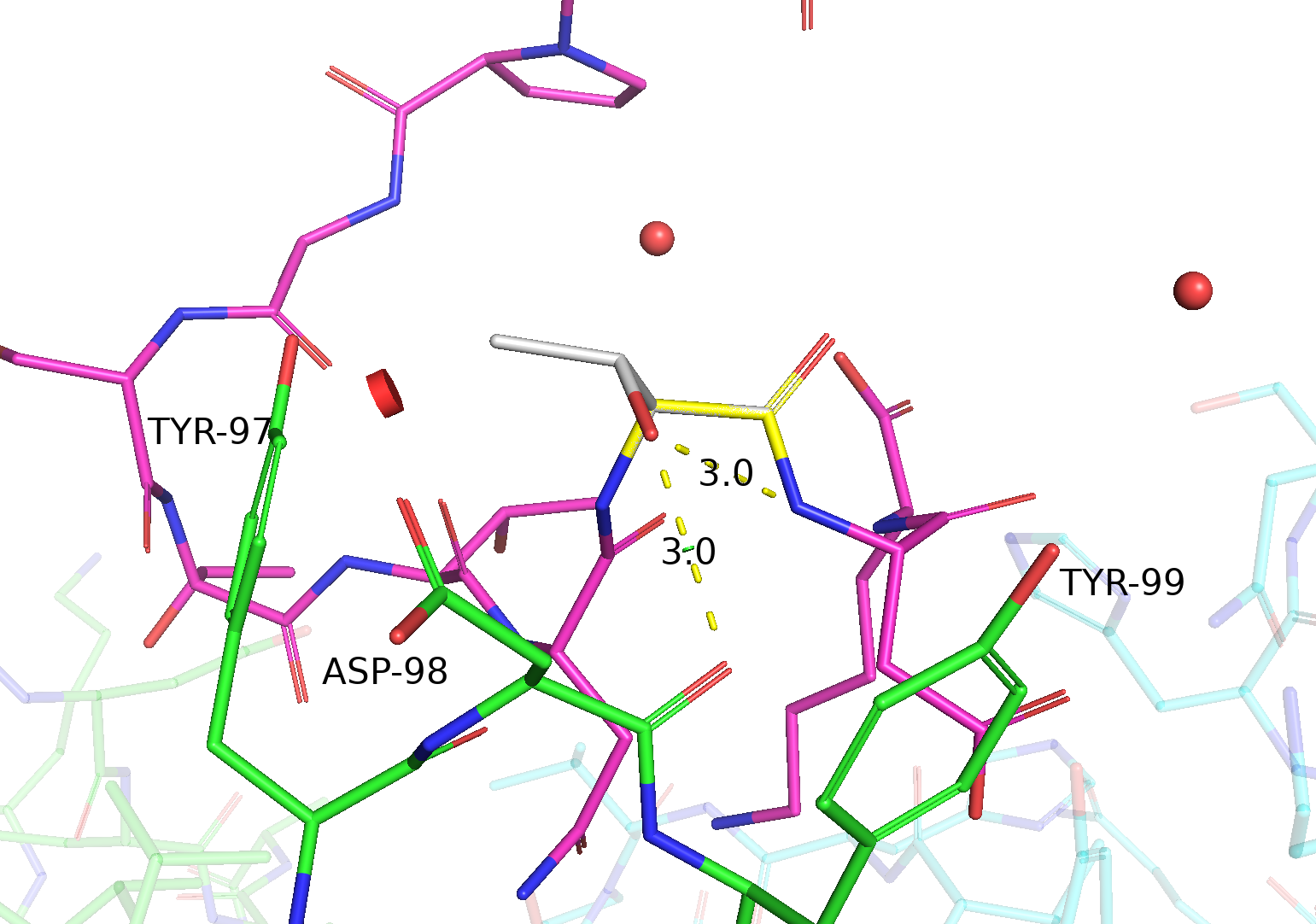 |
Две водородные связи: одна - с остовным кислородом ASP-98, другая - с остовным азотом ASP-102 на цепи антигена (довольно слабая из-за плохой геометрии). |
Приведенные выше ротамеры серина и треонина имеют высокий процент представленности, да и клэша практически нет. Но взаимодействие происходит с остовным атомом остатка в паратопе, а не с атомом боковой цепи, то есть нет специфичности связывания остатка Х, поэтому варианты серина и треонина отметаются. Если говорить про ротамер аспарагина, то, хоть значение его strain и меньше чем strain аргинина и лизина, а представленность больше, он незаряженный, а хотелось бы электростатических взаимодействий, раз рядом есть отрицательный ASP-98. Выбрать между лизином и аргинином сложно, но strain для ротамера аргинина меньше, чем для ротамера лизина, и он образует, помимо солевого мостика, водородную связь. Для позиции Х структуры 0013 выберу аргинин.
Исходный остаток 16 антигена модели 0082 назовем, который необходимо определить, назовем остатком Y. В данном случае остаток смотрит вовнутрь комплекса, в свой карман связывания. На мой взгляд, здесь остатками, потенциально способными взаимодействовать с остатком Y, являются остатки ASP-96, THR-30, TYR-31, THR-32, цепи B, TYR-104 цепи А и близлежащие к остатку Y молекулы воды. Соответственно, остаток Y, предположительно, относится к одному из следующих классов аминокислот: полярные незаряженные, ароматические, заряженные (желательно положительно).
Здесь рассмотрены мною наиболее интересные, на мой взгляд варианты аминокислот, которые могли бы быть остатком Y. Многие кандидаты отмелись просто потому, что не влезли в этот карман связывания.
| Тип остатка | Набор ротамера | Стерическая напряженность (strain) | Представленность | Визуализация | Типы взаимодействий остатка X с окружением |
|---|---|---|---|---|---|
| Thr | 2/2 | 38.96 | 11.6% | 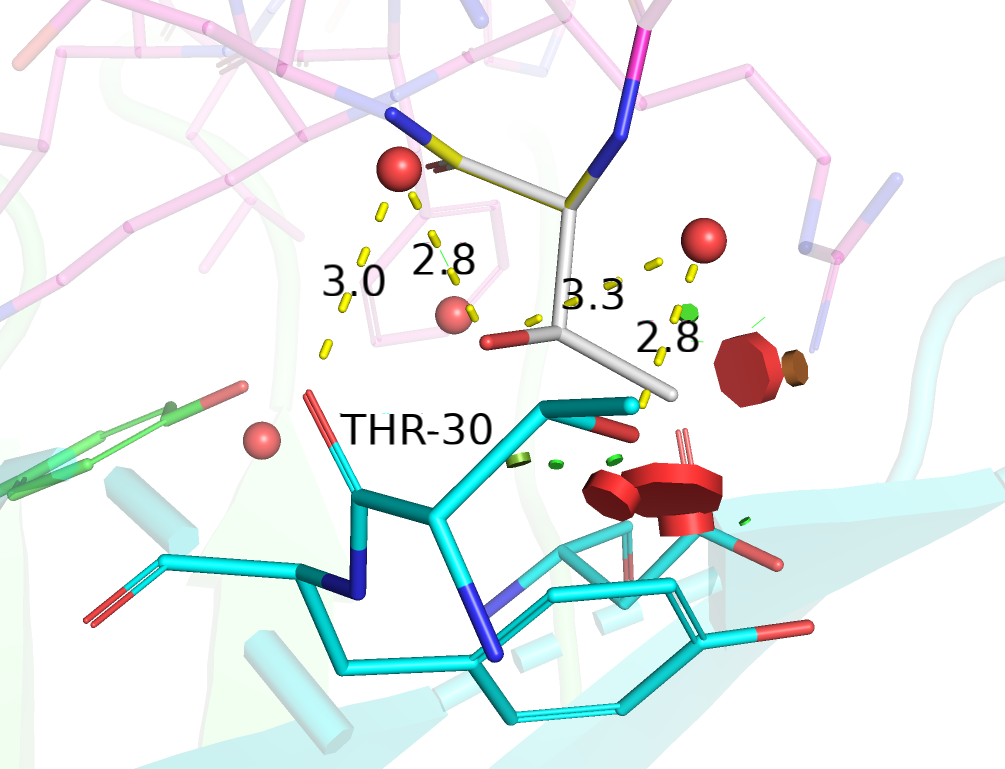 |
Взаимодействие через водяные мостики с остовным кислородом и кислородом боковой цепи THR-30. |
| Ser | 2/3 | 26.58 | 30.2% | 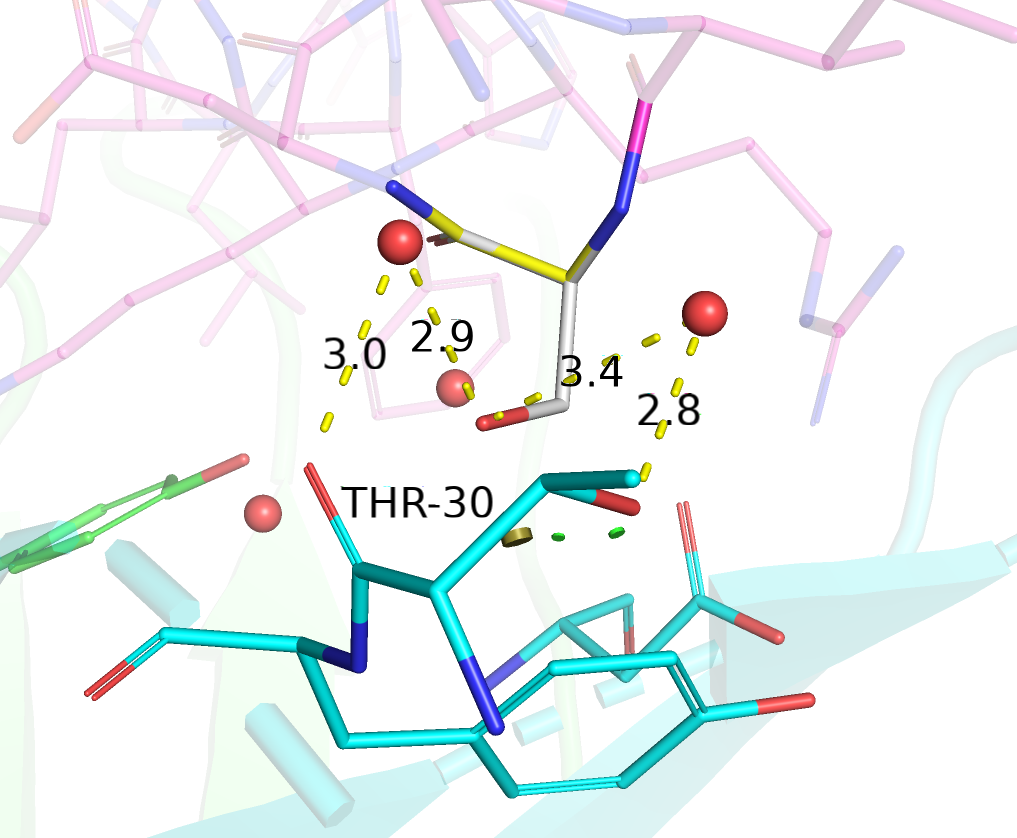 |
Взаимодействие через водяные мостики с остовным кислородом и кислородом боковой цепи THR-30.. |
| His | 4/7 | 24.77 | 16.0% | 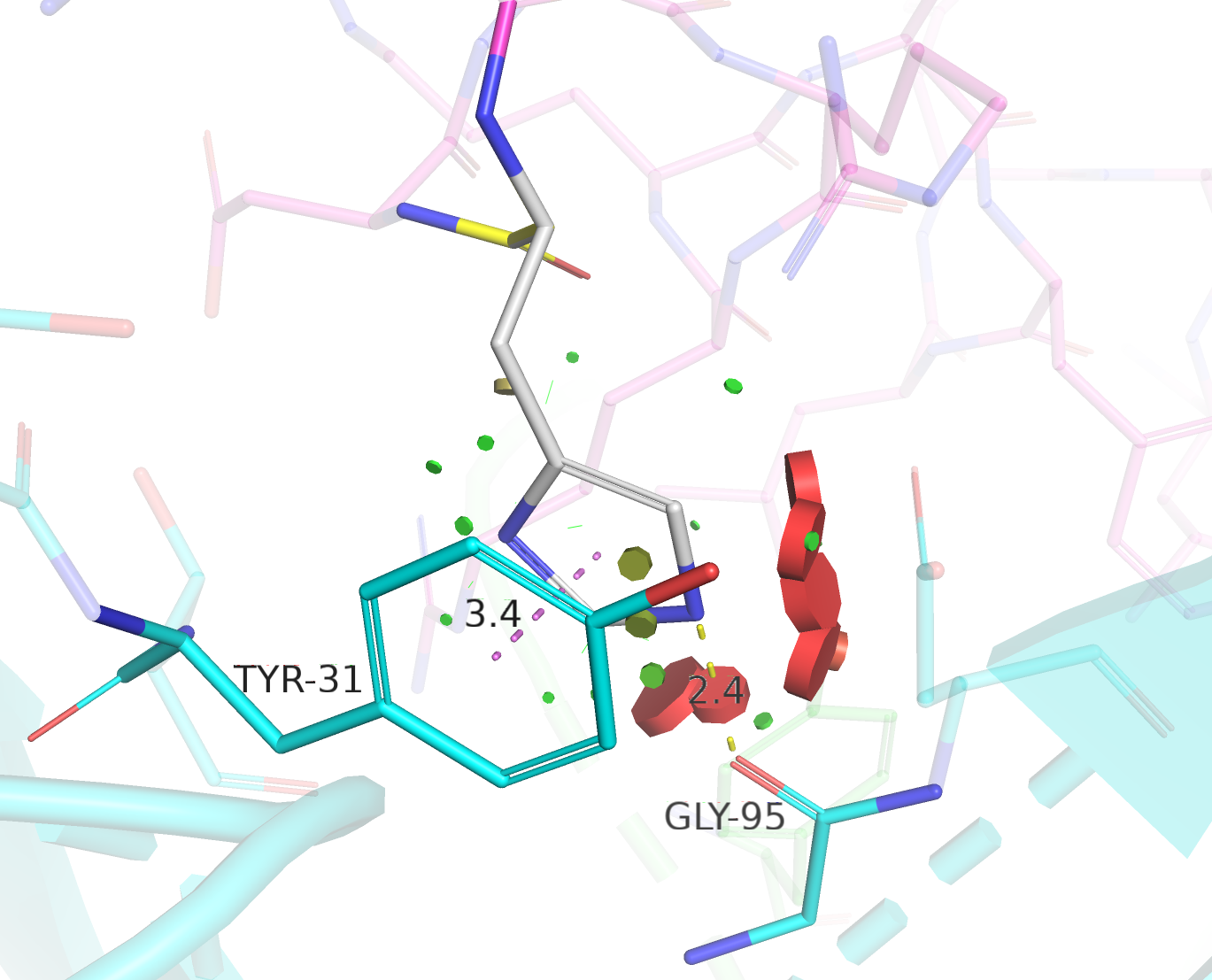 |
Стэкинг с фенольным кольцом TYR-31, водородная связь с остовным кислородом GLY-95. |
| Glu | 15/15 | 14.92 | 1.0% | 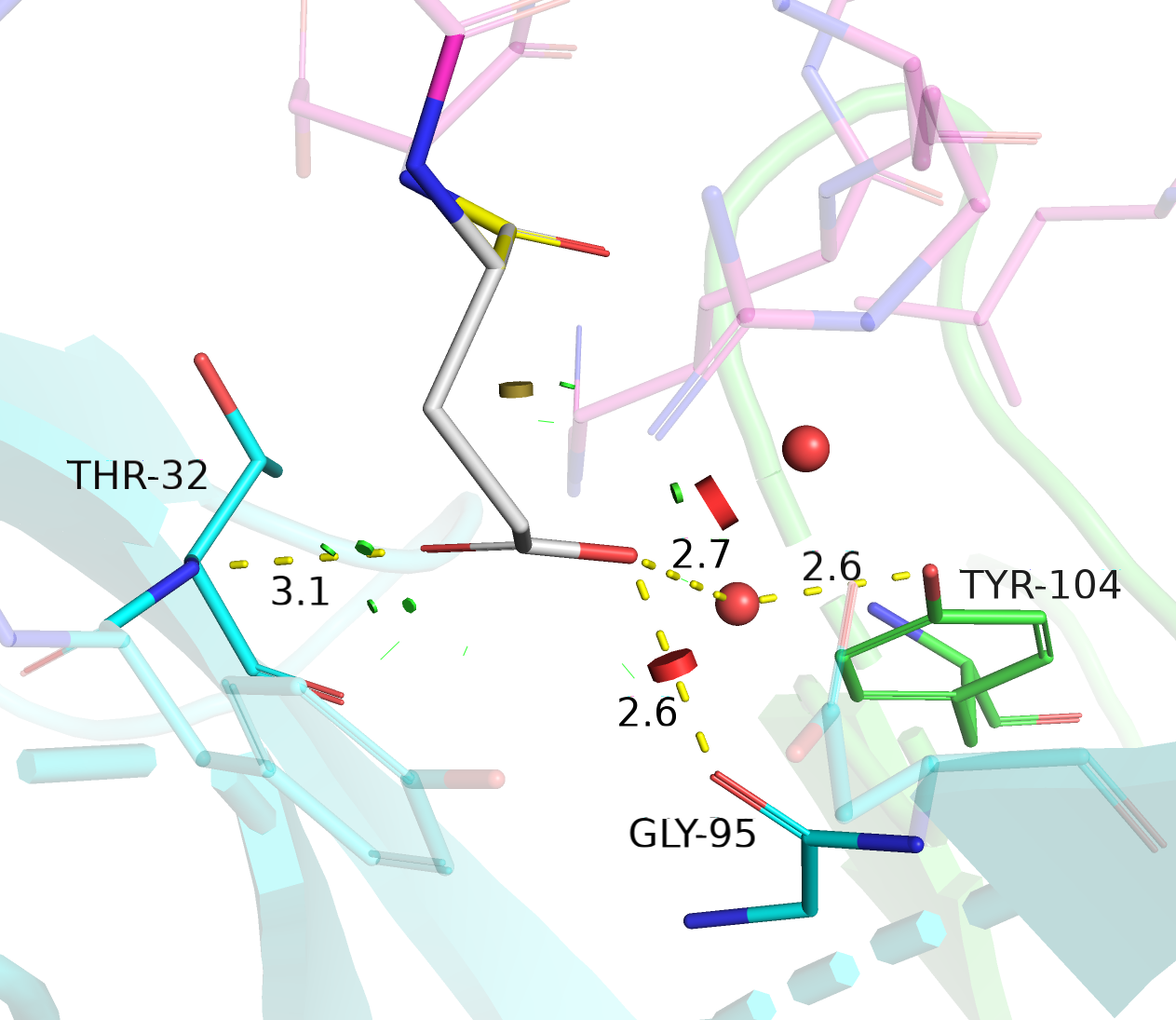 |
Водородная связь с остовным азотом THR-32, с остовным кислородом GLY-95, взаимодействие через водяной мостик с TYR-104. |
| Gln | 11/16 | 13.90 | 1.9% | 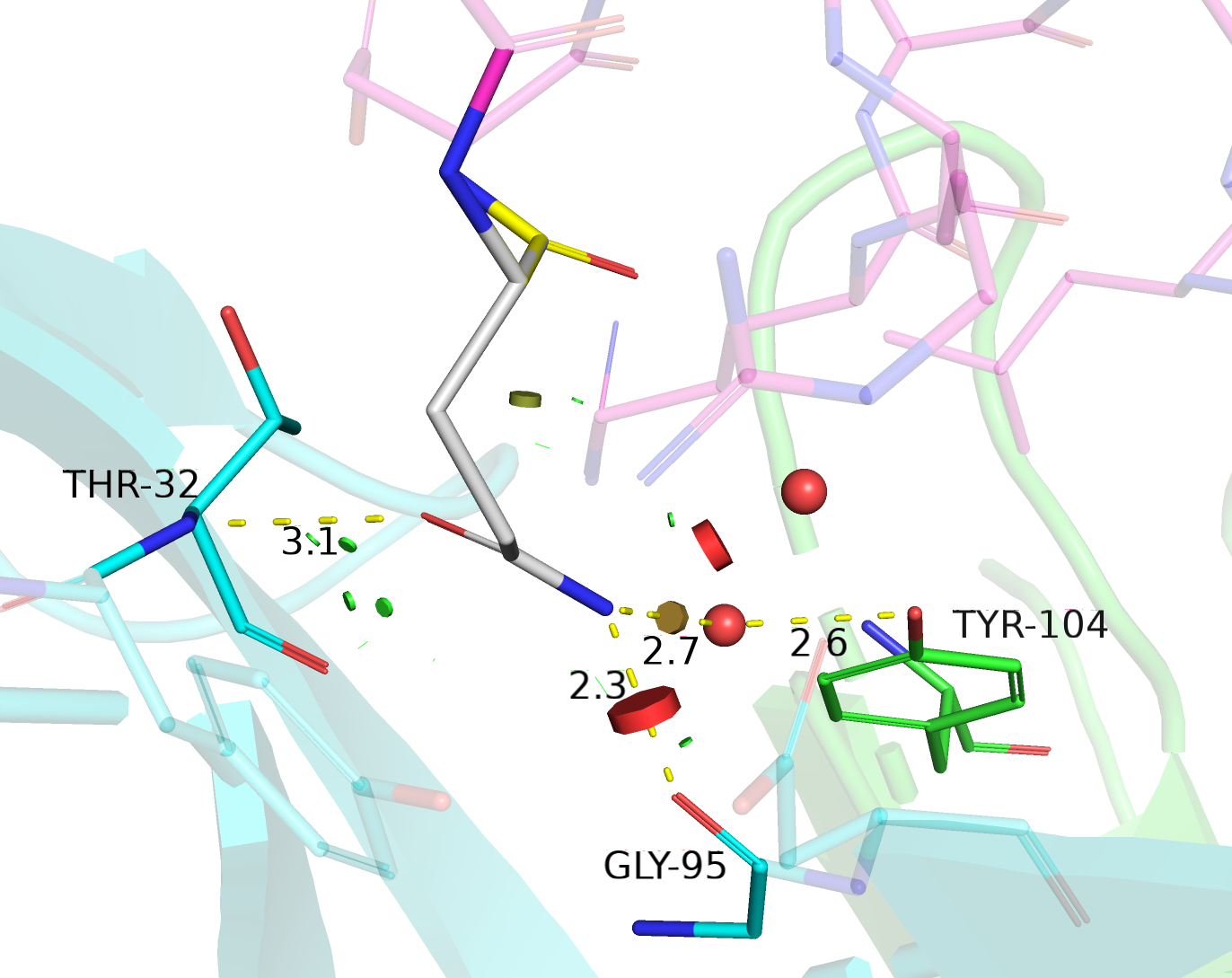 |
Водородная связь с остовным азотом THR-32, с остовным кислородом GLY-95, взаимодействие через водяной мостик с TYR-104. |
| Asn | 10/11 | 30.80 | 1.4% | 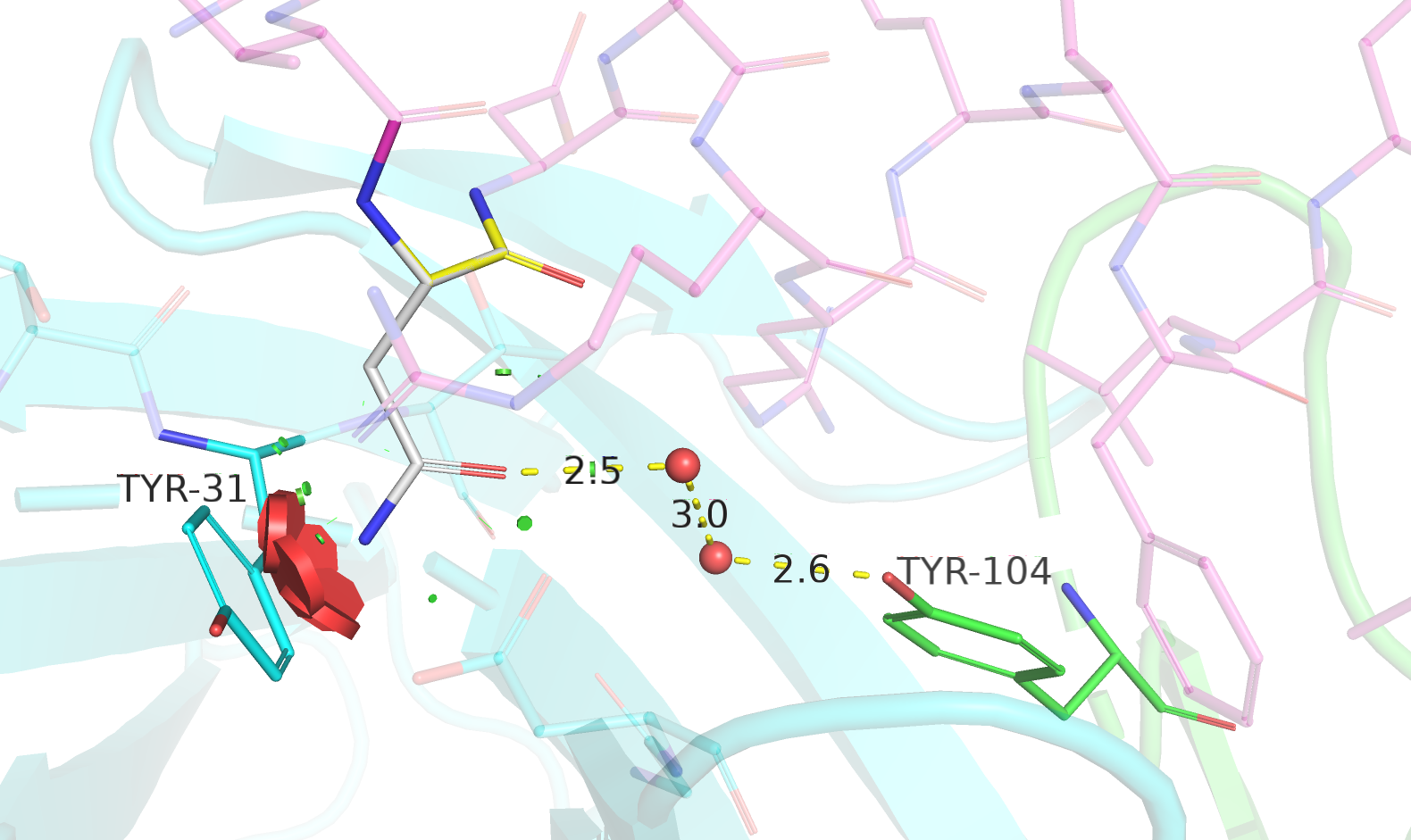 |
Взаимодействие через водяные мостики с TYR-104. |
Гистидин (таутомер HIE) был бы хорошим вариантом, но геометрия его водородной связи не очень хорошая и есть заметное перекрывание ван-дер-ваальсевых радиусов. Аспарагин также имеет большой клэш с соседствующим TYR-31, тоже отметается. Выбранные мной ротамеры серина и треонина очень похожего характера взаимодействия с THR-30, но треонин имеет клэш с соседними остатками, поэтому между ним и серином я бы предпочла серин. Также, похожим образом взаимодействуют с окружением глутамин и глутамат. Геометрия водородной связи между азотом боковой цепи глутамина и остовным кислородом GLY-95 хуже чем между кислородом боковой цепи глутамата и остовным кислородом GLY-95, но зато глутамин незаряженный, в отличие от отрицательно заряженного глутамата, и, учитывая нахождение рядом отрицательно заряженного ASP-96, я скорее выберу глутамин, а не глутамат. Таким образом, выбрать надо между глутамином и серином, что довольно непросто. Но глутамин заходит в глубь кармана, что способствует лучшему связыванию, и взаимодействует с несколькими остатками, в отличие от серина. Поэтому склоняюсь к тому, что на позиции 16 антигена модели 0082 находится глутамат.
© Агаева Зара, 2021