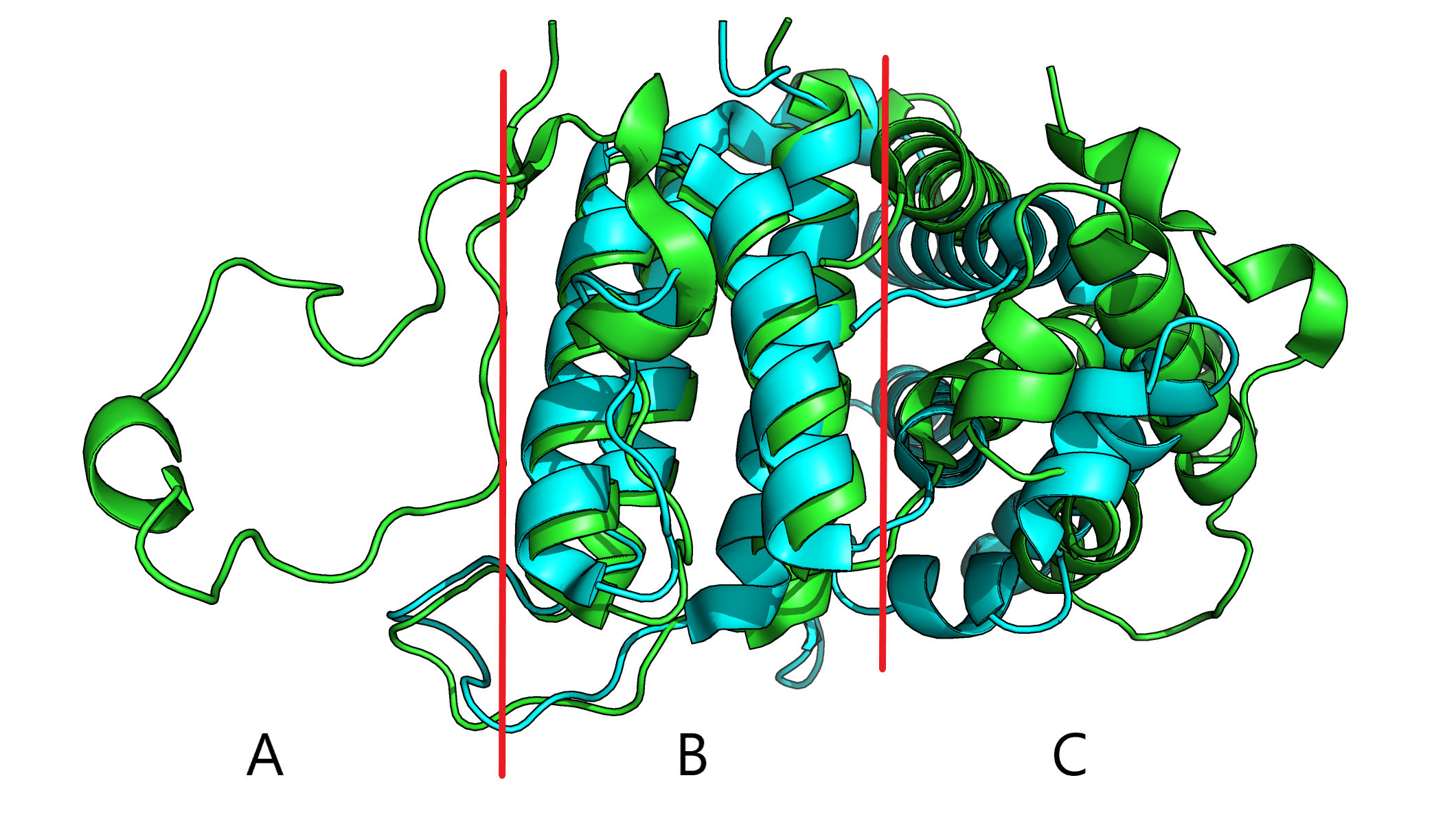
В рамках данного практикума я использую структуры закрытой и открытой форм dUTP пирофосфатазы из Trypanosoma brucei (4dlc и 4dk2 соответственно). На рис. 1 видно, что при изменении конформации часть белка B остается фактически неизменной, а часть C претерпевает сильные конформационные изменения. Петля в части A представлена только в структуре 4dk2, в 4dlc ее нет.

Рис. 1. Визуализация совмещенных структур 4dlc (закрытая форма) и 4dk2 (открытая форма).
Если говорить о площади поверхности, то видим, что площадь поверхности белка в открытой конформации (в случае и MS, и SAS) больше, чем в закрытой. Это объясняется тем, что в случае открытой конформации белок менее плотно упакован, и молекуле растворителя доступно больше поверхности белка. Также можно заметить, что MS (площадь молекулярной поверхности) больше SAS (площадь поверхности, доступной растворителю) в случае и закрытой, и открытой конформации белка. Видимо, когда площадь поверхности "раздувается", как это происходит при вычислении SAS, теряется площадь небольших впадин и щелей, которые могли бы учесться при вычислении MS.
| MS, Å2 | SAS, Å2 | |
|---|---|---|
| закрытая конформация (4dlc) | 22712.867 | 11413.506 |
| открытая конформация (4dk2) | 26015.523 | 14061.395 |
С помощью веб-сервиса fpocket было предсказано расположение карманов связывания субстрата в структурах 4dlc (рис. 2) и 4dk2 (рис. 3). В случае закрытой конформации пришлось немного редактировать вывод fpocket и объединять раздробленные карманы в один. Объем кармана в открытой конформации оказался равен 2574.7898 Å3, а в закрытой меньше - 2382.1770 Å3. Это звучит логично: при открытой конформации субстрат может связаться с ферментом, а при закрытой уже нет, так как карман более плотно упакован, чтобы субстрат, связавшийся с белком его в открытой конформации, не мог этот карман покинуть до процессирования (отсюда и меньший объем кармана).
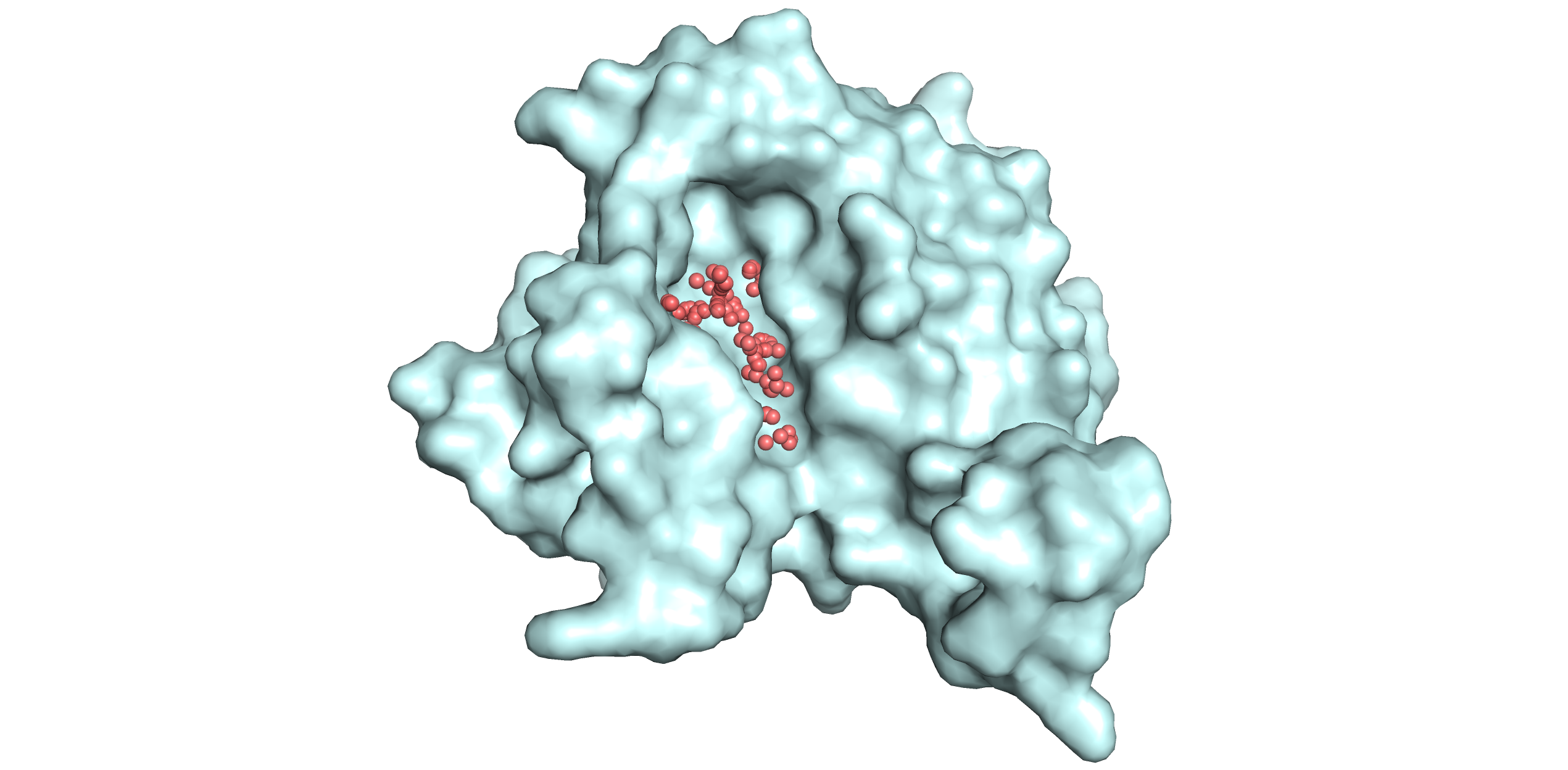
Рис. 2. Визуализация кармана связывания 4dlc (закрытая форма).
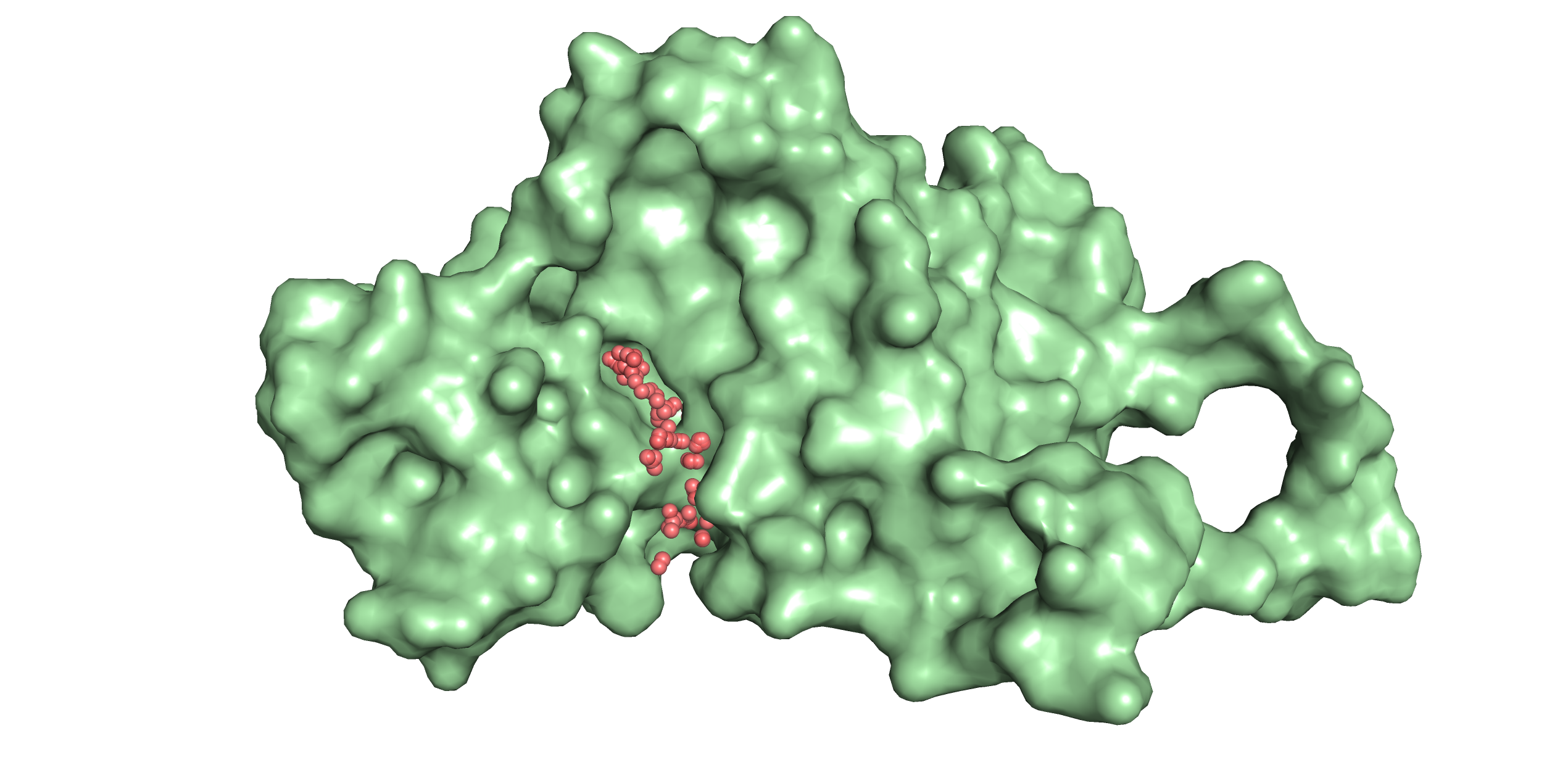
Рис. 3. Визуализация кармана связывания 4dk2 (открытая форма).
В этом задании необходимо было выбрать остаток, разница в экспонированности которого в открытой и закрытой формах была наибольшей. Таким остатком оказался ARG-215: в закрытой форме значение экспонированности оказалось равно 11, в открытой - 126, соответственно, разница между открытой и закрытой формами - 115.
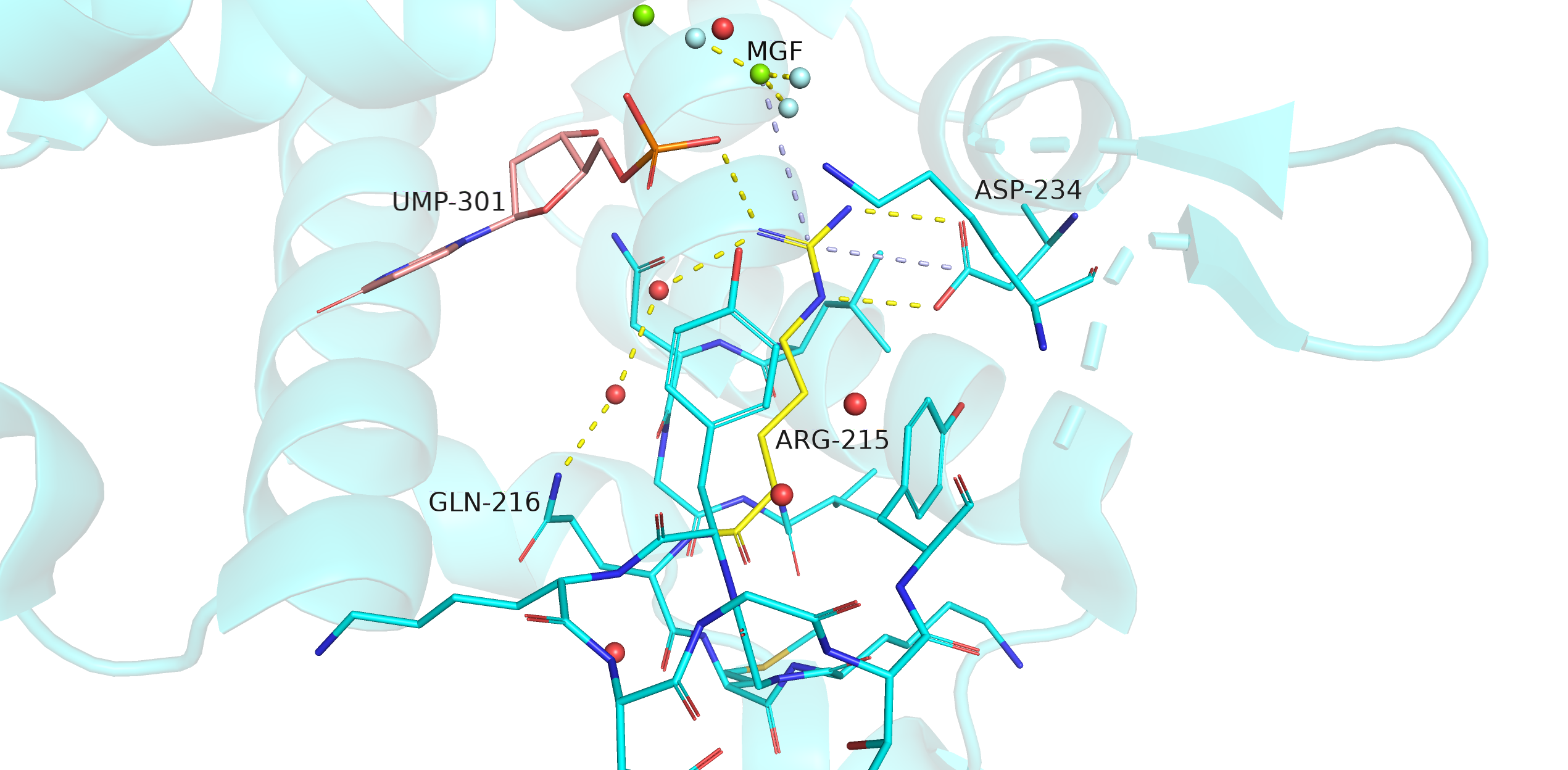
Рис. 4. Визуализация остатка ARG-215 и его взаимодействий с окружением в структуре 4dlc (закрытая форма); желтый пунктир - водородная связь, голубой - солевые мостики.
В закрытой конформации белка (рис. 4) ARG-215 плотно окружен соседствующими остатками и вовлечен во множество взаимодействий. Так, он образует водородные связи с уридинмонофосфатом, ASP-234, GLN-216 (через водяные мостики) и солевые мостики с ASP-234 и MgF3-. Гидрофобная часть ARG-215 также довольно плотно окружена остатками, в том числе двумя тирозинами. Таким образом, ARG-215 хорошо запрятан в белке в его закрытой конформации.
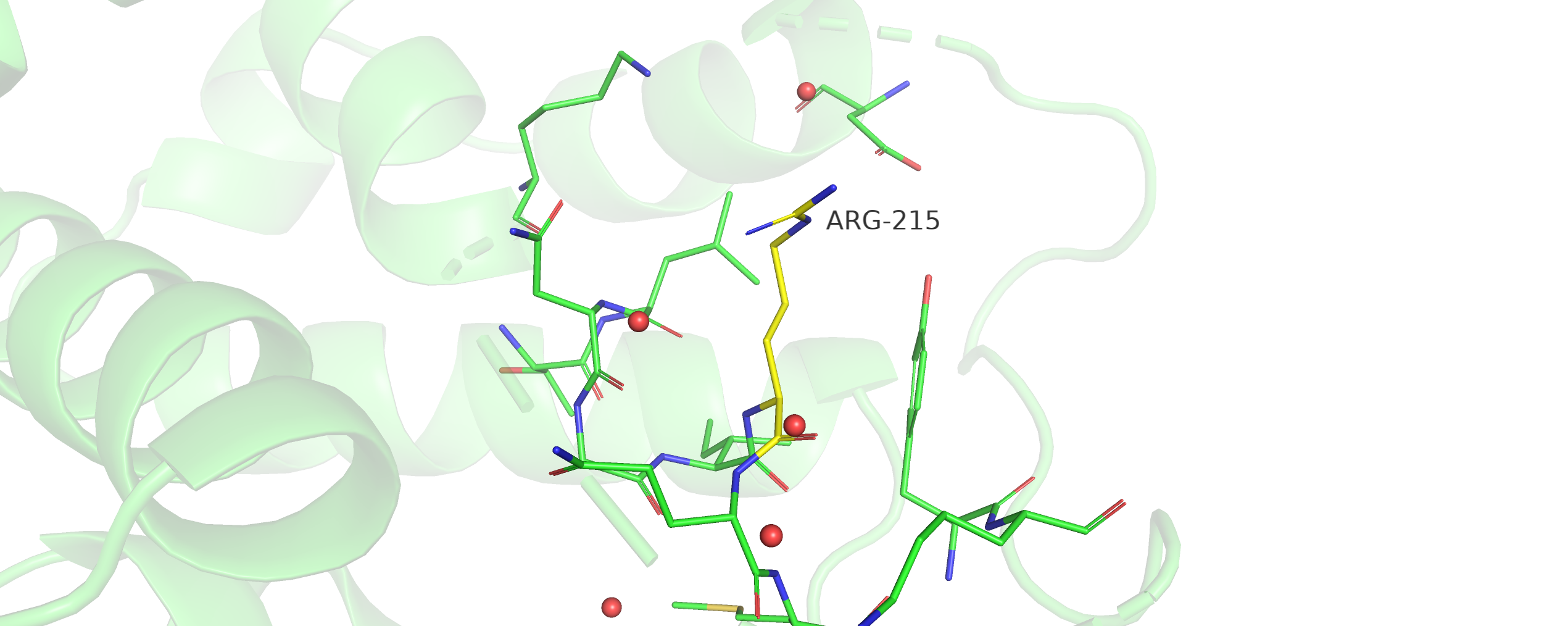
Рис. 5. Визуализация остатка ARG-215 и его окружения в структуре 4dk2 (открытая форма).
В открытой конформации белка (рис. 5) ARG-215 не сохранил тех водородных связей и солевых мостиков, что и в закрытой конформации. Упаковка соседних остатков вокруг него тоже не такая плотная, и ARG-215 "смотрит" вовне белка. Очевидно, что ARG-215 участвует в связывании субстрата, и его экспонированность зависит от конформации белка.
© Агаева Зара, 2021