Исследование белок-нуклеиновых контактов
Задачей ставилось исследовать контакты между белком и нуклеиновой кислотой.
-
Был скачан PDB файл с кодом 1TTU с сайта PDB.
-
Файл был исследован с помощью программы RasMol. Были определены следующие множества:
полярные атомы 2'-дезоксирибозы (pol_drib) полярные атомы остатков фосфорной кислоты (pol_p) полярные атомы азотистых оснований, обращенные в большую бороздку (pol_mjg) полярные атомы азотистых оснований, обращенные в малую бороздку (pol_mig) неполярные атомы 2'-дезоксирибозы (hphob_drib) неполярные атомы азотистых оснований, обращенные в большую бороздку (hphob_mjg) неполярные атомы азотистых оснований, обращенные в малую бороздку (hphob_mig)
Был создан скрипт-файл для работы в RasMol.
Таблица. Контакты разного типа в комплексе ...Полярные Гидрофобные Всего Контакты белка с ... ... остатками 2'-дезоксирибозы 4 27 31 ... остатками фосфорной кислоты 14 0 14 ... остатками азотистых оснований со стороны большой бороздки 3 6 9 ... остатками азотистых оснований со стороны малой бороздки 2 0 2 Больше всего полярных аминокислот белка взаимодействуют с остатками фосфорной кислоты ДНК, поскольку 2 отрицательно заряженных атома кислорода из остатка фосфорной кислоты находятся на поверхности молекулы ДНК и соответственно наиболее доступны для взаимодейсвия с положительно заряженными аминокислотами.
Из таблицы видно, что гидрофобных контактов белка с заряженной ДНК практически нет, поскольку гидрофобные аминокислоты белка обычно сосредоточены внутри молекулы, а полярные - снаружи. Была обнаружена только 1 гидрофобная аминокислота белка, контактирующая с остатками 2'-дезоксирибозы ДНК. Эта аминокислота - фенилаланин 235, в состав которого входит бензильный радикал, обладающий большим размером и гидрофобностью. Остов ДНК отрицательно заряжен и поэтому это взаимодействие не вносит вклад во взаимодействия внутри комплекса ДНК-белок. - Поиск
специфических контактов, обеспечивающих узнавание сайта в молекуле
ДНК. После анализа структуры при помощи RasMol можно
предположить, что такие остатки, как, например, 232GLU и 234ARG, могут отвечать за
специфичность узнавания белком ДНК. Это можно предположить на основании расположения этих
аминокислотных остатков по отношению к ДНК. Наиболее интересным является ARG234, который
виден на изображении ниже.
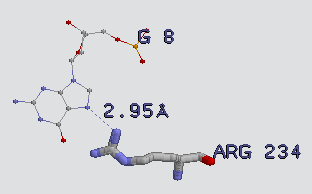
Аргинин лежит внутри большой бороздки ДНК и, кроме того, близко контактирует с ДНК.
- Описание функций
исследованного белка
Описание белка в UniProt (AC:Q9TYY1): Lin-12 and glp-1 phenotype protein 1, isoform a (DNA-binding protein
LAG-1) (Lag-1 protein), т.е. этот белок является ДНК-связывающим.
В Pfam о соответствующем ДНК-связывающем домене, называемом LAG1-DNAbind, говорится, что он принадлежит такому семейству ДНК-связывающих доменов, среди которого встречаются различные эукариотические гипотетические белки, которые характеризуются структурой так называемого бета-сэндвича с 9 нитями в двух бета-листах.
Согласно выравниванию из Pfam, остаток ARG234 является консервативным. На изображении из GeneDoc он стоит на 19 позиции.

Более детально выравнивание можно увидеть здесь.
- Построение схемы контактов белка с ДНК Была запущена программа
nucplot, предназначенная для визуализации контактов между ДНК и
белком. Результат:
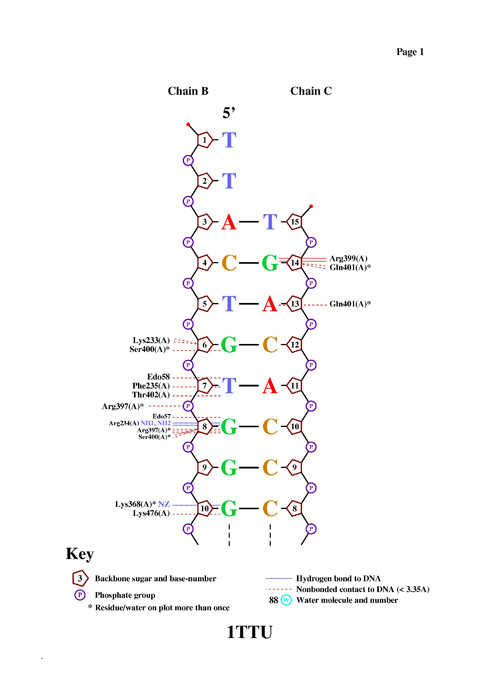
Программа nucplot показывает, что ARG234 образует водородную связь с G8, кроме того, видно, что результат совпадает с данными из таблицы.