Практикум 12
Данный белок
Для работы был выдан белок Y1569_ARCFU это белок с неизвестной функцией в Archaeoglobus fulgidus.
База данных OPM
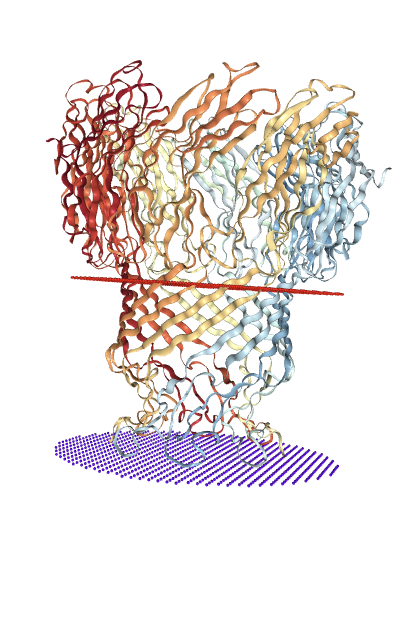
В базе данных OPM был выбран Porin MspA, белок отвечающий за транспорт гидрофильных соединений внутрь бактерии, встречается у грам+ бактерии Mycolicibacterium smegmatis и содержит β-бочонок.
C помощи пакета nglview в Python была получена визуализация трехмерной структуры белка и отмечены стороны мембраны.
| Толщина гидрофобной части белка в мембране | 40,7 Å |
|---|---|
| Координаты трансмембранных участков во всех субъединицах(белок гомооктомер) | A:1(74-83),2(111-119) B:1(74-83),2(111-119) C:1(74-83),2(111-119) D:1(74-83),2(111-119) E:1(74-83),2(111-119) F:1(74-83),2(111-119) G:1(74-83),2(111-119) H:1(74-83),2(111-119) |
| Среднее количество остатков в одном β-тяже белка. | 19 |
| Мембрана, в которую встроен белок | Мембрана грам+ бактерии |
.
.
.
DeepTMHMM
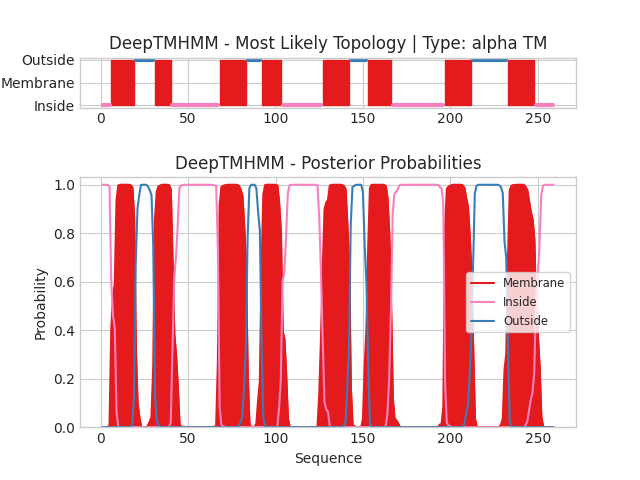
Был проведен анализ для α-спирального Y1569_ARCFU. Текстовую выдачу можно найти тут. На оси абсцисс отложены координаты белка, на оси ординат отложена вероятность определённой локализации белка. Красным цветом выделены трансмембранные участки, синим - внеклеточные, розовым - внутриклеточные.Было предсказано 8 трансмембранных участков, также N и С концы располагаются с внутренней стороны мембраны.
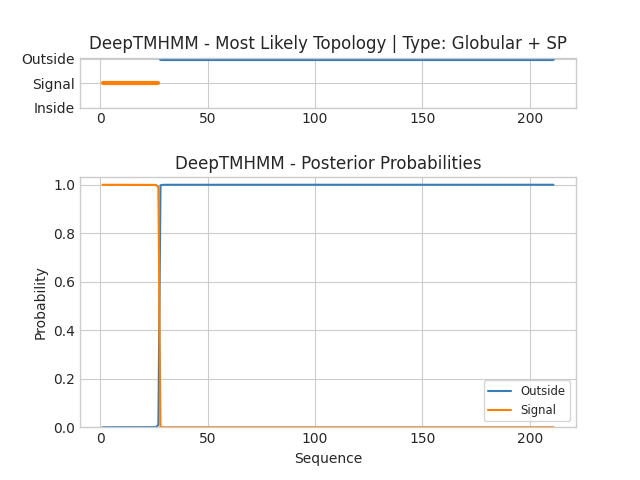
Также был проведен анализ для β-листового Porin MspA. Текстовую выдачу можно найти тут. На оси абсцисс отложены координаты белка, на оси ординат отложена вероятность определённой локализации белка. Голубым цветом выделена локализация со стороны внешней мембраны, оранжевым – сигнал локализации. Как я поняла алгоритм сервера не в состоянии справится с аннотацией участков белка. Один сигнал локализации он выдал, остальное якобы с мембрана не связано. Вполне возможно белок проявляет траснмембранные свойства только в присутствии всех составляющих комплекса.
PPM
Для белка Y1569_ARCFU был запущен алгоритм PP 3.0 со следующими параметрами:
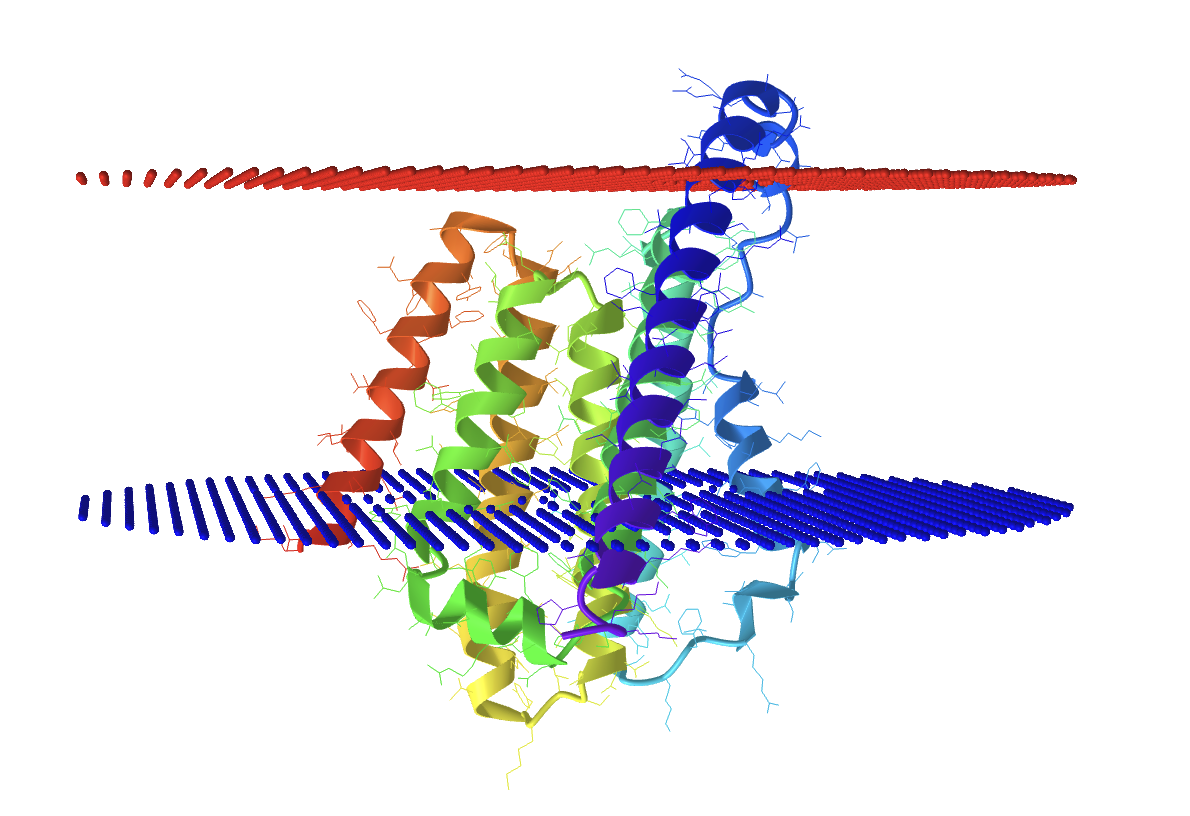
Была получена структура белка с отмеченными красным цветом положительно заряженной частью мембраны, и синим отрицательной частью.
| Толщина гидрофобной части белка в мембране | 29.4 ± 1.1 Å |
|---|---|
| Угол изгиба | 19 ± 0° |
| Координаты трансмембранных участков | 1( 5- 26), 2( 27- 44), 3( 72- 85), 4( 90- 104), 5( 126- 146), 6( 150- 166), 7( 226- 252) |
| Среднее количество остатков в одной a-спирали c белка. | 23 |
| Мембрана, в которую встроен белок | Мембрана археи |
Cравнение алгоритмов
Для выданного белка результаты очень схожи, они оба говорят о 8 трансмембранных участках, а N- и C-концы имеют внутреннюю локализацию. Вряд ли достоверность модели могла повлиять на результат PPM, поскольку модель предсказанная PPM и AlphaFold схожи, и при этом похожи на результат работы DeepTMHMM. Также стоит отметить что участки трансмембранных α-спиралей обладают высоким весом.