- Phytophthora megasperma
- Dictyostelium discoideum
- Chondrus crispus
- Marchantia polymorpha
- Oryza sativa Japonica Group
- Zancudomyces culisetae
- Rhizopus oryzae
- Allomyces macrogynus
- Ustilago maydis 521
- Vanderwaltozyma polyspora DSM 70294
- Trichoplax adhaerens
- Metridium senile
- Corvus brachyrhynchos
- Zaglossus bruijni
- Acipenser persicus
- Marmota broweri
- Rhinophylla fischerae
- Sorex excelsus
- Mustela altaica
- Microcebus murinus
- Q35522.1
- Q37311.1
- P48875.1
- P26852.2
- P0C524.1
- Q3T4C8.1
- Q3T4F1.1
- Q37395.1
- Q0H8X3.1
- A6H4Q4.1
- Q1AGX7.1
- O47499.1
- Q950C7.1
- Q5ZN98.1
- Q9G3M2.1
- Q9TH46.1
- Q9GAM7.1
- O79997.2
- Q9GBG9.1
- Q9G0S9.1
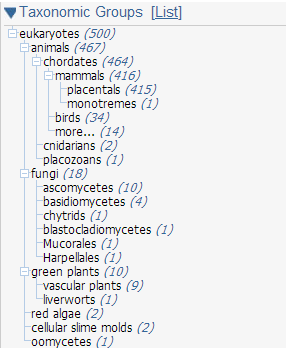 Рис. 1
Рис. 1
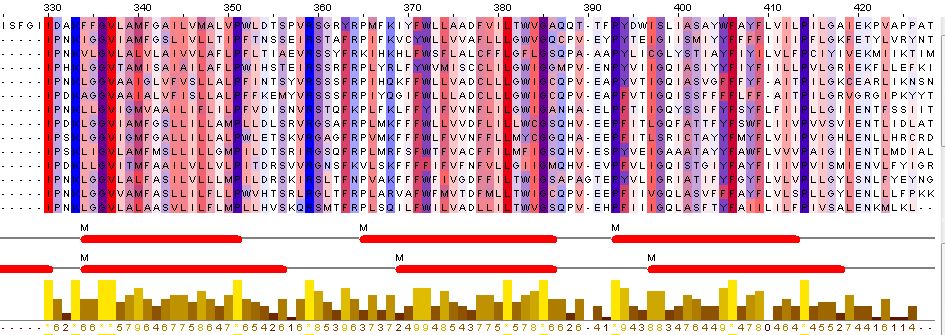 Рис. 2
Рис. 2
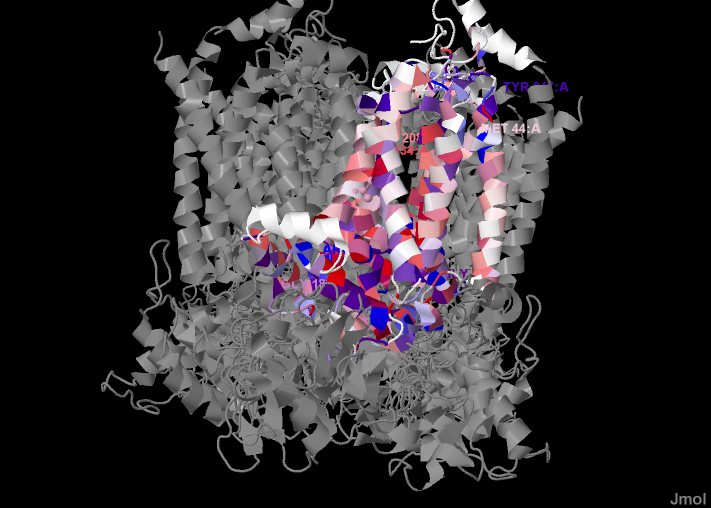 Рис. 3
Рис. 3
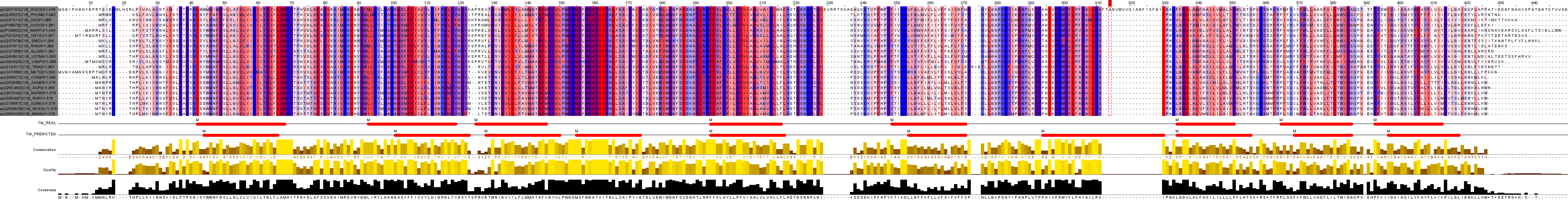 Рис. 4
Рис. 4