+29+15+13+12+12+10+10
| Параметры кластера | найденные кластеры (остатки) | Изображение | Интерпретация результата |
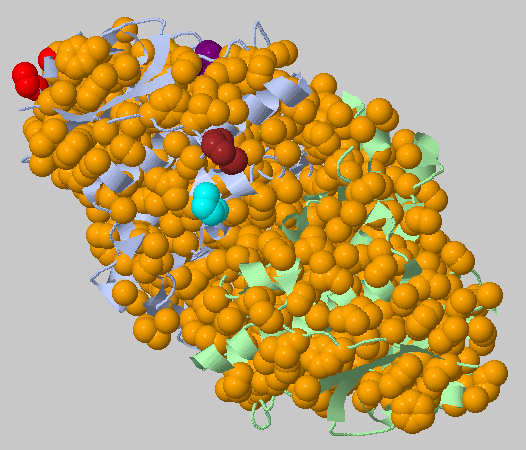
| Порог на расстояние 5.4 Ангстрем, минимальное число атомов 3 | 1162+6+5+4+4+3 |  |
Как видно, предсказался один большой гидрофобный кластер на весь белок и несколько кластеров размером поменьше. Фактически мы получили доказательство утверждения, что белок как правило удерживает свою укладку гидрофобными контактами. Найдем кластеры более интересного состава (порог построже). |
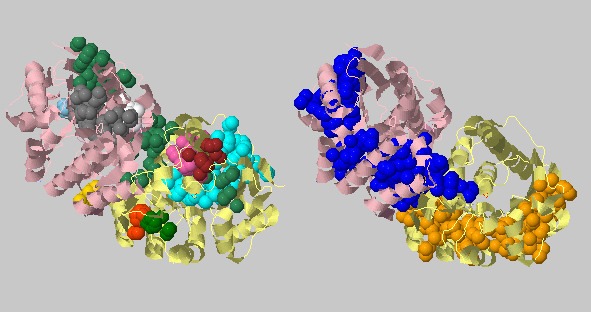
| Порог на расстояние 4.4 Ангстрем, минимальное число атомов 10 | 212+204+93+48+47+34+30+ +29+15+13+12+12+10+10 |
 |
С такими порогами отыскались интересные крупные кластеры в каждой субъединице (синий и оранжевый) и кластеры более мелкого размера, поддерживающие оставшиеся элементы третичной структуры. Это иллюстрирует утверждение, которое м знаем из механизмов ферментативной кинетики, что фермент, как правило, имеет жесткую часть и более подвижные части для катализа. |
| Порог на расстояние 4 Ангстрем, минимальное число атомов 10 | 25+16+15+15+14+13+13+13+10+10 |  |
Можно видеть, что кластеры распределились по структуре неравномерно, причем самые крупные из них расположились близко к области контакта, но все же между субъединицами контакт там не очень хорош. Подробнее проверим это далее. |
| Порог на расстояние 3.5 Ангстрем, минимальное число атомов 3 | 4+4+4+4+4+3+3+3 |  |
Данный порог был выбран просто чтобы убедиться, что таких кластеров очень мало и они разбросаны хаотически по структуре. |
| Параметры кластера | найденные кластеры (остатки) | Изображение | Интерпретация результата |
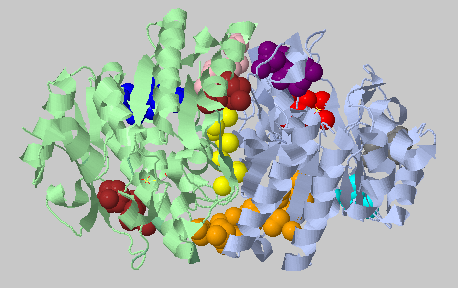
| Порог на расстояние 5.4 Ангстрем, минимальное число атомов 3 | 50+50+21+3+3 | 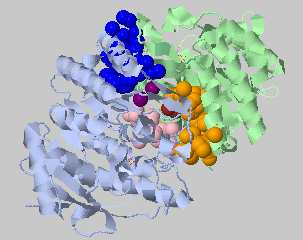 |
Как теперь видно, действительно есть крупные межсубъдничные гидрофобные контакты на периферии, в центре белка контакты поменьше. |
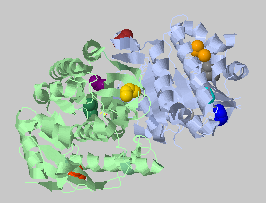
| Порог на расстояние 4.4 Ангстрем, минимальное число атомов 3 | 40+24+13+12+3+3 | 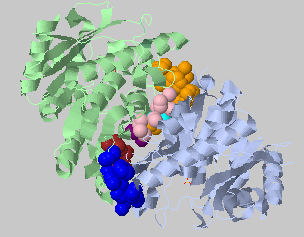 |
Крупные контакты уменьшаются или распадаются на несколько кластеров при задании более жесткого порога, а вот средний кластер в центре (розовый) прочнее, чем можно было предположить, хотя он тоже уменьшился почти вдвое. |
| Порог на расстояние 3.9 Ангстрем, минимальное число атомов 3 | 9+8+8+8+4+3+3 | 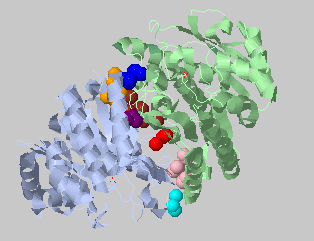 |
И все же самые прочные кластеры на периферии. При задании порога на расстояие 3.5 Ангстрем кластеро нет, следовательно, контакты между субъединицами слабее контактов внутри них. |