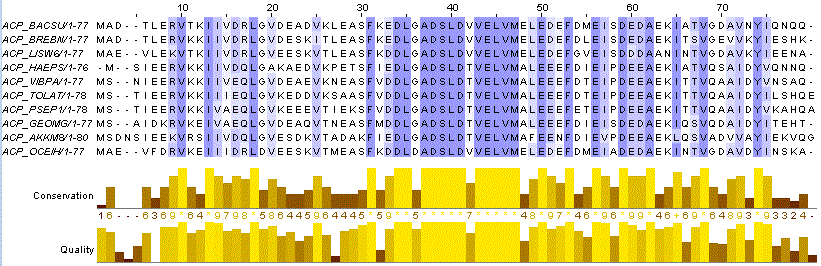
| Организм | ID | AC |
| Bacillus subtilis | ACP_BACSU | P80643 |
| Brevibacillus brevis | ACP_BREBN | C0ZFP2 |
| Listeria welshimeri serovar 6b | ACP_LISW6 | A0AJR1 |
| Haemophilus parasuis serovar 5 | ACP_HAEPS | B8F7C3 |
| Vibrio parahaemolyticus | ACP_VIBPA | P0A2W2 |
| Tolumonas auensis | ACP_TOLAT | C4L8E4 |
| Pseudomonas putida | ACP_PSEP1 | A5W713 |
| Geobacter metallireducens | ACP_GEOMG | Q39V90 |
| Akkermansia muciniphila | ACP_AKKM8 | B2UQS2 |
| Oceanobacillus iheyensis | ACP_OCEIH | Q8ER06 |
 |
 |