Сравнение описания белка YOAJ_BACSU (Expansin-YoaJ из Bacillus subtilis) с описанием того же белка из геномов двух других представителей рода Bacillus
Сравнительная таблица
Информация о белках была получена с помощью программы entret пакета EMBOSS, а ортологи белка YOAJ_BACSU были найдены с помощью поиска по ключевым словам в UNIPROT. Результаты сравнения белка Expansin-YoaJ из Bacillus subtilis с его ортологами Extracellular endoglucanase из Bacillus licheniformis и YoaJ из Bacillus atrophaeus представлены в Таблице 1.
Таблица 1В результате сравнения указанных выше белков выяснено, что белок Expansin-YoaJ из Bacillus subtilis изучен лучше его ортологов Extracellular endoglucanase из Bacillus licheniformis и YoaJ из Bacillus atrophaeus. Запись о Expansin-YoaJ есть в базе данных Swiss-Prot, последовательность аннотирована, доказано существование, описана структура, локализация и функция белка. Записи о его ортологах есть только в базе данных TrEMBL, то есть известны лишь последовательности аминокислот этих белков, они не аннотированы, их функции и вторичные структуры неизвестны. Доказательств существования этих белков нет, и пока что оно лишь предполагается.
Ответы на вопросы
Получите последовательность 2-й альфа-спирали, используя команду seqret пакета EMBOSS.
Последовательность аминокислот второй альфа-спирали определена с помощью команды
seqret -sbegin 109 -send 115 sw:yoaj_bacsu.
В процессе выпонения команды был задан вопрос о названии создаваемого файла
Reads and writes (returns) sequences output sequence(s) [yoaj_bacsu.fasta]:
И так как файл yoaj_bacsu.fasta уже существует в данной директории и содержит полную аминокислотную последовательность белка, во избежание путаницы он был назван мной yoaj_bacsu(ahelix2).fasta. Таким образом, в результате выполнения команды был создан файл yoaj_bacsu(ahelix2).fasta с последовательностью аминокислот второй альфа спирали.
Укажите положение сигнального пептида в последовательности (от - до) и опишите роль этого пептида.
Сигнальный пептид белка Expansin-YoaJ из Bacillus subtilis состоит из 25 аминокислот (1 - 25). Он расположен на N-конце и имеет последовательность MKKIMSAFVGMVLLTIFCFSPQASAA. Однако, к сожалению, информация о том, что это действительно сигнальный пептид, не подкреплена экспериментальными данными, поэтому нет и информации о его функции. Возможно, он нужен для транспорта белка к месту его локализации, однако это лишь моё предположение.
Ответ на вопрос основан на данных, найденных с помощью команды entret пакета EMBOSS и страницы в PDB с описанием структуры данного белка - Expansin-YoaJ - O34918 (YOAJ_BACSU)
Какие аминокислотные остатки (номер, трехбуквенный код, русское название) Вы бы стали мутировать, чтобы повлиять на структурную целостность Вашего белка?
Чтобы нарушить структурную целостность белка Expansin-YoaJ из Bacillus subtilis можно мутировать аминокислотный остаток пролина-109 (Pro-109), так как он обеспечивает поворот аминокислотного мостика, связывающего два домена этого белка. В случае, если заменить этот остаток на другой, взаимное расположение доменов нарушится, а значит, что нарушится и структура белка. На рисунке 1 показано положение аминокислотного остатка Pro-109 (выделен желтым цветом) в структуре 3D30 белка Expansin-YoaJ из Bacillus subtilis.
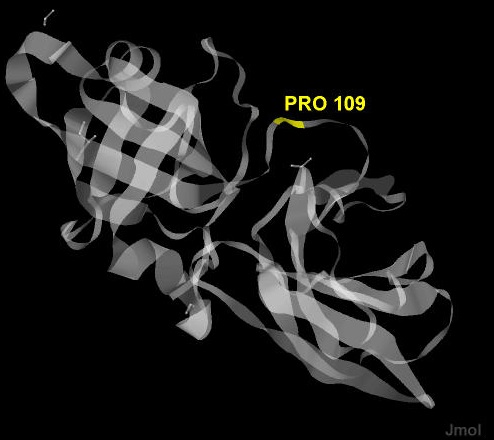
Рис.1. Положение аминокислотного остатка Pro-109 в структуре 3D30.
Предложите мутацию, которая, на Ваш взгляд, сильно повлияет на активность белка.
На активность белка Expansin-YoaJ из Bacillus subtilis, на мой взгляд, сильно повлияет мутация, в результате которой аминокислотные остаки Asp-82 и Thr-12 заменятся на другие. Я делаю это предположение, исходя из того, что положение Asp является консервативным для различных белков со схожей структурой и функцией. Считается, что Asp-82 отвечает за каталитические функции данного белка. Thr-12 связан водородной связью с аспарагином и, тем самым, отвечает за правильное его позиционирование. Аминокислотные остатки образующие водородные связи с Asp также встречаются в других похожих белках. На рисунке 2 показано положение аминокислотных остатков Asp-82 и Thr-12 (выделены желтым цветом) в структуре 3D30 белка Expansin-YoaJ из Bacillus subtilis, а на рисунке 3 показана водородная связь между ними.
Примечание. Ответ на этот вопрос основан на статье "Crystal structure and activity of Bacillus subtilis YoaJ (EXLX1), a bacterial expansin that promotes root colonization" PMCID: PMC2579346
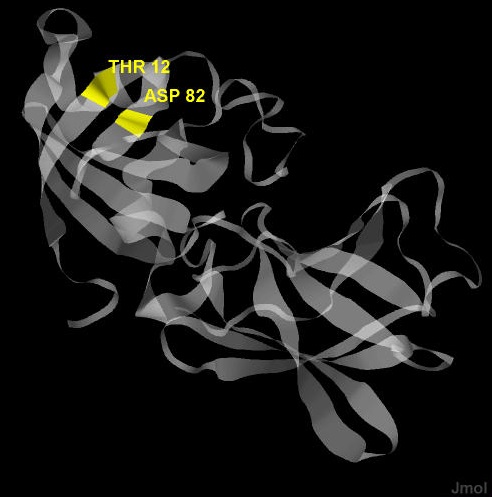
Рис.2. Положение аминокислотных остатков Asp-82 и Thr-12 в структуре 3D30.
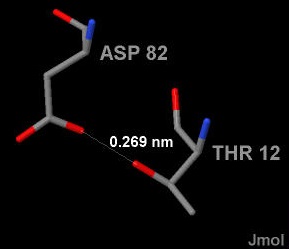
Рис.3. Водородная связь между аминокислотными остатками Asp-82 и Thr-12 в структуре 3D30.
Мутация по какому аминокислотному остатку нарушит связывание белка с каким-либо субстратом?
Cвязывание белка Expansin-YoaJ из Bacillus subtilis с субстратом, например с целлюлозой, осуществляется с помощью аминокислотных остатков Tyr-143, Trp-149, Ile-150, Val-181, Pro-187. На рисунке 2 эти аминокислотные остатки показаны красным цветом в структуре 3D30 белка Expansin-YoaJ из Bacillus subtilis (изображен только второй домен белка). Эти аминокислотные остаки находятся на втором бета-листе белка, имеющем вогнутую форму и создающем углубление для связывания с субстратом, длинной линейной молекулой. Чтобы нарушить связывание с субстратом можно, например, внести мутацию, в результате которой, гидрофобные аминокислотные остатки изолейцин и валин заменятся на гидрофильные заряженные, например лизин, аргинин, аспарагиновую кислоту и т.д. Тогда появится электростатическое взаимодействие между ними и другими аминокислотными остатками бета-листа, и структура связывающего субстрат сайта нарушится.
Ответ на вопрос основан на данных, представленных в PDB - Crystal structure of Bacillus Subtilis expansin (EXLX1) in complex with cellohexaose
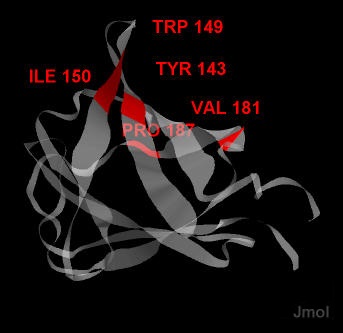
Рис.4. Положение Tyr-143, Trp-149, Ile-150, Val-181, Pro-187 в структуре 3D30 белка Expansin-YoaJ из Bacillus subtilis. Изображен только второй домен белка.
Число предполагаемых ортологов белка YOAJ_BACSU (Expansin-YoaJ из Bacillus subtilis) в базах данных Swiss-Prot и TrEMBL.
С помощью запроса
taxonomy:bacillus AND name:yoaj
в Uniprot найдено 8 ортологов белка YOAJ_BACSU, однако некоторые из них описаны для не полностью секвенированных геномов. Результат поиска представлен на рисунке 5.
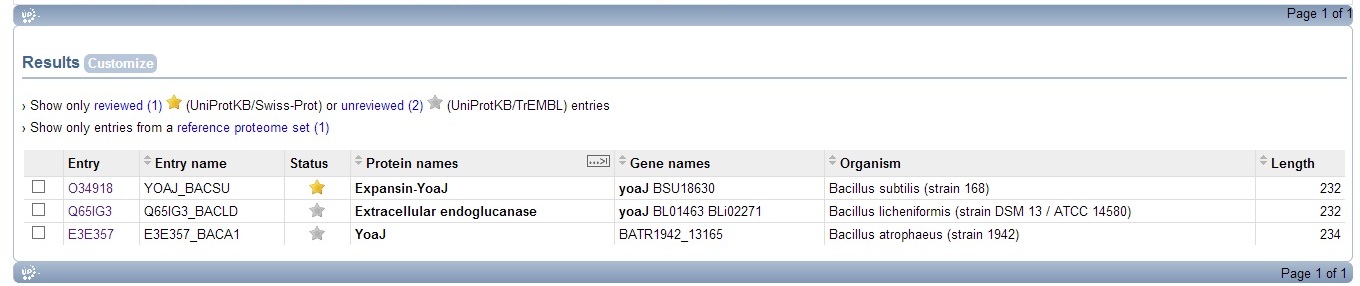
Рис.5. Результат поиска ортологов YOAJ_BACSU в Uniprot по запросу taxonomy:bacillus AND name:yoaj.
Далее с помощью кнопки "Show only entries from a complete proteome set" поиск ограничился лишь последовательностями из полностью секвенированных геномов, а запрос стал выглядеть следующим образом
taxonomy:bacillus AND name:yoaj AND keyword:181.
В результате поиска было найдено два ортолога белка YOAJ_BACSU - Extracellular endoglucanase из Bacillus licheniformis и YoaJ из Bacillus atrophaeus, они же и были взяты для сравнения информации, полученной с помощью программы entret. Оба белка находятся в базе даннных TrEMBL, они не аннотированы. Результат поиска представлен на рисунке 6.
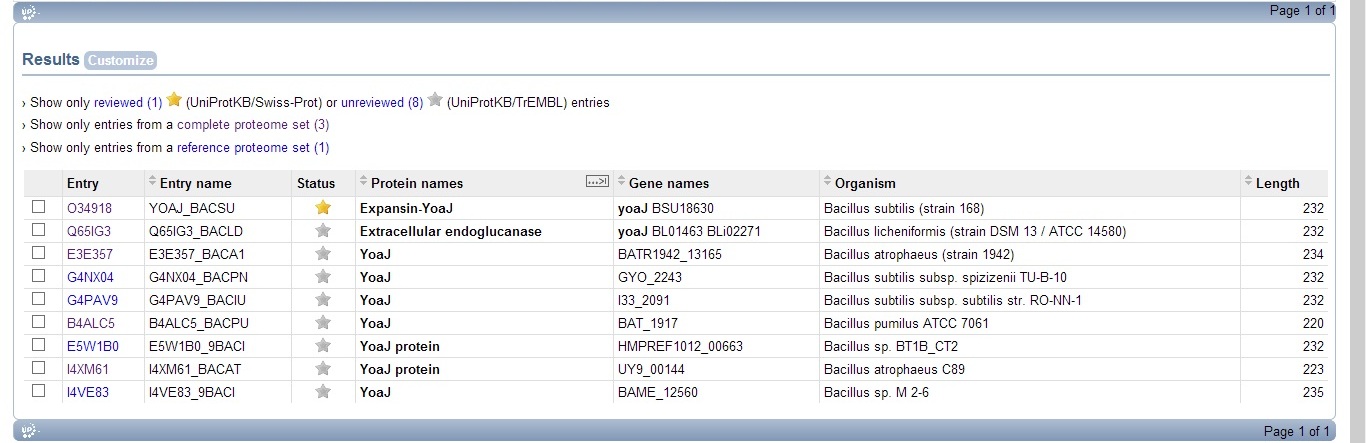
Рис.5. Результат поиска ортологов YOAJ_BACSU в Uniprot для полностью секвенированных геномов по запросу taxonomy:bacillus AND name:yoaj AND keyword:181.