Восстановление кристалла для структуры экспансин-подобного белка с PDB-кодом 3D30
В записи PDB 3D30 указаны следующие кристаллографические характеристики (поле CRYST1):
CRYST1 143.780 143.780 143.780 90.00 90.00 90.00 I 2 3 24
Первые три числа - это длины направляющих векторов кристалла. Они все одинаковые и составляют 143.780 Å. Следующие три числа - это углы между направляющими векторами кристалла. Все эти углы прямые. Кристаллографическая группа I 2 3. Это кубическая объемоцентрированная ячейка (body-centred). Всего в ней 24 молекулы. В PDB всего 0.41% структур имеет такую элементарную ячейку.
С помощью команды symexp удалось восстановить симметричный кусочек кристалла, состоящий из 18 молекул белка. Сначала использовалась команда
PyMOL>symexp sym*, 3hdd, 3hdd, 5
Затем для восстановления симметричного участка в качестве опорных выбирались другие молекулы.
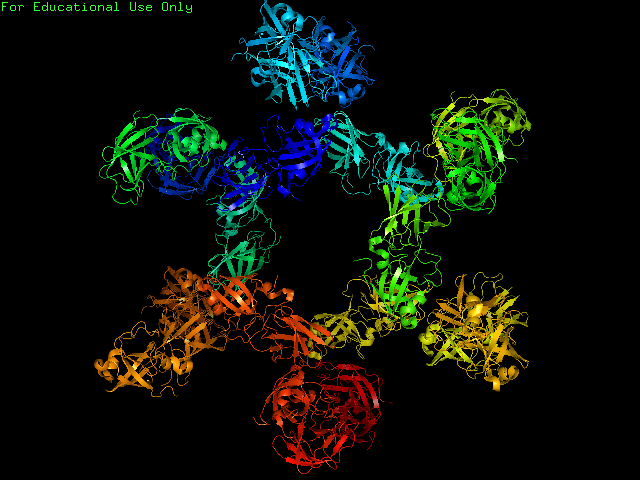

Рисунки 1 и 2. Участок кристалла, состоящий из 18 молекул белка.
Для того, чтобы рассмотреть все взаимодействия между молекулами белка в кристалле, достаточно всего трёх молекул. Остатки, расположенные на расстоянии до 3.5 Å от соседних ячеек показаны голубым.
PyMOL>select sel3, byres(sym19000000 within 3.5 of 3d30) PyMOL>select sel2, byres(sym16000000 within 3.5 of 3d30) PyMOL>select sel1, byres(3d30 within 3.5 of sym16000000 or sym19000000) PyMOL>dist dist12, sel1, sel2, 3.5
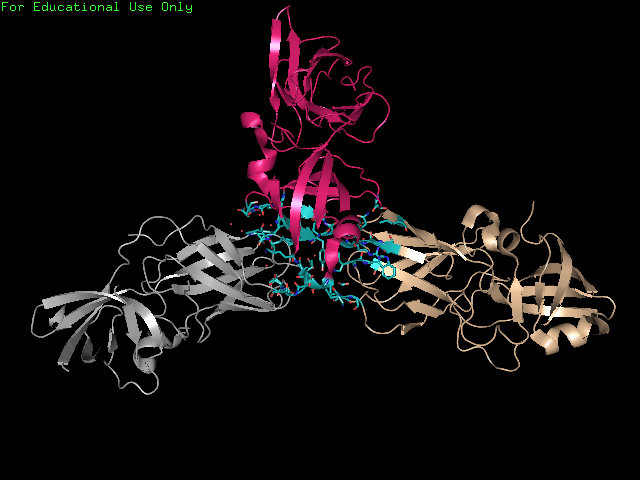
Рисунок 3. Участок кристалла, состоящий из 3 молекул белка. Остатки, расположенные на расстоянии до 3.5 Å от соседних ячеек показаны голубым.
Рассмотрим подробнее контакты между розовой и бежевой молекулами.
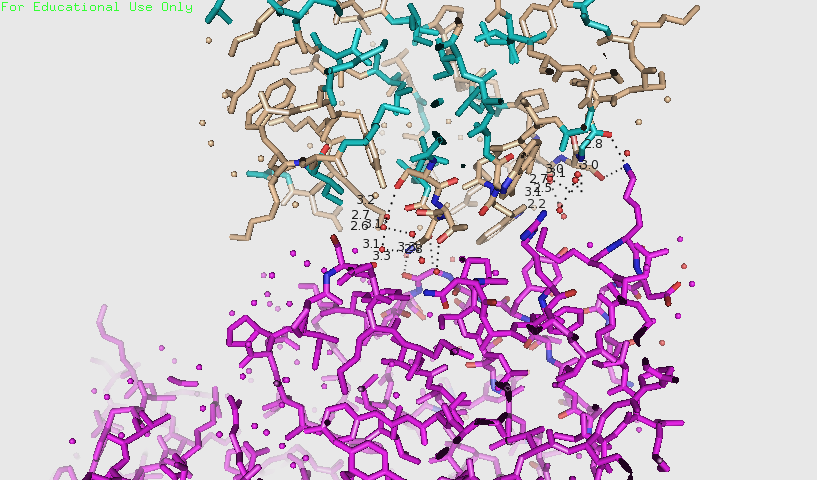
Рисунок 4. Взаимодействия, обнаруженные между розовой и бежевой молекулами на расстоянии до 3.5 Å.
На рисунке 4 видно, что есть две области взаимодействий. В одной из них (рисунок 5), вероятно, есть водородные связи между Asn164 и атомами полипептидной цепи, соотвествующими Gly15. Asn164 связан водородной связью с водой, дальше идет цепочка водородных связей между молекулами воды и одна молекула воды, вероятно, образует водородную связь с Ser162. На рисунке 6 видно, как Lys95 образует водородные связи с Ser192 и атомом кислорода полипептидной цепи, соотвествующим Gly193.
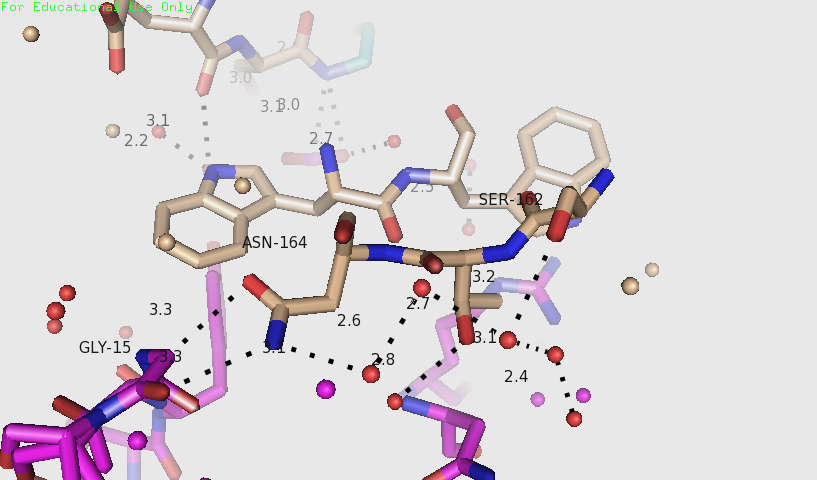
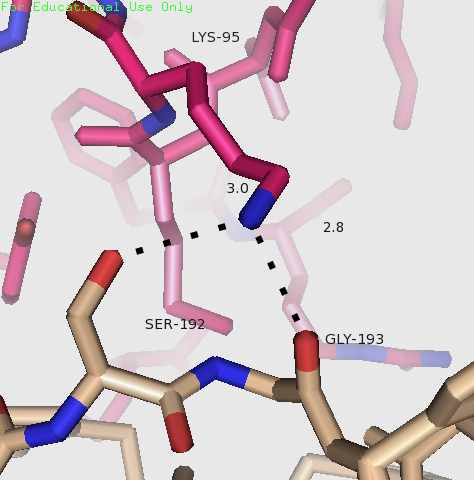
Рисунки 5 и 6. Взаимодействия, обнаруженные между розовой и бежевой молекулами на расстоянии до 3.5 Å
На рисунке 7 голубым выделены гидрофобные остатки. Даже на расстоянии 5 Åне удалось выявить гидрофобных взаимодействий. Видно, что гидрофобные остатки удалены от места контакта молекул.
PyMOL>select hydrophobes, (resn ala+gly+val+ile+leu+phe+met) PyMOL>dist Hydr, (3d30 and hydrophobes), (sym19000000 and hydrophobes), 5

Рисунок 8. Гидрофобные остатки в молекулах показаны голубым.
Таким образом, между молекулами есть две зоны контакта, образованные за счет водородных связей.
Рассмотрим теперь подробнее контакты между розовой и серой молекулами.

Рисунок 9. Взаимодействия, обнаруженные между розовой и серой молекулами на расстоянии до 3.5 Å.
На рисунке 9 видно, что между розовой и серой молекулами есть две области взаимодействий, так же как и для розовой и бежевой молекул. В одной из них (рисунок 10), вероятно, есть водородные связи между Ser195 и водой, водой и Thr194, между двумя молекулами воды и между водой и Lys98. Стоит отметить, что для Thr194 показано сразу две конформации, и водородная связь возможна только для одной из них. На рисунке 10 показан другой участок взаимодействий. Из-за двух возможнвх конформаций Lys198 он достаточно запутанный.


Рисунки 9 и 10. Взаимодействия, обнаруженные между розовой и серой молекулами на расстоянии до 3.5 Å
На рисунке 11 голубым выделены гидрофобные остатки. На расстоянии до 5 Å удалось выявить одно возможное гидрофобное взаимодействие (рисунок 12). Однако, если приглядеться, для остатка Gly193 показан взаимодействующий кислород. Это не является гидрофобным взаимодействием.
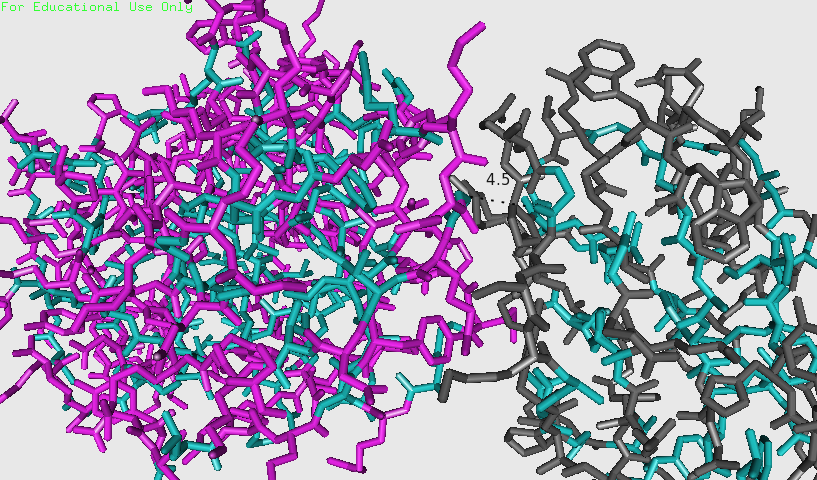
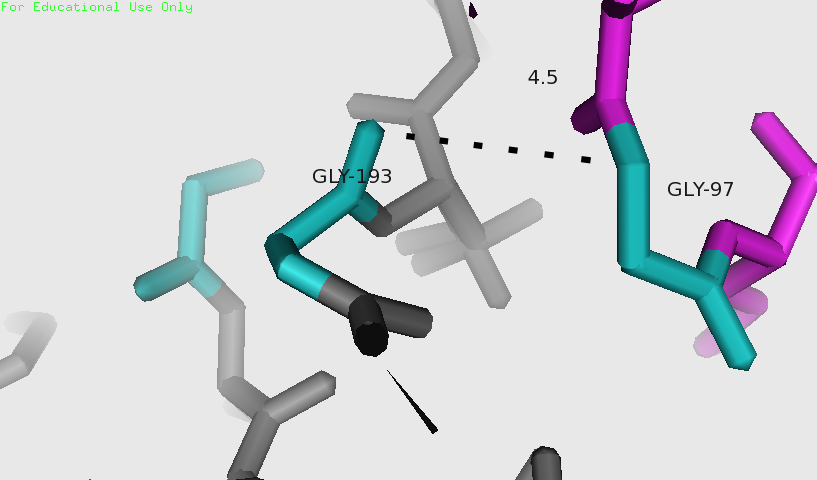
Рисунки 11 и 12. Гидрофобные остатки в молекулах показаны голубым.
Таким образом, весь кристалл образуется за счет четырех различных зон контакта, по две зоны между двумя разными молеклами. Одна молекула взаимодействует с четырьмя другими и на одну молекулу всего приходится 8 зон контакта. Эти зоны образованы за счет водородных связей. Мне кажется, что это большое число зон и водородные связи являются достаточно сильными, чтобы за из-за их появления белок удалось кристаллизовать.
Похоже, что в природе этот белок существует в виде мономера. Вряд ли эти взаимодействия могут обеспечивать его олигомеризацию в природе, потому что сами зоны содержат совсем небольшое число связей. Сомневаюсь, что две молекулы белка можно удержать рядом в растворе за счет двух водородных связей.