Сравнение трёх водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА
Для работы были выбраны модели структур бактериальной рибонуклеазы Т1. Структура, полученная методом РСА, имеет PDB-код 1BU4. Разрешение структуры составляет 1.90Å при полноте 95.6%. Структура, полученная методом ЯМР, содержит 24 модели (PDB-код 1IYY). Укладки структур 1BU4 и 1IYY сходны, как видно на рисунках 1 и 2.

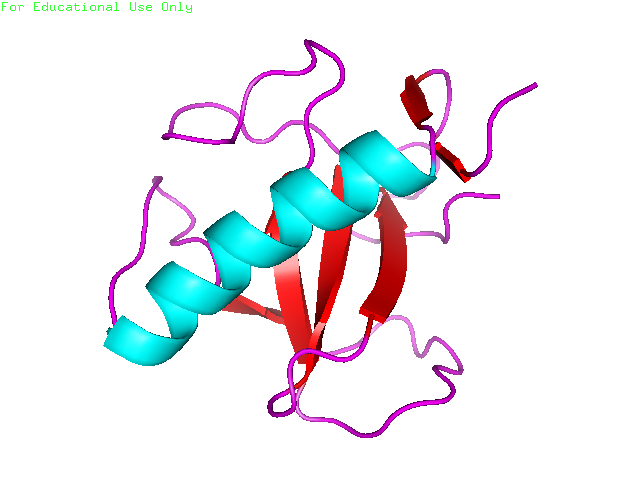
Рисунки 1 и 2. Структуры 1IYY, полученная методом ЯМР (показаны 24 модели, визуализация ribbon), и 1BU4, полученная методом РСА (визуализация cartoon).
В структуре, полученной РСА, были выбраны три водородные связи.
Водородная связь между Lys41 и Tyr57 образована одним из атомов водорода концевой групы лизина и атомом кислорода -OH группы боковой цепи тирозина. Остатки располагаются на поверхности глобулы на неструктурированных участках. На рисунке 3 показаны красным.
Водородная связь между боковыми цепями Thr91 и Asp76 образована атомом кислорода Asp76 и атомом водорода Thr91. Оба остатка располагаются внутри глобулы белка на участках, обозначенных как участки без четкой вторичной структуры, сразу после β-тяжей. На рисунке 3 показаны желтым.
Остатки Val79 и Gly88 находятся в β-листе. Кислород пептидной связи Gly88 образует характерную для β-листа водородную связь с водородом -NH- Val79, который тоже участвует в образовании пептидной связи. На рисунке 3 остатки показаны голубым.
Рисунок 3. Остатки, выбранные для анализа водородных связей, показаны на структуре 1BU4, полученной методом РСА (визуализация cartoon). Остатки Lys41 и Tyr57 показаны красным, Thr91 и Asp76 - жёлтым, а Val79 и Gly88 голубым.
Характеристики рассмотреных расстояний между атомами, которые могут образовывать водородную связь между указанными остатками в структурах 1IYY, полученной методом ЯМР, и 1BU4, полученной методом РСА, представлены в таблице 1.
Таблица 1. Расстояния между атомами, которые могут образовывать водородную связь между остатками Lys41 и Tyr57, Thr91 и Asp76, Val79 и Gly88 рибонуклеазы Т1 в структурах 1IYY, полученной методом ЯМР, и 1BU4, полученной методом РСА
| Расстояние между остатками | Расположение | Расстояние между остатками в структуре 1BU4 (РСА) | Минимальное расстояние между остатками в структуре 1IYY (ЯМР) | Максимальное расстояние между остатками в структуре 1IYY (ЯМР) | Медиана значений расстояний в структуре 1IYY (ЯМР) | Процент моделей 1IYY, в которых есть водородная связь |
| Tyr57 и Lys41 | На поверхности глобулы (боковые цепи) | 2.9 | 5.3 | 9.2 | 7.3 | 0% |
| Val79 и Gly88 | Внутри глобулы в β-листе | 3 | 2.1 | 2.7 | 2.1 | 100% |
| Asp76 и Thr91 | Внутри глобулы (боковые цепи) | 2.6 | 2.1 | 5.7 | 4 | 33% |
Изображения связей между Lys41 и Tyr57, Thr91 и Asp76, Val79 и Gly88 в модели 1BU4, полученной методом РСА, и изображения для минимальных и максимальных значений расстояний в моделях структуры 1IYY, полученной методом ЯМР, показаны на рисунках 4 - 12.
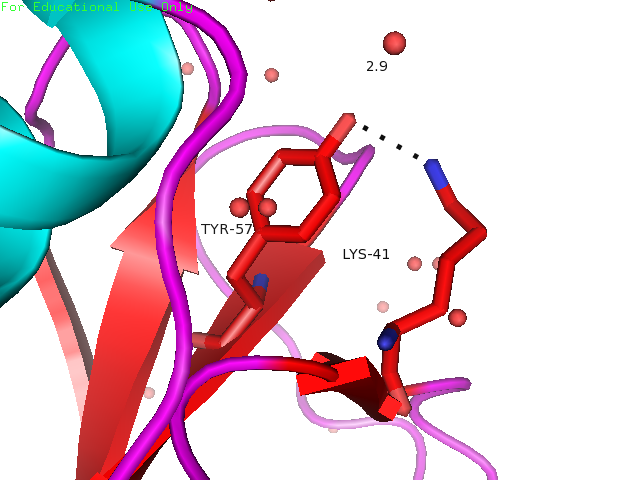
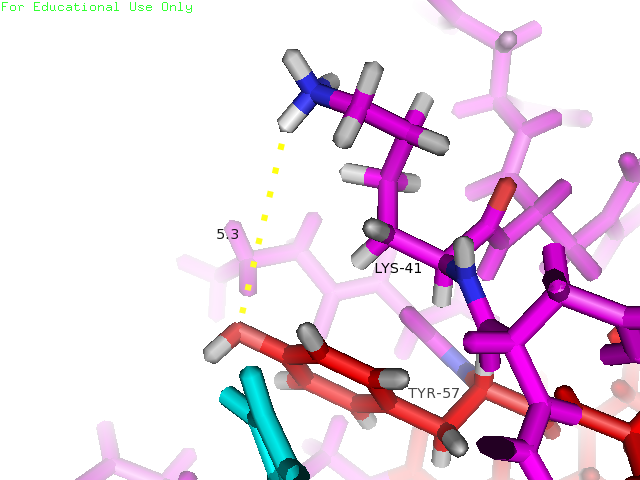
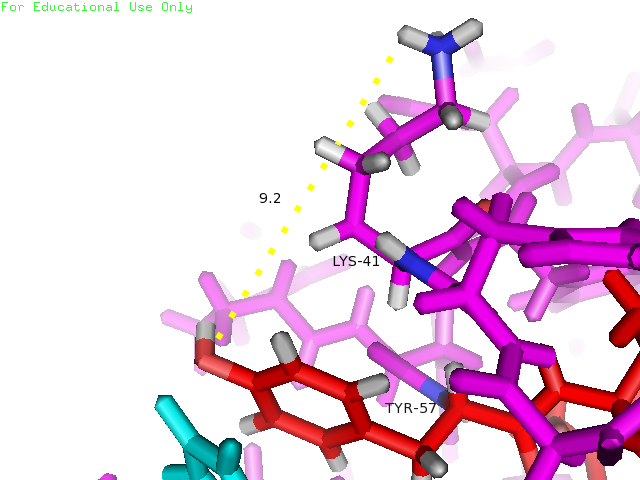
Рисунки 4, 5 и 6. Изображение расстояния между атомами, которые могут образовывать водородную связь между остатками Lys41 и Tyr57, слева направо: в структуре 1BU4 (водородная связь), минимальное и максимальное расстояния в структуре 1IYY.
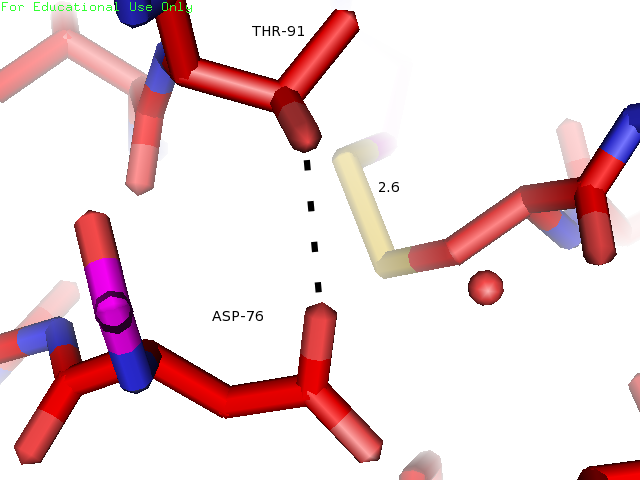
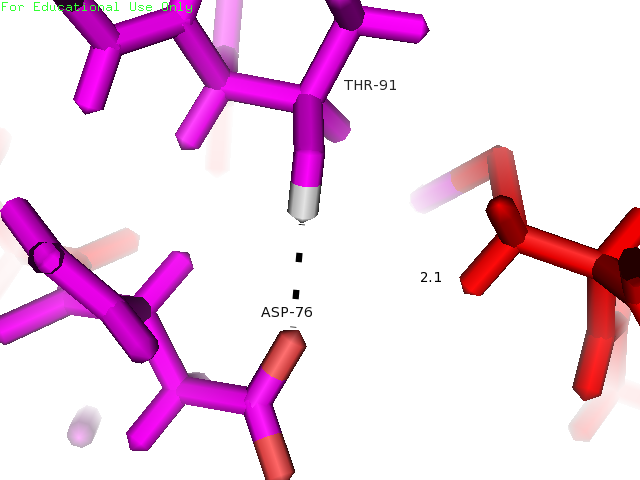
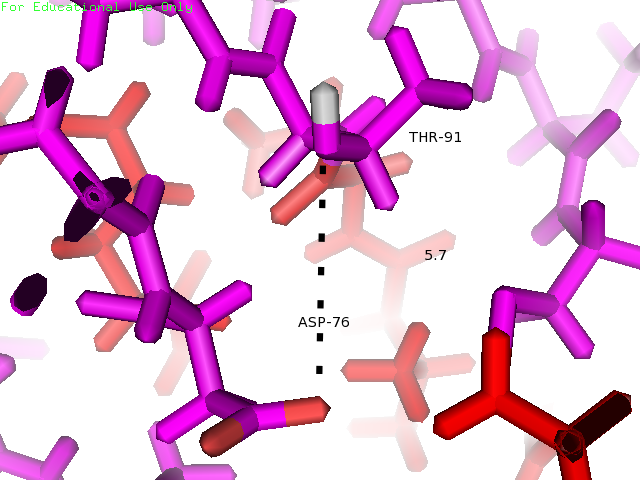
Рисунки 7, 8 и 9. Изображение расстояния между атомами, которые могут образовывать водородную связь между остатками Thr91 и Asp76, слева направо: в структуре 1BU4 (водородная связь), минимальное (водродная связь) и максимальное расстояния в структуре 1IYY.
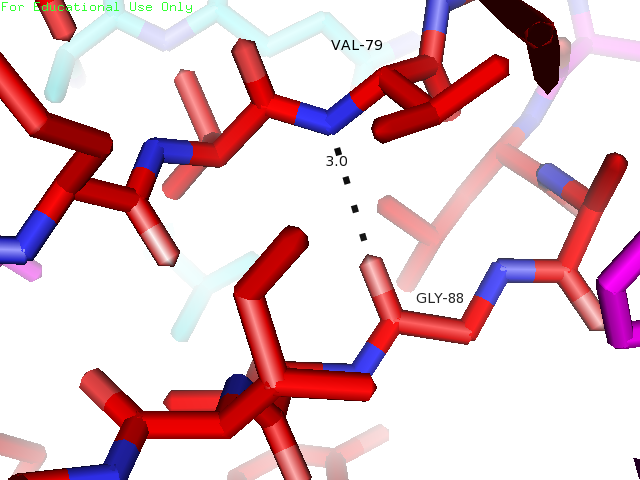
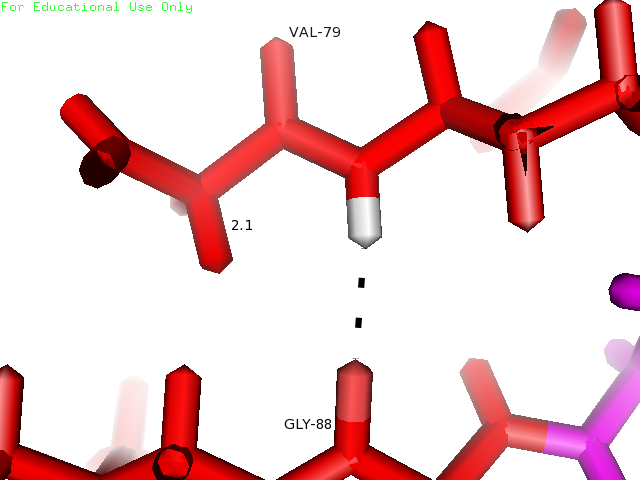
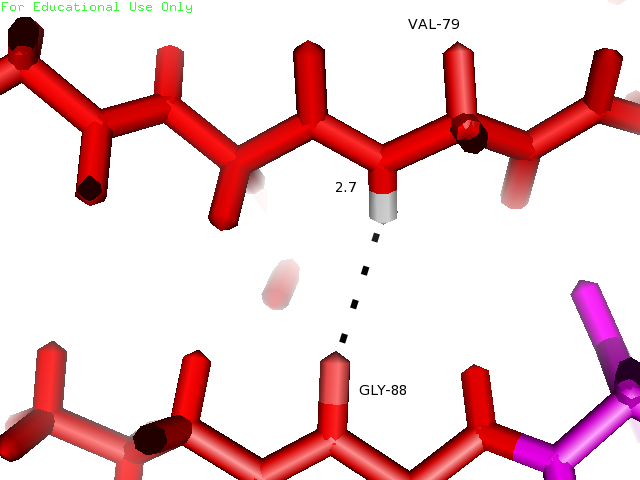
Рисунки 10, 11 и 12. Изображение водородной связи между Val79 и Gly88, слева направо: в структуре 1BU4, связь в модели с минимальной длиной и с максимальной длиной в структуре 1IYY.
Можно заметить, что водородная связь, обнаруженная на поверхности глобулы в кристалле белка (в структуре 1BU4, полученной методом РСА), не сохраняется в растворе (в структуре 1IYY, полученной методом ЯМР). Это может быть связано с тем, что боковые радикалы и остов полипептидной цепи в растворе более подвижны, а также с тем, что при кристаллизации белок принимает определенную структуру, связанную со взаимодействиями с соседними белками в кристалле. Также не во всех моделях есть водородная связь, образованная боковыми радикалами внутри глобулы белка.
Однако связь в β-листе сохраняется во всех моделях, полученных методами и ЯМР, и РСА. Также можно заметить, что структуры белка в растворе и в кристалле практически идентичны по укладке полипептидной цепи, особенно для вторичных структур (α-спиралей и β-листов).
Таким образом, можно заключить, что в растворе боковые цепи аминокислотных остатков белка и неструктурированные участки обладают большей подвижностью, чем вторичные структуры. А также, что водородные связи в молекуле белка в растворе, вероятно, лабильны.
