Открыть рисунок в отдельном окне
 �
�
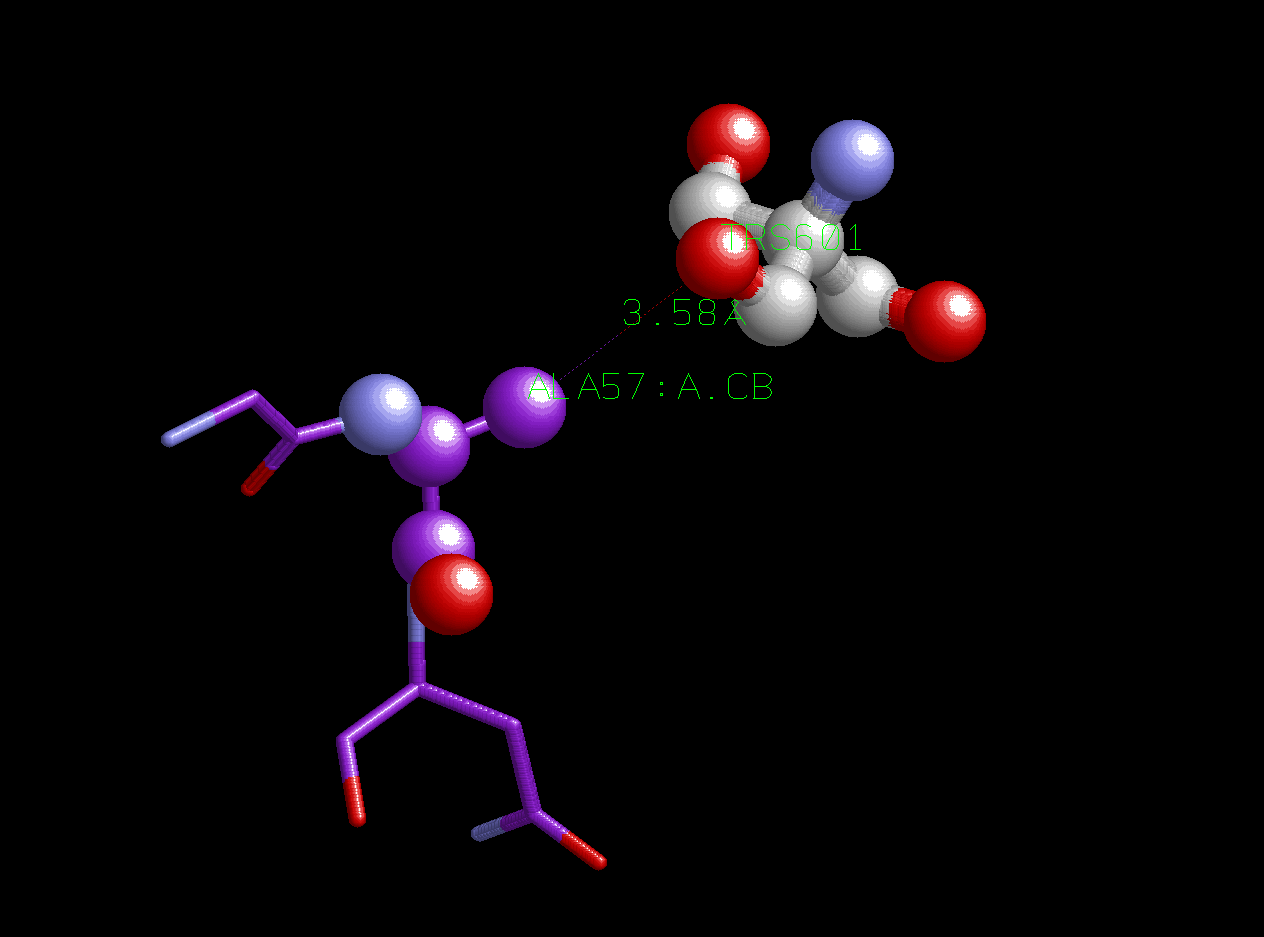
Метильная группа аланина контактирует с ОН-группой спирта. Это довольно странно, потому что гидроксильная группа является полярной группой, метильная группа аланина же, наоборот, неполярна. Однако столь маленькое расстояние между ними говорит о том, что контакт (показанный пунктирной линией) имеет место. Проволочной моделью меньшего размера показаны два прилегающих к аланину остатка полипептидной цепи А белка (166 и 168). Фиолетовым цветом обозначены атомы углерода остатков полипептидной цепи, серым - атомы углерода лиганда, красным - атомы кислорода, синим - атомы азота. Этот рисунок может быть получен с помощью скрипта ligandandala.spt.
Открыть рисунок в отдельном окне
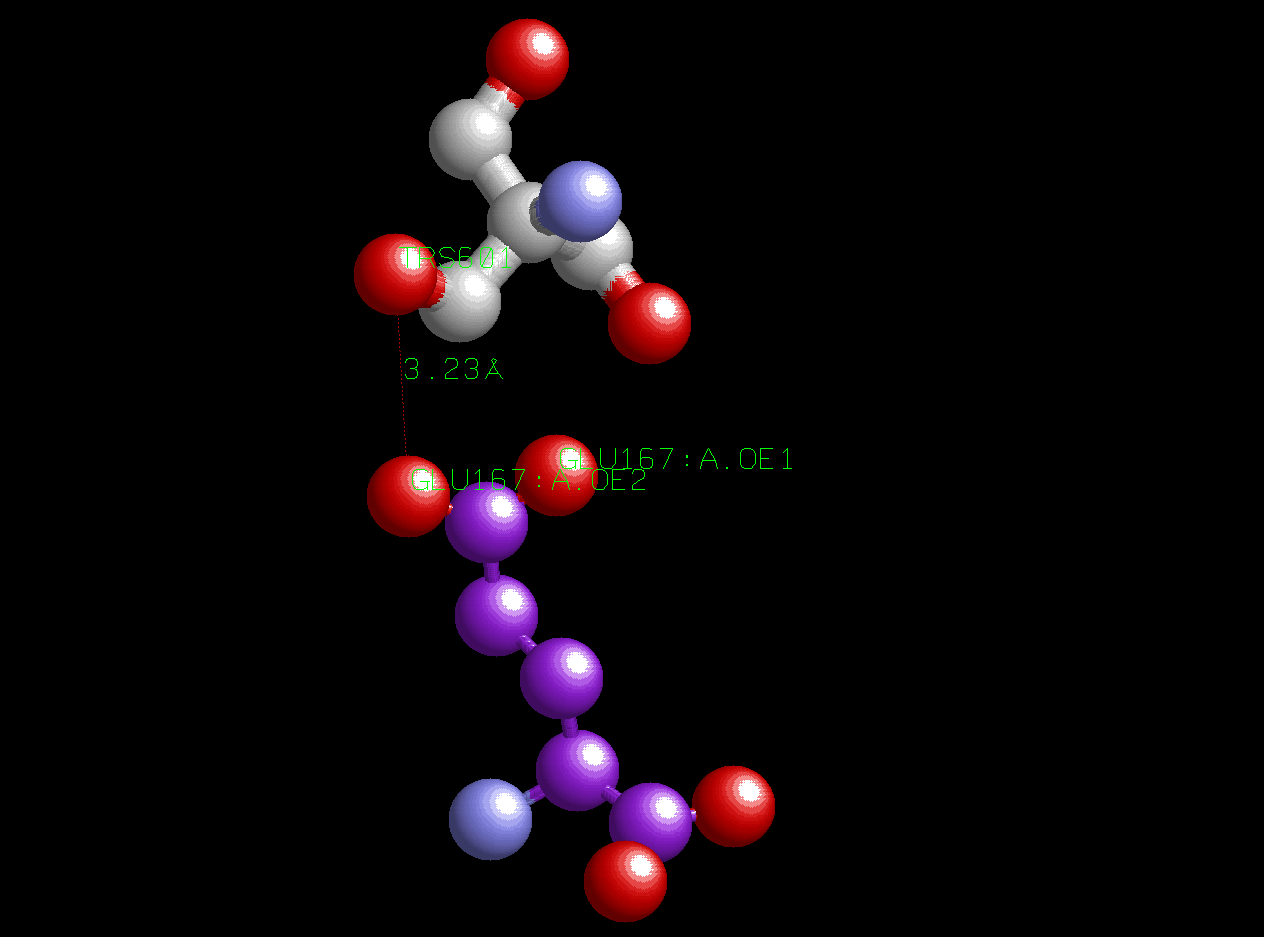
Фиолетовым цветом обозначены атомы углерода остатка полипептидной цепи, серым - атомы углерода лиганда, красным - атомы кислорода, синим - атомы азота. Карбоксильная группа 167-го аминокислотного остатка контактирует с гикроксильными группами 2-амино-2-гидроксиметил-пропан-1,3-диола. Это вполне объяснимо, ведь контактируют полярные группы, способные образовывать между собой водородные связи. Расстояние от одного кислорода глутаминовой кислоты (OE2) до гидроксильной группы лиганда - 3,23 ангстрем; расстояние от другого кислорода глутаминовой кислоты (OE1) до другой гидроксильной группы лиганда (на картинке расположенной справа) - 3,28 ангстрем. Интересно то, что аминогруппа лиганда расположена от кислорода OE1 на расстоянии всего 4,01 ангстрем. Это говорит о том, что между ними, вполне возможно, образовалась ионная связь (электростатическое взаимодействие). Этот рисунок можеть быть получен с помощью скрипта ligandandglu.spt.
Открыть рисунок в отдельном окне