
Открыть рисунок в отдельном окне

Открыть рисунок в отдельном окне
Открыть рисунок в отдельном окне
Элемент вторичной структуры белка DPS_ECOLI

| Так выглядит выбранный мною элемент вторичной структуры полипептидной цепи - альфа-спираль Asn58-Leu87 - на фоне всей полипептидной цепи. Это самая длинная альфа-спираль полипептидной цепи: она состоит из 7 с половиной витков. Данная альфа-спираль может быть выделена с помощью скрипта vtor.spt. Открыть рисунок в отдельном окне |

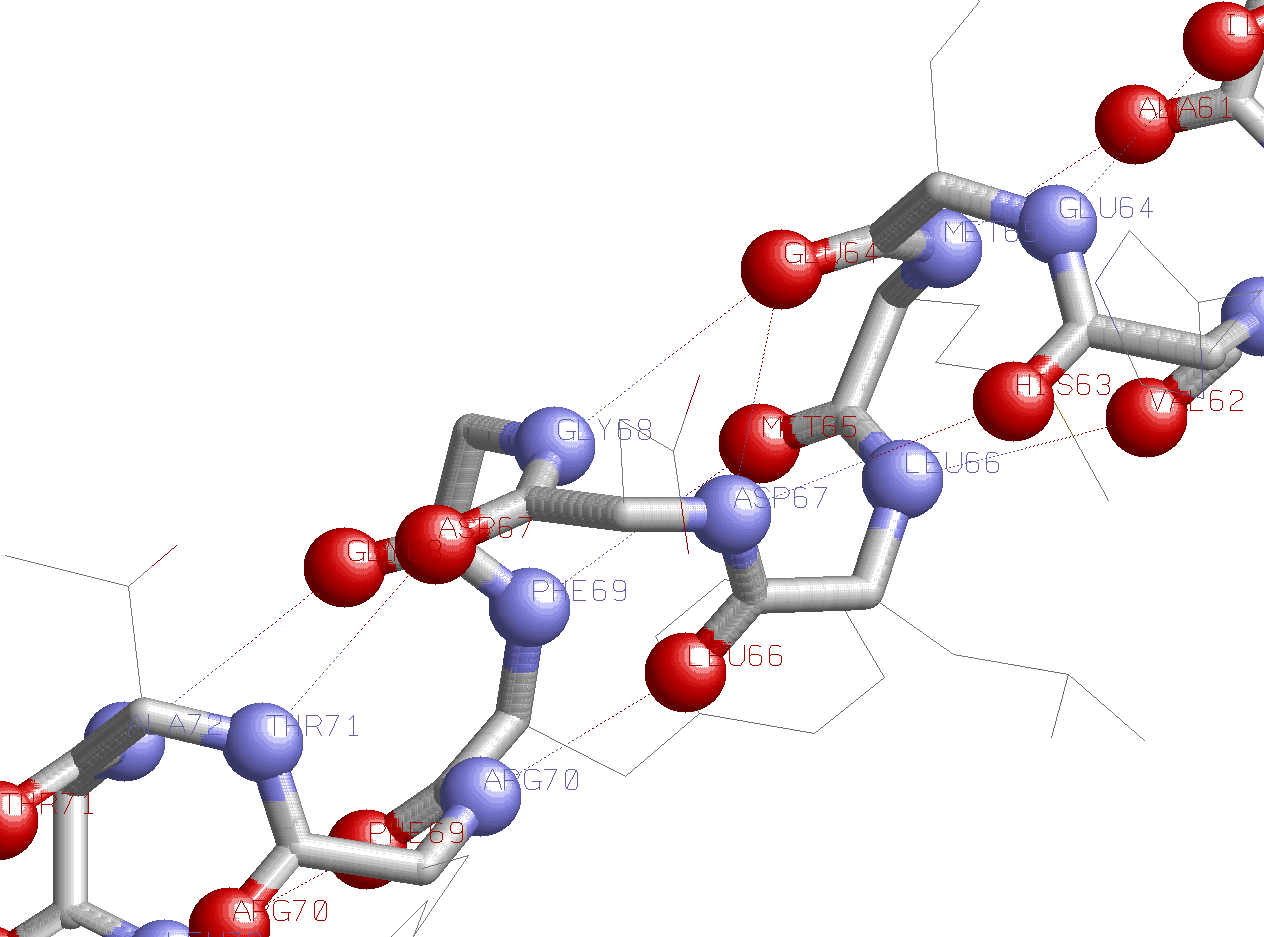
| На рисунке представлена одна альфа-спираль (Asn58-Leu87) белка DPS E.coli. Синими кружками отмечены атомы азота остовной цепи, красным - атомы кислорода остовной цепи, пунктирными линиями - водородные связи между кислородами и азотами остовной цепи. Данный рисунок может быть получен с помощью скрипта alpha.spt. Открыть рисунок в отдельном окне |

| С помощью рисунка можно сформулировать правило образования водородных связей в альфа-спирали белка. В типе водородная связь образуется между карбонильным остовным кислородом n-го остатка и амидным остовным азотом (n+4)-го остатка. Кроме того, важно заметить, что номера остатков, кислород (азот) которых образует водородную связь, идут в порядке возрастания с шагом, равным единице. Кроме того, имеются атомы кислорода (азота) остова, образующие водородные связи сразу с двумя атомами азота (кислорода) остова (например, кислород остатка Glu64 образует водородную связь с азотом остатка Asp67 и остатка Gly68). Тогда если кислород принадлежит остатку с номером n, то один из азотов принадлежит остатку (n+4) (согласно правилу), а второй принадлежит остатку (n+3). Открыть рисунок в отдельном окне |
Назад