
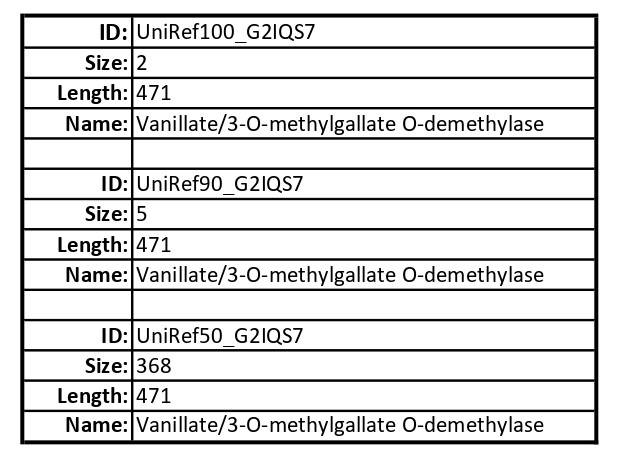
Информация о белке. Ванилат/3-О-метилгалат-О-деметилаза — это фермент, участвующий в превращении ванилата и 3-О-метилгалата в протокатехат и галат соответственно [1]. Этот фермент относится к классу метилтрансфераз, то есть способствует переносу метильной группы от одной молекулы к другой. Перечисленные выше соединения — важные участники метаболизма лигнина, который является компонентом клеточной стенки древесных растений [2].
Информация об организме. Выданный белок был выделен из Sphingomonas paucimobilis SYK-6. Это один из штаммов бактерий, который обрёл способность получать углерод из различных природных ароматических соединений [3]. В частности, Sphingomonas paucimobilis SYK-6 хорошо развивается на различных субратах, содержащих соединения лигнина [2]. В природе Sphingomonas paucimobilis широко распространена в воде и почве как строго аэробная грамотрицательная бактерия, способная заражать и человека [4].

name:vanillate name:demethylase taxonomy:"Alphaproteobacteria [28211]" NOT taxonomy:"Sphingomonadales [204457]"name:vanillate name:demethylase existence:"Evidence at protein level [1]"name:vanillate NOT name:demethylase NOT (taxonomy:"Bacteria [2]" OR taxonomy:"Fungi [4751]")
Да, такой белок встречается у английского дуба, что вполне логично, так как древесные растения синтезируют лигнин для встраивания в клеточную стенку. Неожиданно, что запись по этому запросу была одна и аннотирована вручную.
Протеом бактерии, которой принадлежит исследуемый белок, является референсным с общим количеством белков, равным 4057 (десять из них имеют записи в Swiss-Prot*), и имеет идентификатор UP000001275. В качестве
второго протеома взять протеом Sphingobium japonicum (strain DSM 16413 / CCM 7287 / MTCC 6362 / UT26 / NBRC 101211 / UT26S), включающий 4348 белков (девять из которых включены в Swiss-Prot) и имеющий
идентификатор UP000007753. Был выбран именно этот протеом, так как это таксономически очень близкие организмы, но, в отличие от Sphingomonas paucimobilis SYK-6,
Sphingobium japonicum (strain DSM 16413 / CCM 7287 / MTCC 6362 / UT26 / NBRC 101211 / UT26S) перерабатывает не лигнин, а гексахлорциклогексан — вещество, широкоприменяемое в сеьском хозяйстве для борьбы с насекомыми-вредителями. Обоим протеомам CPD присвоил категорию Standart, а согласно BUSCO доли дуплицированных, фрагментированных или отсутствующих генов пренебрежимо мало.
Протеомы скачаны командами:
wget 'https://www.uniprot.org/uniprot/?query=organism:627192&format=txt&compress=yes' -O UP000001275.swiss.gz
wget 'https://www.uniprot.org/uniprot/?query=organism:627192&format=txt&compress=yes' -O UP000007753.swiss.gz
Сравнение протеомов. Будем искать в протеомах трансмембранные белки и ферменты. В качестве дополнительной группы рассмотрим белки, которые могут иметь некоторое отношение к хлору, ведь именно перерабатываемыми соединениями отличаются наши объекты.
Будем искать трансмембранные белки по ключевому слову в строках KW с помощью конвейера команд:
zgrep '^KW' UP*.swiss.gz | grep 'Transmembrane' | wc -l
Чтобы найти количество ферментов, отберём записи с EC (Enzyme Classification). Попробуем избежать подсчёта одной и той же записи несколько раз, так как в пределах записи и даже полей DE данная информация может встретиться несколько раз:
zgrep '^DE' UP*.swiss.gz | grep 'EC=' | sort -u | wc -l
Найдём записи, описание которых содержит сокращение "chlor", чтобы найти белки, потенциально связанные с катаболизмом хлорпроизводных:
zgrep '^DE' UP*.swiss.gz | grep 'chlor' | wc -l
Полученные данные соберём в таблицу (Табл. 3).
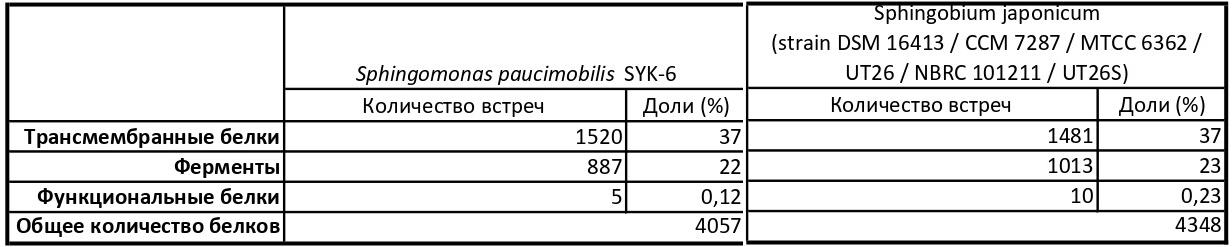
Видим, что по количеству и долям трансмембранных белков и ферментов протеомы очень схожи. Отличие наблюдается в функциональных группах: Sphingobium japonicum (strain DSM 16413 / CCM 7287 / MTCC 6362 / UT26 / NBRC 101211 / UT26S) имеет больше белков, имеющих какое-то отношение к хлорпроизводным. Этим можно объяснить отсутствие способности у Sphingomonas paucimobilis SYK-6 перерабатывать гексахлоргексан. Думаю, что подобный подсчёт числа встреч сильно зависит от качества аннотации. Например, мы искали трансмембранные белки по полям KW, куда информация поступает из нуклеотидных баз данных; если запись проверена вручную, то ключевых слов будет гораздо больше.
Ещё проведём сравнение протеомов по количеству ферментов, принадлежащих разным классам. Сделаем это с помощью конвейера:
zgrep '^DE' UP*.swiss.gz | grep 'EC=' | sort -u | tr '=' '\t' | cut -f2 | cut -f1 -d. | sort -n | uniq -c
Результаты оформим в виде таблицы (Табл. 4).
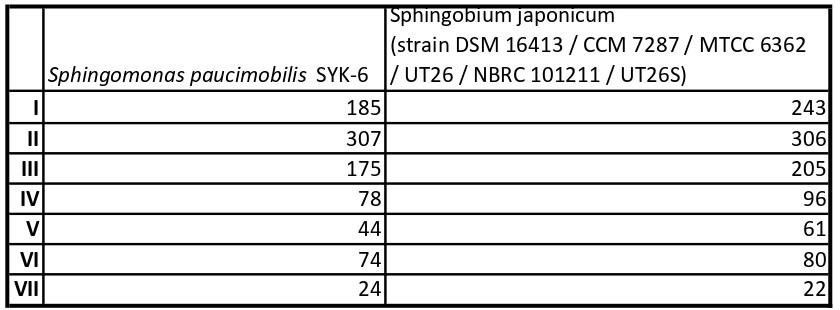
Можно заметить, что протеомы существенно различаются по количеству оксидоредуктаз и гидролаз. Это может свидетельствовать о том, что среди этих ферментов есть такие, которые, например участвую в разрыве связи С-Сl и дальнейнем метаболизме хлора.
[1] A Tetrahydrofolate-Dependent O-Demethylase, LigM, Is Crucial for Catabolism of Vanillate and Syringate in Sphingomonas paucimobilis SYK-6 DOI:https://doi.org/10.1128/JB.187.6.2030-2037.2005
[2] Genetic and Biochemical Characterization of a 2-Pyrone-4,6-Dicarboxylic Acid Hydrolase Involved in the Protocatechuate 4,5-Cleavage Pathway of Sphingomonas paucimobilis SYK-6 DOI:https://doi.org/10.1128/JB.181.1.55-62.1999
[3] Structure of aryl O-demethylase offers molecular insight into a catalytic tyrosine-dependent mechanism DOI:https://doi.org/10.1073/pnas.1619263114
[4] Infections with Pseudomonas paucimobilis: Report of Four Cases and Review DOI:https://doi.org/10.1093/clinids/13.6.1072